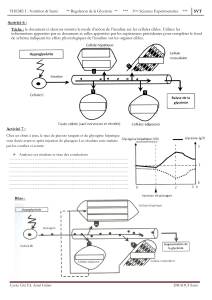
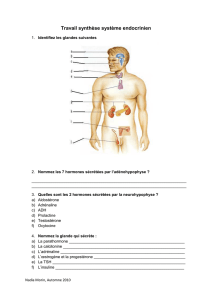
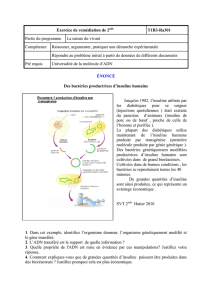
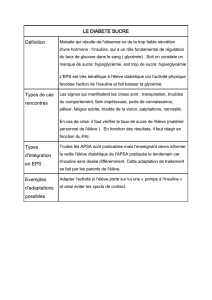
HUMULINE 30/70 RESUME ABREGE DES CARACTERISTIQUES
publicité

HUMULINE 30/70 RESUME ABREGE DES CARACTERISTIQUES DU PRODUIT 1. DENOMINATION DU MEDICAMENT Humuline Regular Cartridge 100 UI/ml solution injectable en cartouche Humuline NPH Cartridge 100 UI/ml suspension injectable en cartouche Humuline 30/70 Cartridge 100 UI/ml suspension injectable en cartouche 2. COMPOSITION QUALITATIVE ET QUANTITATIVE 1 ml contient 100 UI d’insuline humaine (produite dans E. coli par la technique de l’ADN recombinante). Une cartouche d’Humuline Regular contient 3 ml équivalent à 300 UI d’insuline soluble. Une cartouche d’Humuline NPH contient 3 ml équivalent à 300 UI d’insuline isophane. Une cartouche d’Humuline 30/70 contient 3 ml équivalent à 300 UI d’insuline biphasique isophane composée de 30 % d’insuline soluble et de 70 % d’insuline isophane. Pour la liste complète des excipients, voir rubrique 6.1. 3. FORME PHARMACEUTIQUE Solution ou suspension injectable en cartouche. Humuline Regular est une solution aqueuse stérile, limpide, incolore d’insuline humaine. Humuline NPH est une suspension stérile formée d’un précipité blanc cristallisé, d’insuline humaine isophane dans un tampon phosphate isotonique. Humuline 30/70 est une suspension stérile d’insuline humaine composée de 30% d’insuline soluble et de 70% d’insuline isophane. 4. DONNEES CLINIQUES 4.1 Indications thérapeutiques Traitement des patients atteints de diabète insulino-dépendant ou insulino-nécessitant, pour maintenir un équilibre glycémique normal. 4.2 Posologie et mode d’administration La posologie est déterminée par le médecin, selon les besoins du patient. Humuline Regular doit être administrée par injection sous-cutanée et peut également, bien que ce ne soit pas conseillé, être administrée par injection intramusculaire. Cette préparation peut également être administrée par voie intraveineuse. Humuline NPH et Humuline 30/70 doivent être administrées par injection sous-cutanée et peuvent également, bien que ce ne soit pas conseillé, être administrées par injection intramusculaire. Ces préparations ne doivent pas être administrées par voie intraveineuse. L’administration souscutanée doit être effectuée dans le haut des bras, les cuisses, les fesses ou l’abdomen. Les points d’injection doivent varier afin de ne pas utiliser le même point d’injection plus d’une fois par mois environ. Lors de l’injection de toute préparation d’insuline Humuline, s’assurer que l’aiguille n’a pas pénétré dans un vaisseau sanguin. Après l’injection, ne pas masser le point d’injection. Les patients doivent être formés pour utiliser une technique d’injection correcte. Humuline 30/70 est un mélange préétabli et prêt à l’emploi contenant de l’insuline sous forme d’insuline soluble et d’insuline isophane, spécialement conçu pour que le patient n’ait pas à préparer son mélange d’insulines. Le schéma thérapeutique de chaque patient doit être établi en fonction de ses besoins métaboliques propres. Chaque boîte contient une notice d’information contenant des instructions pour pratiquer l’injection d’insuline. 4.3 Contre-indications Hypoglycémie. Hypersensibilité à l’Humuline ou à l’un des excipients, sauf dans le cadre d’un programme de désensibilisation. Les préparations d’Humuline ne peuvent en aucun cas être administrées par voie intraveineuse, à l’exception d’Humuline Regular. 4.8 Effets indésirables L’hypoglycémie est l’effet indésirable le plus fréquent lors du traitement insulinique chez le patient diabétique. L’hypoglycémie sévère peut entraîner la perte de connaissance allant, dans des cas extrêmes, jusqu’à la mort. Aucune fréquence spécifique d’hypoglycémie n’est donnée étant donné que l’hypoglycémie résulte à la fois de la dose d’insuline et d’autres facteurs tels le régime alimentaire et l’intensité de l’activité physique du patient. Une allergie locale est un symptôme fréquent (1/100 à < 1/10). Une rougeur, un œdème et des démangeaisons peuvent se manifester au point d’injection. Cette réaction disparaît habituellement en quelques jours, voire quelques semaines. Dans certains cas, ces réactions peuvent être liées à des facteurs autres que l’insuline, tels que des produits irritants contenus dans le désinfectant cutané ou une mauvaise technique d’injection. L’allergie systémique, qui est très rare (< 1/10.000) mais potentiellement plus grave, correspond à une allergie généralisée à l’insuline. Elle peut entraîner une éruption généralisée sur tout le corps, une dyspnée, une respiration sifflante, une baisse de la pression artérielle, une accélération du pouls ou des sueurs. Les cas sévères d’allergie généralisée peuvent menacer le pronostic vital. Dans les rares cas d’allergie sévère à Humuline, un traitement doit être instauré immédiatement. Un changement d’insuline ou une désensibilisation peut être nécessaire. Une lipodystrophie au site d’injection est un symptôme peu fréquent (1/1.000 à < 1/100). Des cas d’œdèmes ont été rapportés lors du traitement par insuline, en particulier si un mauvais contrôle métabolique préalable est amélioré par une insulinothérapie intensive. 6. DONNEES PHARMACEUTIQUES 6.1 Liste des excipients Humuline Regular : Le métacrésol, le glycérol et l’eau pour injection. L’hydroxyde de sodium ou l’acide chlorhydrique peuvent avoir été utilisés pour ajuster le pH. Humuline NPH et Humuline 30/70 : Le métacrésol, le glycérol, le phénol, le sulfate de protamine, le phosphate de sodium dibasique, l’oxyde de zinc, l’eau pour injection. L’hydroxyde de sodium ou l’acide chlorhydrique peuvent avoir été utilisés pour ajuster le pH. 7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE ELI LILLY BENELUX s.a. Rue du Marquis 1 1000 Bruxelles Belgique 8. NUMEROS D’AUTORISATION DE MISE SUR LE MARCHE Humuline Regular Cartridge 100 UI/ml solution injectable en cartouche: BE 178175 Humuline NPH Cartridge 100 UI/ml suspension injectable en cartouche: BE 178166 Humuline 30/70 Cartridge 100 UI/ml suspension injectable en cartouche: BE 178141 9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 25.04.2006 10. DATE DE MISE A JOUR DU TEXTE 01.2013 Date d’approbation : 04/2013. STATUT LEGAL DE DELIVRANCE Médicament soumis à prescription médicale. HUMALOG MIX25 RESUME DES CARACTERISTIQUES DU PRODUIT 1.DENOMINATION DU MEDICAMENT : Humalog Mix25 100 UI/ml KwikPen, suspension injectable ; Humalog Mix50 100 UI/ml KwikPen, suspension injectable 2.COMPOSITION QUALITATIVE ET QUANTITATIVE 2.1Description générale : Humalog Mix25 et Humalog Mix50 sont des suspensions stériles et de couleur blanche. 2.2Composition qualitative et quantitative Un ml contient 100 UI (équivalent à 3,5 mg) d’insuline lispro (ADN d’origine recombinante produite par E. Coli). Chaque conditionnement contient 3 ml équivalent à 300 UI d’insuline lispro. Humalog Mix25 contient 25 % d’insuline lispro en solution et 75 % d’insuline lispro protamine en suspension. Humalog Mix50 contient 50 % d’insuline lispro en solution et 50 % d’insuline lispro protamine en suspension. Pour la liste complète des excipients, voir rubrique 6.1. 3.FORME PHARMACEUTIQUE Suspension injectable. 4.DONNEES CLINIQUES 4.1.Indications thérapeutiques : Humalog Mix25 et Humalog Mix50 sont indiqués pour le traitement des patients atteints de diabète nécessitant un traitement par insuline pour maintenir un équilibre glycémique normal. 4.2.Posologie et mode d’administration : La posologie est déterminée par le médecin, selon les besoins du patient. Humalog Mix25 et Humalog Mix50 peuvent être administrés peu de temps avant les repas. Quand cela est nécessaire, Humalog Mix25 et Humalog Mix50 peuvent être administrés juste après les repas. Humalog Mix25 et Humalog Mix50 doivent être administrés par injection sous-cutanée stricte. En aucun cas Humalog Mix25 et Humalog Mix50 ne doivent être administrés par voie intraveineuse. L’administration sous-cutanée doit être effectuée dans les bras, les cuisses, les fesses ou l’abdomen. Les points d’injection doivent varier afin de ne pas utiliser le même point d’injection plus d’une fois par mois environ. Lors de l’injection sous-cutanée d’Humalog Mix25 et Humalog Mix50, s’assurer que l’aiguille n’a pas pénétré dans un vaisseau sanguin. Après injection, ne pas masser le point d’injection. Les patients doivent être éduqués pour utiliser une technique d’injection correcte. La rapidité d’action et le pic d’activité précoce propres à Humalog lui-même sont observés après administration sous-cutanée d’Humalog Mix25 et Humalog Mix50. Ceci permet d’administrer une injection d’Humalog Mix25 et Humalog Mix50 à un moment proche des repas. La durée d’action de la composante insuline lispro protamine en suspension (basale) dans Humalog Mix25 et Humalog Mix50 est proche de celle d’une insuline basale (isophane). L’évolution dans le temps de l’action de toute insuline peut varier de façon importante d’un sujet à un autre, ou à différents moments chez le même sujet. Comme pour toutes les préparations d’insuline, la durée d’action d’Humalog Mix25 et Humalog Mix50 dépend de la dose, du site d’injection, de la vascularisation, de la température et de l’activité physique. 4.3.Contre-indications Hypersensibilité à l’insuline lispro ou à l’un de ses composants.Hypoglycémie. 4.8.Effets indésirables L’hypoglycémie est l’effet indésirable le plus fréquent lors du traitement insulinique chez le patient diabétique. L’hypoglycémie sévère peut entraîner la perte de connaissance allant, dans des cas extrêmes, jusqu’à la mort. L’hypoglycémie pouvant résulter à la fois d’un excès d’insuline et d’autres facteurs tels que l’apport alimentaire et la dépense énergétique, aucune fréquence de survenue des hypoglycémies ne peut être présentée. L’allergie locale est fréquente (1/100 à <1/10). Une rougeur, un oedème et des démangeaisons peuvent survenir au point d’injection. Cette réaction, habituellement, disparaît en quelques jours voire quelques semaines. Dans certains cas, cette réaction peut être liée à des facteurs autres que l’insuline, tels que des produits irritants contenus dans le désinfectant cutané ou une mauvaise technique d’injection. L’allergie générale, qui est rare (1/10 000 à <1/1 000) mais potentiellement plus grave, correspond à une généralisation de l’allergie à l’insuline. Elle peut entraîner une éruption généralisée sur tout le corps, une dyspnée, une respiration sifflante, une baisse de la pression artérielle, une accélération du pouls ou une transpiration. Les cas sévères d’allergie généralisée peuvent menacer le pronostic vital.Une lipodystrophie au site d’injection est peu fréquente (1/1 000 à < 1/100). Des cas d’oedèmes ont été rapportés lors du traitement par insuline, en particulier si un mauvais contrôle métabolique précédent est amélioré par une insulinothérapie intensifiée. 7.TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE : Eli Lilly Nederland B.V, Grootslag 1-5, 3991 RA Houten, Pays-Bas 8.NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE : EU/1/96/007/033 5 stylos de 3 ml Humalog Mix25 100 UI/ml KwikPen.EU/1/96/007/034 Emballage multiple de 2 boîtes de 5 stylos de 3 ml Humalog Mix25 100 UI/ml KwikPen. EU/1/96/007/035 5 stylos de 3 ml Humalog Mix50 100 UI/ml KwikPen. EU/1/96/007/036 Emballage multiple de 2 boîtes de 5 stylos de 3 ml Humalog Mix50 100 UI/ml KwikPen. 9. STATUT LEGAL DE DELIVRANCE : Médicament soumis à prescription médicale. 10.DATE DE PREMIERE AUTORISATION / DE RENOUVELLEMENT DE L’AUTORISATION Date de première autorisation : 30 avril 1996 Date du dernier renouvellement : 30 avril 2006 11.DATE DE MISE A JOUR DU TEXTE avril 2011 La notice d’Humalog® Mix25® cartouche est disponible sur demande au service Médical de Lilly Benelux (02/548 84 94).