Le rétrécissement aortique valvulaire

1
Le rétrécissement aortique valvulaire
J-Ph LESBRE – CHU Amiens - K. ISAAZ - CHU St Etienne
------
C’est la plus fréquente des valvulopathies puisqu’elle représente 25 à
30% d’entre elles.
A partir d’études échographiques portant sur plus de 5000 patients
âgés de 65 ans et plus, Stewart estime sa prévalence à 2% montant à 4% au-delà de 85
ans.
L’écho Doppler occupe une place prépondérante dans son diagnostic,
et a totalement supplanté l’hémodynamique.
L’intervention ne doit être proposée que lors de l’apparition des
premiers signes fonctionnels.
Rappelons enfin que la surface normale de la valve aortique est de 2.5
à 3.5 cm².
- qu’il y a apparition d’un souffle lorsque la surface diminue de 25%
- qu’il y a apparition d’un gradient de pression lorsque la surface est
<1.5 cm²,
- enfin qu’il y a apparition de signes fonctionnels et que l’on parle de
RA chirurgical lorsque la surface est inférieure à 1 cm² et le gradient moyen
50 mmHg.

2
I/ ETIOLOGIES ET ANATOMOPATHOLOGIE
Le rétrécissement aortique valvulaire peut être congénital (RA
congénital en dôme) ou acquis : cas le plus fréquent.
A - RA congénital
Dans la forme uni ou tricuspide , il ne représente guère que 4% dans
les séries chirurgicales de l’adulte, en particulier la série de 300 cas publiée par ACAR.
Ici, la valve est transformée en un diaphragme bombant, percée en son centre d’un
orifice plus ou moins étroit “ en gicleur ”.
En revanche, dans sa forme bicuspide, il est fréquent puisque
représentant 26 % dans la série de ACAR. Elle représente 26% dans la série de ACAR.
La bicuspidie est une malformation très fréquente puisque touchant
1% de la population. Cette malformation conduit à une “ usure ” plus rapide des valves
en raison d’une ouverture incomplète créant des turbulences favorisant fibrose et
calcification précoces. Cette forme touche les sujets un peu plus jeunes, et va se
traduire par l’apparition d’un souffle vers la cinquantaine, il y a pratiquement toujours
association d’une fuite aortique, car la mauvaise qualité des cusps s’accompagne d’un
prolapsus de la plus grande d’entre elles.
B - RA acquis
1 - RA dégénératif ou maladie de Monckeberg
Il représente 56% dans la série d’ACAR. Il n’y a pas de symphyse
commissurale, mais des calcifications d’évolution centripète, débutant au niveau de
l’anneau aortique pour gagner le bord libre des sigmoïdes. Ces calcifications peuvent
devenir proliférantes, massives, en chou fleur, et gagner la racine de la grande valve
mitrale, et le septum à l’origine de troubles de conduction.
Cette maladie n’est observée que chez les patients âgés de plus de 70
ans, habituellement hypertendus. L’orifice est transformé en un dé filé de quelques mm
de diamètre, à la fois rétréci et incontinent.
L’hypertension, l’hypercholestérolémie, et surtout, l’insuffisance
rénale dialysée constituent des facteurs favorisants principaux de ce RA dégénératif.

3
2- Etiologie rhumatismale
Elle représente 14% dans la série de ACAR.
Elle est identifiable au plan anatomique comme échographique par
l’existence d’une symphyse commissurale centripète allant de la périphérie à la partie
centrale.
Les valves sont à la fois rétractées et épaissies par fibrose cicatricielle.
L’orifice résiduel est triangulaire et central, les calcifications apparaissent sur la face
valvulaire des commissures. L’évolution sténosante est lente, et il faut 10 à 20 ans pour
constituer une sténose aortique (évolution plus lente que pour l’orifice mitral).
Il y a bien souvent association d’atteinte mitrale.
3 - Les causes plus rares sont représentées par
. la maladie de Paget
. la polyarthrite rhumatoïde
. l’ochronose
C - Lésions extravalvulaires
L’aorte ascendante est dilatée et le maximum de dilatation intéresse le
bord droit de l’aorte ascendante entre 3 et 5 cm au-dessus du plancher sigmoïdien, au
point d’impact du jet.
Cette dilatation est asymétrique et peut être anévrysmale, et exige un
changement de l’aorte ascendante quand le diamètre dépasse 50 mm.
Le ventricule gauche est le siège d’une hypertrophie ventriculaire
gauche concentrique sans dilatation cavitaire, avec forte augmentation de l’épaisseur
pariétale comprise entre 12 et 20 mm.
Rappelons que la finalité de cette hypertrophie est de normaliser la
contrainte pariétale régie par la loi de Laplace : t = pression X rayon/épaisseur.
Les coronaires sont volontiers augmentées de calibre mais pas au
prorata du degré d’hypertrophie ventriculaire gauche. Il y a donc là le substrat de
l’insuffisance coronarienne fonctionnelle.
Elles peuvent être dans ¼ des cas environ le siège d’une athéromatose
significative, dans 8% des cas, on retrouve des stigmates anatomiques d’embolie
coronarienne (Normand).
La valve mitrale est elle même, dans plus de la moitié des cas, le siège
de calcifications annulaires prédominant au niveau de la racine de la petite valve.
Ces calcifications peuvent être à l’origine de sténoses mitrales dites
“ extrinsèques ” parce que respectant les commissures et engainant la face ventriculaire
des feuillets mitraux.

4
II/ PHYSIOPATHOLOGIE
La sténose produit un obstacle fixe à l’éjection du ventricule gauche.
Il apparaît un gradient de pression holosystolique entre le ventricule
gauche à pression élevée et l’aorte ascendante à pression normale ou basse.
Les conséquences anatomiques sont l’hypertrophie concentrique du
ventricule gauche avec masse myocardique augmentée (Loi de Laplace). Le ventricule
garde des dimensions internes normales, s’il n’y a pas de fuite significative associée.
Conséquences sur les flux : le flux aortique est propulsé à très haute
vitesse, en particulier au niveau du jet central laminaire qui peut atteindre 4 à 6 m/sec.
dans les sténoses aortiques serrées chirurgicales voisines de 0.75 cm².
Le débit cardiaque au repos est conservé, en particulier pendant toute
la phase compensée où l’augmentation de tension pariétale est compensée par une
diminution du rayon et une augmentation de l’épaisseur de la paroi ventriculaire
gauche.
Les signes fonctionnels sont la conséquence directe de l’obstruction :
syncope et angor d’effort.
A la phase décompensée, le débit cardiaque au repos est diminué, et
apparaissent alors la dyspnée d’effort puis la dyspnée de repos.

5
III- CLINIQUE
Il faut souligner la très longue latence fonctionnelle du rétrécissement
aortique qui ne “ parlera ” que lorsque la surface devient inférieure à 1 cm².
Dans la maladie de Monckeberg, c’est par le jeu des calcifications que
l’évolution s’opère dans le sens de l’aggravation de la sténose et de l’apparition des
signes fonctionnels.
- L’angor d’effort s’observe dans ¾ des cas de rétrécissement aortique
sévère. Il correspond au plan physiopathologique dans le ¾ des cas à une insuffisance
coronarienne fonctionnelle ; dans 25% des cas, il correspond à une insuffisance
coronarienne organique.
- Syncopes d’effort : elles s’observent dans 40% des cas de RA sévère.
Elles sont souvent révélatrices de la maladie, car elles amènent à consulter.
Elles peuvent être remplacées par des équivalents mineurs :
étourdissements, vertiges, instabilité déclenchés par des efforts physiques significatifs.
Au plan physiopathologique, elles correspondent à l’absence d’augmentation du débit
cardiaque à l’effort par conséquence de la sténose valvulaire fixe et à la redistribution
du débit cardiaque au niveau des masses musculaires actives quadricipitales au
détriment de la sphère céphalique.
C’est donc par le biais de l’ischémie cérébrale d’effort que surviennent
syncope et étourdissement.
- La dyspnée d’effort est un signe révélateur fréquent observé dans un
tiers des cas. Elle s’explique par la dysfonction diastolique, conséquence de la forte
hypertrophie ventriculaire gauche. C’est pourquoi, elle peut précéder en fait de
plusieurs années la dyspnée de repos ou l’oedème aigu du poumon qui est retrouvé
dans un tiers des cas de rétrécissements aortiques chirurgicaux.
Les données de l’examen physique :
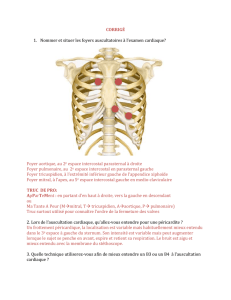
. la présence d’un souffle systolique éjectionnel, c’est à dire
mésosystolique ne couvrant pas toute la systole, séparée de B1 et de B2 par une césure,
crescendo decrescendo, maximum au foyer aortique et irradiant sur les vaisseaux du
cou de tonalité rude, râpeuse, serratique, associée à une extinction franche du 2ème
bruit par immobilité des sigmoïdes aortiques pétrifiées.
Le pouls aux 4 membres est petit, difficile à percevoir : “ pulsus
parvus et tardus ” des anciens auteurs. L’existence d’un thrill sera recherchée
systématiquement au niveau du foyer aortique principal : il n’existe que pour des
sténoses chirurgicales à gradient élevé > à 70 mmHg.
On recherche des signes de stase pulmonaire : absent à ce stade. La
tension artérielle est normale sans augmentation de la différentielle ou élevée :
l’hypertension favorisant la génèse du RA.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%