ESD 2010 - ESPE Toulouse

1
AGREGATION BLANCHE CONCOURS INTERNE ET CAER (Toulouse)
COMPOSITION À PARTIR D’UN DOSSIER
Durée : 5 heures
L’usage de tout ouvrage de référence, de tout dictionnaire et de tout matériel électronique est
rigoureusement interdit.
La respiration
L'invention de la physiologie respiratoire est tout d'abord le fait de chimistes qui, dès le XVIII
ème
siècle,
s'attachent à caractériser les gaz atmosphériques. C'est ainsi que, grâce à Lavoisier, « l'air
déphlogistiqué » devient l'oxygène. Au XIX
ème
siècle et dans la première moitié du XX
ème
siècle, les
avancées de cette jeune discipline seront indissociables des progrès techniques qui fourniront à
d'éminents savants (F Bert, H. A. Krebs, etc.) des appareillages de plus en plus sophistiqués pour
caractériser les échanges gazeux respiratoires, tout d'abord à l'échelle de l'organisme entier puis à celle
de la cellule. Cette même période verra également progresser la compréhension des mécanismes
nerveux qui, à chaque instant, contrôlent le rythme et l'intensité des cycles inspiration / expiration et
permettent d'adapter la ventilation pulmonaire aux conditions dans lesquelles l'organisme évolue.
« L’invention de la physiologie 100 expériences historiques » Rémi Cadet
QUESTION 1 : (8 points)
On entend par respiration l’ensemble des processus assurant l’apport d’O
2
aux cellules, l’élimination du
CO
2
vers le milieu extérieur ainsi que les mécanismes intracellulaires de l’utilisation de l’O
2
et de la
production du CO
2
à des fins énergétiques.
Montrez comment, au collège et au lycée, se construisent progressivement les différents aspects
de la respiration. Pour chacune des parties de programme concernées, vous indiquerez les documents
du dossier que vous utiliseriez, tels quels ou modifiés. Vous rédigerez le contenu notionnel apporté par
chacun d’eux, tel qu’il pourrait figurer dans la trace écrite des élèves.
QUESTION 2 : (8 points)
Dans le cadre du programme 5
ème
, vous proposerez une séance de travaux pratiques
permettant d’établir l’unité de la respiration.
Vous préciserez l’organisation de la séance et vous prévoirez, dans cette séance, des aides pour
différencier le travail dans la classe. Vous indiquerez les critères de réussite et les productions
attendues.
QUESTION 3 : (4 points)
A partir des documents de votre choix, vous élaborerez une évaluation sommative correspondant à
l’évaluation des capacités expérimentales du baccalauréat S portant sur le processus
respiratoire.
Vous proposerez une grille d’évaluation adaptée accompagnée de son barème.

2
Documents du dossier
Certains documents fournis sont issus de manuels scolaires dont le niveau est précisé. Les candidats
sont libres d’exploiter ces documents pour travailler à un autre niveau que celui indiqué et d’apporter
éventuellement les modifications ou compléments qu’ils jugeront nécessaires.
Chaque document peut, si on le souhaite, être utilisé pour répondre à plusieurs questions.
Document 1 : relation entre rythme cardiaque, rythme respiratoire et consommation en
dioxygène page 3/11
Document 2 : la quantification du métabolisme page 3/11
Document 3 : les échanges gazeux d’un organisme vivant page 4/11
Document 4 : les risques du tabagisme page 4-5/11
Document 5 : l’appareil respiratoire page 5/11
Document 6 : la détermination de VO
2
max et de la PMA chez un sportif page 6/11
Document 7 : le dégagement de chaleur page 6/11
Document 8 : la respiration d’un organe page 7/11
Document 9 : des exemples d’appareils respiratoires page 7/11
Document 10 : le contrôle de la respiration page 8/11
Document 11: la respiration des mitochondries isolées page 9/11
Document 12 :
tableau issu de l’analyse biochimique de cellules page 9/11
Document 13 : étude expérimentale de la glycolyse page 10/11
Document 14 : les réserves en glycogènes du muscles page 11/11

3
Document 1 : Relation entre rythme cardiaque, rythme respiratoire et consommation en
dioxygène
Enregistrement réalisé par ExAO (matériel ORPHY) : variation des fréquences cardiaques et
respiratoires en fonction de l’effort physique (ici 20 flexions en 30 secondes à partir de la 30ème
seconde de l’enregistrement)
Rappel des légendes indiquées
Courbe rouge du haut : rythme cardiaque exprimé en battements par minute
Courbe bleue du milieu : quantité d’air échangée en litres par seconde
Courbe verte du bas : quantité de dioxygène consommée (courbe cumulative)
Base de temps en abscisse exprimée en secondes (entre 0 et 100 secondes)
Le début et la fin de l’effort sont indiqués au dessus de la courbe rouge et surlignés en jaune.
Source : Site académique de Besançon
(http://artic.ac-besancon.fr/svt/env_san/edu_san/cardio/consO2/conso.htm )
Document 2 : la quantification du métabolisme
(Bordas 2
nd
)

4
Document 3 : les échanges gazeux d’un organisme vivant
(hatier 5
ème
)
Enregistrement EXAO du dioxygène présent
dans l'enceinte contenant des vers de terre. Enregistrement Ex.A.O. du C0
2
présent dans
l'enceinte contenant des vers de terre
Enregistrement EXAO du dioxygène présent
dans l'enceinte contenant des radis. Enregistrement Ex.A.O. du CO
2
présent dans
l’enceinte contenant des radis.
Enregistrement EXAO de la teneur en dioxygène et en dioxyde de carbone dissous dans la
solution nutritive où vivent des levures.
Document 4 : Les risques du tabagisme
L’exposition passive à la fumée du tabac est la cause d’un risque de cancer des poumons chez la personne
exposée.
a- Lien entre parents fumeurs et infections pulmonaires
Parents Infections pulmonaires des enfants en %
2 non fumeurs 7,6
1 fumeur et 1 non fumeur 10,4
2 fumeurs 15,3

5
b- Aspect du tissu pulmonaire chez un fumeur et un non fumeur
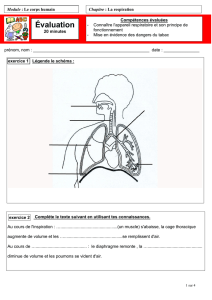
Document 5 : L’appareil respiratoire
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%