La segmentation - DSI friends 972

!"#$%&'%()")*+(#
,- .*$%#%(#/0"1%#2%#0"#'+340"##
54"(2#4(#647#%$)#781+(28#+4#"1)*98:#$"#$%&'%()")*+(#28;4)%<#!%$#=#7%4*00%)$:#>4%#$+():#
0?%1)+2%3'%:#0%#'8$+2%3'%:#%)#0#%(2+2%3'%:#$%#'%))%()#%(#/0"1%#$%0+(#0%$#"@%$#2%#/+0"3*)8#
2%#0?%';3A+(#0+3$#2%#0"#&"$)340")*+(#%)#2%#0"#(%4340")*+(<#
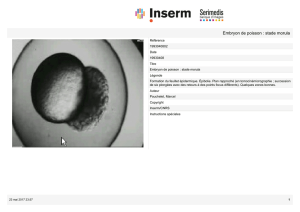
!?%';3A+(#>4*#$%#$%&'%()%#%$)#"//%08#blastula:#*0#%$)#1"3"1)83*$8#/"3#4(%#"1)*9*)8#'*)+)*>4%#
*()%($%#<B4#$%*(#2%#0"#;0"$)40"#"//"3"*)#4(%#1"9*)8#2%#$%&'%()")*+(#"//%08%#blastocœle<#!%$#
1%0040%$#7*00%$#>4*#1+'/+$%()#0"#;0"$)40"#$+()#2%$#blastomères<##
!%#'+2%#2%#$%&'%()")*+(#%$)#7+(1)*+(#2%#0"#>4"()*)8#2%#38$%39%#%(#9*)%004$#>4%#0?647#"43"#
"114'408:#2%#1%#7"*)#+(#2*$)*(&4%#2*7783%()$#)A/%$#2?647$#C#
DE(#647#"081*)F%#%$)#4(#647#"A"()#"414(%#38$%39%#9*)%00*(%<##
DE(#647#+0*&+081*)F%#%$)#4(#647#"A"()#/%4#2%#38$%39%#9*)%00*(%#
DE(#647#F8)83+081*)F%#%$)#4(#647#"A"()#2%$#38$%39%$#9*)%00*(%$#3%0")*9%'%()#*'/+3)"()%$#
'"*$#*(8&"0%'%()#38/"3)*%$#G1?%$)#0%#1"$#2%$#"'/F*;*%($-<#
E(#647#)80+081*)F%#%$)#4(#647#"4#9*)%004$#";+(2"():#/38$%()#1F%H#0%$#3%/)*0%$:#+*$%"4@#%)#
'+004$>4%$<###
E(#647#1%()3+081*)F%#%$)#4(#647#"4#9*)%004$#/0"18#"4#(*9%"4#1%()3"0:#)%3'%#$/81*7*>4%#"4@#
*($%1)%$##
IF">4%#/FA04'#/+$$J2%#4(#'+2%#1"3"1)83*$)*>4%#2%#$%&'%()")*+(:#7+(1)*+(#2%#0?";+(2"(1%#
%)#2%#0"#2*$)3*;4)*+(#2%$#38$%39%$#%(#9*)%004$#2%#0"#1%0040%#647<##
K(#+;$%39%#2%4@#)A/%$#2%#$%&'%()")*+(#C#
DE(%#$%&'%()")*+(#F+0+;0"$)*>4%#+4#)+)"0%:#+L#0?647#$%#2*9*$%#2"($#$+(#*()8&3"0*)8<#
DE(%#$%&'%()")*+(#.83+;0"$)*>4%#+4#/"3)*%00%:#+4#$%40%#0"#38&*+(#24#1A)+/0"$'%#/"493%#%(#
9*)%004$:#$%#2*9*$%<##
E(%#$%&'%()")*+(#F+0+;0"$)*>4%#/%4)#%(&%(23%3#2%$#1%0040%$#7*00%$#2%#)"*00%#*2%()*>4%#+4#
2*7783%()%<#!"#$%&'%()")*+(#F+0+;0"$)*>4%#%$)#8&"0%#"4#28;4)#24#289%0+//%'%()#/4*$#
2%9*%()#*(8&"0%#"/3J$#0%$#/3%'*J3%$#2*9*$*+($<##
K(#2*$)*(&4%#>4")3%#)A/%$#2%#$%&'%()")*+(#F+0+;0"$)*>4%$#$%0+(#0?+3*%()")*+(#%)#0%$#/+$*)*+($#
2%$#/0"($#2%#2*9*$*+($#C#
DE(%#$%&'%()")*+(#3"2*1"0"*3%:#1"3"1)83*$8%#/"3#4(%#$411%$$*+(#2%#/0"($#'83*2*%($##%)#
0")*)42*("4@#G"'/F*;*%($-<#

DE(%#$%&'%()")*+(#$/*3"0%:#'"3>48%#/"3#0"#3+)")*+(#%()3%#1F">4%#1A10%#2%#2*9*$*+(:#2?4(#
"(&0%#2%#MNO#/"3#3"//+3)#P#0?"@%#/+0%#"(*'"0Q/+0%#98&8)")*7<#
D#E(%#$%&'%()")*+(#;*0")83"0%:#'"3>48%#/"3#0%#7"*)#>4%#/%(2"()#0%$#2*9*$*+($#:#0%$#1%0040%$#$%#
38/"3)*$$%()#2%#/"3)#%)#2?"4)3%$#2%$#"@%$#"()83+D/+$)83*%43$#:#2+3$"0D#9%()3"0#:24#74)43#
%';3A+(##
D#E(%#$%&'%()")*+(#3+)")*+((%00%:#"4#$)"2%#2%#1%0040%:#0?4(#2%$#;0"$)+'J3%$#$%#2*9*$%#$%0+(#
4(#/0"(#'83*2*%(:#%)#0?"4)3%#$%0+(#4(#/0"(#8>4")+3*"0<#
R0#%@*$)%#2%4@#)A/%$#2%#$%&'%()")*+(#.83+;0"$)*>4%#C#
DE(%#$%&'%()")*+(#2*$1+S2"0%#
DE(%#$%&'%()")*+(#$4/%37*1*%00%#
T"($#4(%#$%&'%()")*+(#2*$1+S2"0%:#0%$#2*9*$*+($#$+()#3%$)3%*()%$#P#4(%#38&*+(#1A)+/0"$'*>4%#
28/+4394%#2%#38$%39%#9*)%00*(%<#!"#$%&'%()")*+(#$?*(*)*%#/"3#2%$#/0"($#'83*2*%($:#/4*$#
)3"($9%3$"4@<#
#K(#+;)*%()#"0+3$#0"#7+3'")*+(#2?4(#2*$>4%#2%#1%0040%$#"4D2%$$4$#24#9*)%004$#G+*$%"4@:#3%/)*0%$#
%)#1%3)"*($#/+*$$+($-<#
R0#A#"#4(%#$%&'%()")*+(#$4/%37*1*%00%#+;$%398%#1F%H#0%$#*($%1)%$#%)#0%$#134$)"18$<#B4#28;4)#2%#
0"#$%&'%()")*+(#$%40$#0%$#(+A"4@#$%#2*9*$%()#%)#7+3'%()#"*($*#0%#syncytium.#U($4*)%#0%$#
(+A"4@#'*&3%()#P#0"#/83*/F83*%#2%#0?%';3A+(<#
#!%$#'%';3"(%$#/0"$'*>4%$#>4*#"//"3"*$$%():#/3+9*%((%()#2%#0"#'%';3"(%#/0"$'*>4%#2%#
0?647#V#%)#%()+43%#1F">4%#(+A"4<#
W- T%$13*/)*+($#2%$#/3%'*J3%$#2*9*$*+($##
Premier3plan3de3division#C#
!%#/3%'*%3#/0"(#2%#$%&'%()")*+(#%$)#9%3)*1"0Q'83*2*%(#$%0+(#0?"@%#/+0%#"(*'"0Q/+0%#
98&8)")*7<#
!%#$*00+(#2%#$%&'%()")*+(#%$)#*(*)*8#"4#/X0%#"(*'"0#%)#$%#/3+/"&%#9%3$#0%#/+0%#98&8)")*7<#R0#
2*9*$%#0?647#%(#1%0040%#2%#)"*00%$#*2%()*>4%$#C#les3blastomères<#
T"($#0%#/+0%#"(*'"0:#0%#$*00+(#$%#/3+/"&%#P#4(%#9*)%$$%#%$)*'8%#P#,''Q'*(<#
#B0+3$#>4%#2"($#0%#/+0%#98&8)")*7#0"#9*)%$$%#%$)#2%#0?+323%#2%#=<,YD=#''Q'*(<##
Z+43#0"#/04/"3)#2%$#%$/J1%$:#0%#/3%'*%3#/0"(#2%#2*9*$*+(#/"$$%#2"($#0"#'+*)*8#2%$#1"$#/"3#0%#
plan3de3symétrie3bilatérale3(=3croissant3dépigmenté3ou3gris).33
Second3plan3de3division3:3

!%#$%1+(2#/0"(#2%#0"#$%&'%()")*+(#%$)#8&"0%'%()#'83*2*%(#%)#9%3)*1"0:#%)#/%3/%(2*140"*3%#"4#
/3%'*%3:#*0#9"#2+(1#2*9*$%3#0?647#%(#>4")3%#;0"$)+'J3%$#*2%()*>4%$#%(#)"*00%#%)#%(#"//"3%(1%:#
'"*$#1%0"#(%#$*&(*7*%#/"$#>4?*0$#"*%()#0"#'['%#1+'/+$*)*+(#'+08140"*3%:#(*#0%$#'['%$#
/+)%()*"0*)8$#2%#289%0+//%'%()<##
R0#"#8)8#28'+()38#>4?%(#*$+0"()#1F"14(#2%$#;0"$)+'J3%$:#"4#$)"2%#W#+4#M#1%0040%$:#>4%#0%$#
;0"$)+'J3%$#2+3$"4@:#>4*#1+()*%((%()#)+4)#+4#%(#/"3)*%#24#13+*$$"()#&3*$:#/+43$4*9%()#0%43#
289%0+//%'%()#%)#/3+24*$%()#2%4@#%';3A+($<###
U(#3%9"(1F%#0%$#;0"$)+'J3%$#9%()3"4@#>4*#(#F83*)%()#/"$#2%#13+*$$"()$#&3*$:#1+()*(4%()#2%#$%#
2*9*$%3#%)#7+3'%()#2%$#98$*140%$#*(2*7783%(1*8$<#!?"("0A$%#F*$)+0+&*>4%:#389J0%#2"($#1%$#
;0"$)+'J3%$#9%()3"4@:#0"#/38$%(1%#2%#1%0040%$#8/*)F80*"0%$#2%#)A/%#8/*2%3'*>4%:#2%#1%0040%$#
'8$%(1FA'")%4$%$:#'"*$#8&"0%'%()#2%$#1%0040%$#$"(&4*(%$#%)#2%$#1%0040%$#%(2+2%3'*>4%$<##
B4#7*("0:#1%1*#$4&&J3%#>4?*0#%@*$)%#"4#$%*(#24#13+*$$"()#&3*$:#2%$#7"1)%43$#+4#2%$#28)%3'*("()$:#
>4*#1+()3X0%()#0"#38"0*$")*+(#24#/3+&3"''%#2%#289%0+//%'%()<##
E(%#%@/83*%(1%#1+($*$)"()#P#0*&")43%3#4(#647:#\4$)%#"/3J$#0"#781+(2")*+(:#"#'+()38#>4%#
0?F8'*$/FJ3%#>4*#1+()*%()#0%#(+A"4#$%#2*9*$%<#B4#$)"2%#]#+4#,^#1%0040%$:#$*#+(#3%0_1F%#0"#
0*&")43%:#4(#(+A"4#/%4)#/"$$%3#24#1+)8#>4*#%(#8)"*)#28/+4394:#$*#%($4*)%#+(#3%$$%33%#0"#
0*&")43%#/+43#$8/"3%3#287*(*)*9%'%()#0%$#2%4@#F8'*D%';3A+($:##%)#>4?+(#0"*$$%#0%#
289%0+//%'%()#$%#/+43$4*93%:#+(#+;)*%()#"0+3$#2%4@#%';3A+($<#I%1*#/%3'%)#2%#1+(1043%#>4%#
0%$#(+A"4@#$+()#&8(8)*>4%'%()#*2%()*>4%$:#%)#1"/";0%$#2%#2*3*&%3#4(#289%0+//%'%()#
F"3'+(*%4@<###
Troisième3plan3de3division#C#
B#/"3)*3#2%#1%#)3+*$*J'%#/0"(#2%#2*9*$*+(:#0"#$%&'%()")*+(#2%9*%()#*(8&"0%:#0%#)3+*$*J'%#/0"(#
%$)#04*:#F+3*H+()"0#%)#%$)#/0"18#08&J3%'%()#"4D2%$$4$#2%#0?8>4")%43<#R0#1+(24*)#P#0"#7+3'")*+(#
2%#]#;0"$)+'J3%$#*(8&"4@:#>4")3%#>4%#0?+(#>4"0*7*%3"#2%#'*13+'J3%$#2"($#0?F8'*$/FJ3%#
"(*'"0:#%)#>4")3%#'"13+'J3%$#2"($#0?F8'*$/FJ3%#98&8)")*7<##
B#0?*$$4%#2%#1%))%#)3+*$*J'%#2*9*$*+(:#0%$#2*9*$*+($#$4*9"()%$#$%#7+()#$4*9"()#4(%#"0)%3("(1%#2%#
/0"($#F+3*H+()"4@#%)#'83*2*%($:#"4#$)"2%#,^#;0"$)+'J3%$:#0?%';3A+(#/3%(2#0"#7+3'%#2*)%#2%#
'+340"<##
E(%#"("0A$%#F*$)+0+&*>4%#"#'+()38#>4?"4#1+43$#2%#0"#$%&'%()")*+(:#0%#/0"$'%#&%3'*("0:#>4*#
%$)#0+1"0*$8#"4#/X0%#98&8)")*7:#9+()#3%'+()%3#/3+&3%$$*9%'%():#0%#0+(#/3%'*%3#$*00+(#2%#
$%&'%()")*+(<#B4#$)"2%#2%#M#;0"$)+'J3%$:#1%#/0"$'%#&%3'*("0#9"#7+3'%3#>4")3%#'"$$%$#2%#
1A)+/0"$'%$:#>4*#9+()#$%#3%/"3)*3#%(#>4")3%#1%0040%$<###
I%#'+49%'%()#24#/0"$'%#&%3'*("0#%$)#$+4$#0"#28/%(2"(1%#2%#'*13+)4;40%$#%)#2%$#/3+)8*(%$#
2%#0?647:#"4#7*("0#P#0"#7*(#2%#0"#$%&'%()")*+(:#0%#/0"$'%#&%3'*("0#(%#9"#[)3%#2*$)3*;48#>4%#
2"($#4(#(+';3%#3%$)3%*()#2%#'"13+'J3%$#"4#(*9%"4#98&8)")*7<#

=- I+()3X0%#2%#0"#)3"($13*/)*+(#24#&8(+'%#%)#2%$#2*9*$*+($#/"3#2%$#7"1)%43$#
1A)+/0"$'*>4%$#C#
!"#$%&'%()")*+(#%$)#'"3>48%#/"3#0?"1)*9")*+(#%)#0"#3%/3*$%#2%#0"#)3"($13*/)*+(#24#&8(+'%#
2?4(#(+49%0#+3&"(*$'%:#'"*$#*0#A#"#8&"0%'%()#4(#1+()3X0%#/381*$#2%#2*9*$*+(#%)#0"#7+3'")*+(#
2%#(+49%00%$#'%';3"(%$#/0"$'*>4%$<##
D)3"($*)*+(#;0"$)408%((%#C#
B4#)+4)#28;4)#2%#0"#$%&'%()")*+(#0%$#2*9*$*+($#$+()#3"/*2%$:#1"3#0"#2438%#2%#1F">4%#1A10%:#%$)#
3824*)%#%(#";$%(1%#2%$#/F"$%$#`,#%)#`W#24#1A10%#1%0040"*3%<##
E(#1A10%#243%#=N#'*(4)%$#1F%H#0%$#"(+43%$:#%)#0%#2+4;0%#1F%H#0%$#43+2J0%$:#0%$#2*9*$*+($#$+()#
$A(1F3+(%$#\4$>4?#"4@#,YD,W#%'%#1A10%$#'*)+)*>4%<#a4$>4?#P#1%#'+'%()#0?%';3A+(#1+()*%()#
MYb^#1%0040%$:##"#/"3)*3#2%#0P#*0#$%#/3+24*)#4(#"00+(&%'%()#2%$#1A10%$#2%#2*9*$*+(:#0*8%#"#
0?*()3+241)*+(#/3+&3%$$*9%#2%$#/F"$%$#`,#%)#`W<#!"#2438%#2%$#2*9*$*+($#2%9*%()#*(8&"0%:#
/3*(1*/"0%'%()#"#1"4$%#2%#0"#$431F"3&%#%(#9*)%004$#2%$#;0"$)+'J3%$#98&8)")*7$:#2%#)%00%#$+3)%#
>4%#1%$#;0"$)+'J3%$#98&8)")*7$#$+()#'+*($#(+';3%4@#'"*$#/04$#9+04'*(%4@#>4%#0%$#
;0"$)+'J3%$#24#/+0%#"(*'"0<##
I%))%#28$A(1F3+(*$")*+(#2%$#1A10%$#>4*#$?"11+'/"&(%()#2%#0"#3%/3*$%#2%#0"#)3"($13*/)*+(:#%$)#
"//%08#0"#)3"($*)*+(#;0"$)408%((%<#!"#3%/3*$%#2%#0"#)3"($13*/)*+(#%$)#$+4$#0%#1+()3X0%#2%#
/3+)8*(%$#$)+1c8%$#0+3$#2%#0?+9+&8(J$%:##1%#$+()#2%$#7"1)%43$#2%#)3"($13*/)*+(<##I%$#7"1)%43$#
2%#)3"($13*/)*+(#9*%((%()#$%#7*@%3#$43#2%$#$8>4%(1%$#(4108+)*2*>4%$#>4%#0?+(#3%)3+49%#"4#
(*9%"4#2%$#/3+'+)%43$#2%#1%3)"*($#&J(%$<##
U()3%#0"#781+(2")*+(#%)#0"#)3"($*)*+(#;0"$)408%((%#0"#38/0*1")*+(#2%#0?BTd#%$)#3"/*2%:#0"#
)3"($13*/)*+(#$%';0%#[)3%#*("1)*98%:#'"*$#0"#)3"241)*+(#2%$#Bed#'%$$"&%3$#'")%3(%0$:#
/%3'%))"()#0"#$A()FJ$%#2%$#/3+)8*(%$:#*(2*$/%($";0%$#"4@#/3%'*J3%$#8)"/%$#2%#
289%0+//%'%():#%$)#"1)*9%<##
B#/"3)*3#2%#0"#)3"($*)*+(#;0"$)408%((%#2%4@#(+49%"4@#Bed#'%$$"&%3$#$+()#)3"($13*)$:#*0$#
3%/38$%()%()#0%$#/3%'*J3%$#%@/3%$$*+($#2%$#&J(%$#24#HA&+)%:#$*#;*%(#>4%#1+%@*$)%():#2%$#Bed#
'%$$"&%3$#%)#2%$#/3+)8*(%$#2?+3*&*(%#'")%3(%00%$:#%)#2%$#/3+)8*(%$#HA&+)*>4%$<###
I+()3X0%#2%$#1A10%$#2%#2*9*$*+(#C##
!%$#2*9*$*+($#2%#$%&'%()")*+(#*'/0*>4%()#4(%#1++32*(")*+(#$/")*+D)%'/+3%00%#24#1A10%#
'*)+)*>4%:#%)#4(#1+()3X0%#)3J$#/381*$#24#2+4;0%'%()#2%$#(+A"4@#%)#2%$#+3&"(*)%$<##
R0#A#"#2%$#1F%31F%43$#>4*#+()#'+()38$:#>4%#0%#7"1)%43#>4*#28;0+>4%()#0"#2*9*$*+(#'8*+)*>4%:#
\+4%#8&"0%'%()#4(#3X0%#"4#1+43$#2%$#2*9*$*+($#2%#'*)+$%:#0+3$#2%#0"#$%&'%()")*+(<##
!%$#1A10%$#2%#2*9*$*+($#$+()#2+(1#$+4$#0%#1+()3X0%#24#1+'/0%@%#/3+)8*>4%#"//%08#0%#.Zf#
G'")43")*+(#/3+'+)*("1)+3-<#R0#%$)#"$$+1*8#"#4(%#/3+)8*(%:#4(%#1A10*(%#(+''8%#1A10*(%#g:#

"*($*#>4?4(%#/3+)8*(%#c*("$%#28(+''8%#ITIW#>4*#/+433":#%00%:##$#"$$+1*%3#"#4(%#"4)3%#
1A10*(%<#
R0#$%';0%3"*)#>4?4(%#$+4$#4(*)8#*(F*;*)3*1%#2%$#c*("$%$##*()%39*%(23"*)#2"($#0?"1)*9*)8#24#.Zf:#
1%))%#"1)*9*)8#9"3*%#2%#'"(*J3%#1A10*>4%:#%)#"/3J$#0"#781+(2")*+(:#0?"1)*9")*+(#2%#0?647#
/3+9+>4%#0"#$A()FJ$%#2%#0"#1A10*(%:#1%))%#1A10*(%#$%#1+'/0%@%3"#"9%1#0"#c*("$%:#0%#.Zf#
2%9*%()#"0+3$#"1)*7:#0+3$>4%#0"#38/0*1")*+(#2%#0?BTd#%$)#)%3'*(8%<#h+(#"1)*9*)8#%$)#0*8%#P#$+(#
8)")#2%#/F+$/F+3A0")*+(<##
!%#.Zf#"1)*98:#%(&"&%#0%$#1%0040%$#P#3%()3%3#%(#/F"$%#.:#%)#>4"(2#*0#%$)#*("1)*98:#*0#/38/"3%#0"#
/F"$%#h#24#1A10%#1%0040"*3%<#T+(1#0"#/%3)%#+4#0%#&"*(#2?"1)*9*)8#24#.Zf#1+()3X0%#0?%()38%#%(#
'*)+$%#%(#/F"$%#h<###
h)341)43%#2%#0"#;0"$)40"#C#
B#/"3)*3#24#$)"2%#'+340":#0%$#2*9*$*+($#$+()#"$A(1F3+(%$:#%)#1+(24*$%()#P#0"#7+3'")*+(#2?4(%#
;0"$)40":#"4#/0"(#"(")+'*>4%:#0?%';3A+(#%$)#"0+3$#1+($)*)48#2%#2%4@#&3+4/%$#2%#1%0040%$:#2%#
)A/%$#2*7783%()$#%)#>4*#%()+43%()#4(%#1"9*)8:#>4%#0?+(#"//%00%#;0"$)+160%<#I?%$)#4(#%';3A+(#
2*;0"$)*>4%:#0%#)+*):#0"#/"3)*%#$4/83*%43%#24#;0"$)+160%#%$)#0*'*)8%#/"3#0%$#1%0040%$#2%#
0?F8'*$/FJ3%#"(*'"0:#%)#0%#/0"(1F%3:#0"#/"3)*%#*(783*%43%:#%$)#7+3'8#/"3#0%$#;0"$)+'J3%$#2%#
0?F8'*$/FJ3%#98&8)")*7<#
!"#'*$%#%(#/0"1%#24#;0"$)+160%#3%/+$%#$43#2%4@#'81"(*$'%$#C#
#!%#/3%'*%3#'81"(*$'%#%$)#8)";0*#P#/"3)*3#2%#0"#'+340":#0%$#%$/"1%$#*()%31%0040"*3%$#7+3'8$#
0+3$#2?4(%#2*9*$*+(#74$*+((%()<#
#!%#2%4@*J'%#'81"(*$'%#%$)#4(#704@#2%#$+2*4'#>4*#$?8)";0*)#%()3%#0?%@)83*%43#%)#0?*()83*%43#2%#
0?%';3A+(:##1%0"#%()3"*(%#0"#9"3*")*+(#2%#/3%$$*+(#+$'+)*>4%#2+()#0"#1+($8>4%(1%#%$)#4(%#
%()38%#2?%"4#2"($#0"#;0"$)40"<#!"#1"9*)8#7+3'8%#%$)#%@1%()38%#2"($#0?F8'*$/FJ3%#"(*'"0<#
!%$#\+(1)*+($#%()3%#0%$#1%0040%$#2%#0?F8'*$/FJ3%#"(*'"0#C#
!%$#1%0040%$#$+()#2%#/%)*)%$#)"*00%$#/*&'%()8%$#%)#1+F8$*9%$#%()3%#%00%$<#U00%$#$+()#3%/"3)*%$#%(#
/04$*%43$#1+41F%$#2+()#0%#(+';3%#28/%(2#2%$#%$/J1%$<#!%$#;0"$)+'J3%$#0%$#/04$#%@)%3(%$#
$+()#3%0*%$#%()3%#%4@#/"3#2%$#\+(1)*+($#$%33%$#0+1"0*$8%$#"#0?"/%@#2%$#1%0040%$#$+4$#0%$#
'*13+9*00+$*)8$<#
!%$#\+(1)*+($#$%338%$#7+3'%()#"4)+43#2%#0"#1%0040%:#4(%#1%*()43%#>4*#"$$43%#1+F8$*+(#%)#
8)"(1F8*)8<##
!%$#1%0040%$#/04$#/3+7+(2%$#/+$$J2%()#2%$#\+(1)*+($#2%#)A/%#`"/#>4*#'%))%()#%(#1+((%@*+(#
2%$#1%0040%$#"2\"1%()%$<#!?*'/+3)"(1%#2%#1%$#\+(1)*+($#0+3$#24#289%0+//%'%()#"#8)8#'*$%#%(#
89*2%(1%#/"3#2%$#%@/83*%(1%$#>4*#+()#)%()8#2%#i#/%3)43;%3#j#0%$#1+((%@*(%$##
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%