Histiocytose langerhansienne osseuse multifocale

Cas
clinique
Histiocytose
langerhansienne
osseuse
multifocale
:
intérêt
de
la
scintigraphie
osseuse
planaire
Multifocal
Langerhans
cell
histiocytosis
of
bone:
Usefulness
of
planar
bone
scintigraphy
A.
Matrane
a,
*,
A.
Guensi
b
,
M.
Kebbou
b
a
Service
de
médecine
nucléaire,
faculté
de
médecine
et
de
pharmacie,
université
Cadi
Ayyad,
CHU
Mohammed
VI,
Marrakech,
Maroc
b
Service
de
médecine
nucléaire,
faculté
de
médecine
et
de
pharmacie,
université
Hassan
II,
Casablanca,
Maroc
Reçu
le
21
avril
2012
;
accepté
le
2
octobre
2012
Disponible
sur
Internet
le
21
novembre
2012
Résumé
L’histiocytose
langerhansienne
(HL)
est
une
maladie
du
système
réticuloendothélial
caractérisée
par
une
prolifération
clonale
de
cellules
dendritiques
de
Langerhans.
C’est
une
maladie
rare
qui
touche
principalement
l’enfant
et
l’adulte
jeune.
Elle
peut
prendre
plusieurs
aspects,
d’un
simple
granulome
éosinophile
à
des
lésions
généralisées
multiviscérales
mettant
en
jeu
le
pronostic
vital.
L’atteinte
osseuse
est
la
plus
fréquente,
elle
peut
être
uni-
ou
multifocale.
Nous
rapportons
une
observation
de
HL
osseuse
multifocale,
révélée
chez
un
enfant
âgé
de
trois
ans
et
ayant
touché
l’os
temporal
gauche
et
le
fémur
droit.
La
scintigraphie
osseuse
a
permis
de
retrouver
une
troisième
localisation
scapulaire
droite.
L’évolution
fut
favorable
après
chimiothérapie
par
voie
générale.
Les
atteintes
osseuses
se
caractérisent
par
des
lésions
lytiques
d’agressivité
variable
et
sont
responsables
de
douleurs,
de
tuméfactions
et
de
fractures.
L’ensemble
des
techniques
d’imagerie
(radiographies
standard,
TDM
et
IRM)
concourt
à
l’élaboration
du
diagnostic.
La
scintigraphie
osseuse
est
un
examen
très
sensible
qui
permet
le
bilan
d’extension
initial
et
le
suivi
sous
traitement
des
manifestations
osseuses
de
la
maladie.
#
2012
Elsevier
Masson
SAS.
Tous
droits
réservés.
Mots
clés
:
Histiocytose
langerhansienne
;
Granulome
éosinophile
;
Scintigraphie
osseuse
Abstract
Langerhans
cell
histiocytosis
is
a
disease
of
the
reticuloendothelial
system
characterized
by
a
clonal
proliferation
of
dendritic
cells
of
Langerhans.
This
is
a
rare
disease
that
primarily
affects
children
and
young
adults.
It
can
take
many
forms,
from
a
single
eosinophilic
granuloma
to
widespread
lesions
involving
multisystem
life-threatening.
Bone
involvement
is
the
most
common,
it
can
be
uni-
or
multifocal.
We
report
a
case
of
multifocal
bone
Langerhans
cell
histiocytosis,
revealed
in
a
child
aged
3
years
and
touched
his
left
temporal
bone
and
right
femur.
The
bone
scintigraphy
has
found
a
third
location
in
right
scapular.
The
outcome
was
favorable
after
chemotherapy.
The
bone
lesions
are
characterized
by
lytic
lesions
and
are
responsible
for
pain,
swelling
and
fractures.
All
the
imaging
techniques
(radiographs,
CT,
and
MRI)
contribute
to
the
formation
of
the
diagnosis.
Bone
scintigraphy
is
a
very
sensitive
examination
that
allows
the
initial
staging
and
follow-up
on
treatment
of
skeletal
manifestations.
#
2012
Elsevier
Masson
SAS.
All
rights
reserved.
Keywords:
Langerhans
cell
histiocytosis;
Eosinophilic
granuloma;
Bone
scintigraphy
1.
Introduction
L’histiocytose
langerhansienne
(HL)
est
un
groupe
d’affec-
tions
ayant
en
commun
une
infiltration
tissulaire
par
des
cellules
de
Langerhans
ou
cellules
dendritiques
issues
du
système
réticuloendothélial
et
organisées
en
granulomes.
C’est
une
maladie
systémique
de
l’enfant
et
de
l’adulte
jeune,
avec
un
pic
de
fréquence
entre
un
et
quatre
ans
et
une
prédominance
masculine.
Son
spectre
clinique
est
très
divers,
allant
du
simple
granulome
éosinophile
à
la
forme
grave
multivésicale
avec
dysfonctionnement
d’organe.
Elle
est
caractérisée
par
des
lésions
infiltratives,
organisées
en
granulomes,
comprenant
des
histiocytes
CD1a+
et
porteurs
de
protéines
S-100
[1,2].
Disponible
en
ligne
sur
www.sciencedirect.com
Médecine
Nucléaire
36
(2012)
730–735
*
Auteur
correspondant.
Adresse
e-mail
:
(A.
Matrane).
0928-1258/$
–
see
front
matter
#
2012
Elsevier
Masson
SAS.
Tous
droits
réservés.
http://dx.doi.org/10.1016/j.mednuc.2012.10.004

Les
principales
localisations
de
la
maladie
sont
l’os,
la
peau,
les
ganglions
lymphatiques,
la
moelle
osseuse,
les
poumons,
l’axe
hypothalamo-hypophysaire,
la
rate
et
le
foie.
Elles
se
présentent
sous
plusieurs
formes
cliniques
:
le
granulome
éosinophile
de
l’os,
le
syndrome
de
Hand-Schuller-Christian,
le
syndrome
de
Letterer-Siwe
et
la
maladie
de
Hashimoto-
Pritzker.
Le
pronostic
de
la
maladie
dépend
de
l’âge
du
patient,
de
l’extension
de
la
maladie
et
de
l’existence
de
signes
de
dysfonctionnement
d’organe
[3,4].
L’os
est
l’organe
le
plus
fréquemment
atteint
par
cette
affection.
La
localisation
craniofaciale
représente
30
à
50
%
des
cas
et
l’atteinte
du
squelette
périphérique
est
rare,
classique-
ment
localisée
au
niveau
des
os
longs
(fémur,
humérus).
Le
diagnostic
de
certitude
est
histologique
et
repose
sur
la
mise
en
évidence
d’antigènes
CD1a
à
la
surface
des
cellules
pathologiques
et
des
granules
de
Birbech
intracytoplasmiques
en
microscopie
électronique.
Le
traitement
varie
selon
les
localisations
et
la
sévérité
de
l’atteinte.
La
scintigraphie
osseuse
(SO)
joue
un
rôle
important
dans
l’approche
diagnostique
de
l’HL.
C’est
une
technique
d’imagerie
fonctionnelle
non
invasive
qui
permet
une
évalua-
tion
de
l’extension
des
lésions
osseuses
et
le
suivi
des
lésions,
en
particulier
après
traitement.
Le
but
de
ce
travail
est
d’illustrer
l’intérêt
de
la
SO
planaire
aux
bisphosphonates
marqués
au
technétium
99m
(Tc
99m
)
dans
la
prise
en
charge
de
l’HL
osseuse
multifocale
à
propos
d’une
observation
et
de
rappeler,
à
travers
une
revue
de
la
littérature,
les
caractéristiques
de
cette
pathologie
et
les
différents
examens
d’imagerie
dans
la
démarche
diagnostique.
2.
Patient
et
méthodes
Il
s’agit
de
l’enfant
A.Y.
de
sexe
masculin,
âgé
de
trois
ans,
présentant
depuis
deux
ans
une
tuméfaction
rétro-auriculaire
gauche
d’apparition
progressive
avec
otorrhée
et
otorragie
et
une
boiterie
avec
tuméfaction
douloureuse
de
la
jambe
droite.
La
radiographie
du
crâne
a
montré
une
image
d’ostéolyse
au
niveau
de
l’os
temporal
gauche
(Fig.
1a).
La
TDM
du
rocher
a
montré
un
processus
lésionnel
de
la
pyramide
pétreuse
gauche
avec
lyse
osseuse
étendue
(Fig.
1b).
La
radiographie
du
fémur
droit
a
montré
une
image
ostéolytique
du
tiers
inférieur
de
la
diaphyse
fémorale
droite
(Fig.
1c).
L’IRM
du
fémur
droit
a
conclu
a
une
lésion
tumorale
maligne
de
l’extrémité
inférieure
du
fémur
droit
(Fig.
1d).
Le
diagnostic
de
l’HL
a
été
suspecté
sur
les
données
cliniques
et
de
l’imagerie
et
confirmé
par
l’étude
anatomo-
pathologique
et
immuno-histochimique.
L’examen
anatomopathologique
de
la
biopsie
chirurgicale
du
fémur
droit
a
mis
en
évidence
une
prolifération
d’histiocytes
dérivant
des
cellules
de
Langerhans,
exprimant
à
l’immuno-
histochimie
le
CD1a
et
la
protéine
S-100.
Le
diagnostic
de
HL
avec
localisation
temporale
gauche
et
fémorale
droite
a
été
retenu.
L’échographie
abdominale
a
montré
des
reins
en
fer
à
cheval.
Le
reste
du
bilan
paraclinique
a
compris
une
IRM
cérébrale
et
hypophysaire,
une
TDM
thoracique
et
une
biopsie
ostéomédullaire
qui
étaient
normales.
La
SO
a
été
demandée
dans
le
cadre
du
bilan
osseux
de
la
maladie.
L’examen
a
compris
deux
enregistrements
explorant
les
phases
tissulaires
et
osseuses
de
la
cinétique
du
radio-
pharmaceutique.
L’acquisition
a
été
effectuée
au
moyen
d’une
gamma-caméra
(Symbia
de
Siemens
TM
)
équipée
d’un
colli-
mateur
à
trous
parallèles
basse
énergie
haute
résolution
(LEHR),
la
fenêtre
de
spectrométrie
était
centrée
sur
l’énergie
du
photon
gamma
du
99m
Tc
(140
KeV),
fenêtre
de
10
%.
La
matrice
utilisée
était
de
256
256
pour
la
phase
tissulaire
et
256
1024
pour
la
phase
osseuse
tardive.
La
phase
tissulaire
a
été
réalisée,
cinq
minutes
après
l’injection
intraveineuse
de
222
MBq
(6
mCi)
d’oxydronate
(HMDP)
marqué
au
technétium
99m
(Tc99m),
par
l’enregis-
trement
d’une
série
d’images
statiques
précoces
de
deux
minutes
des
jambes
en
faces
antérieure
et
postérieure.
Elle
permet
de
visualiser
la
distribution
extracellulaire
du
radio-
pharmaceutique
et
d’apprécier
la
rapidité
de
la
captation
osseuse.
La
phase
tardive
a
été
réalisée,
trois
heures
après
l’injection
du
radiotraceur,
par
l’enregistrement
d’un
balayage
du
corps
entier
en
faces
antérieure
et
postérieure
(zoom
1).
La
vitesse
de
balayage
était
de
15
cm/min.
Cette
phase
a
été
complétée
par
des
images
statiques
du
crâne
de
cinq
minutes
et
d’une
TEMP
du
rachis
et
des
membres
inférieurs.
Ces
images
étaient
le
reflet
de
la
captation
osseuse
et
de
l’importance
de
l’activité
ostéoblastique
de
l’os
sain
et
pathologique.
3.
Résultats
La
SO
a
montré
au
temps
précoce
une
discrète
asymétrie
de
captation
des
diaphyses
fémorales
en
faveur
du
côté
droit
(Fig.
2a).
Au
temps
tardif,
la
SO
a
montré
une
hypofixation
temporale
gauche
entourée
d’un
liseré
d’hyperfixation
et
un
foyer
d’hyperfixation
intense
en
regard
de
l’épine
de
l’omoplate
droite
(Fig.
2b).
Ces
aspects
scintigraphiques
ont
été
mieux
individualisés
sur
les
acquisitions
statiques
de
profil
(Fig.
2c).
L’examen
a
été
complété
par
une
tomoscintigraphie
qui
a
montré
une
hyperfixation
modérée
et
hétérogène
avec
un
aspect
d’élargissement
médullaire
de
la
diaphyse
fémorale
droite
(Fig.
3).
Devant
l’anomalie
de
fixation
de
l’omoplate
droite,
une
tomodensitométrie
a
été
demandée
et
a
révélé
une
plage
d’ostéolyse
scapulaire
droite
(Fig.
1e),
confirmant
une
troisième
localisation
de
l’HL
scapulaire
droite.
Le
patient
a
été
traité
par
corticothérapie
à
la
dose
de
1
mg/kg
par
jour
en
association
avec
des
cures
hebdomadaires
de
vinblastine
à
la
dose
de
4
mg
pendant
huit
semaines.
L’évolution
fut
favorable
après
chimiothérapie
par
voie
générale.
4.
Discussion
Les
histiocytoses
constituent
un
groupe
de
maladies
chroniques
et
hétérogènes,
caractérisées
par
la
prolifération
et/ou
l’activation
des
cellules
histiocytaires,
et
qui
sont
responsables
d’une
atteinte
multiviscérale
et
pluritissulaire.
Elles
sont
divisées
en
trois
groupes
:
A.
Matrane
et
al.
/
Médecine
Nucléaire
36
(2012)
730–735
731

le
groupe
I
correspond
aux
histiocytoses
langerhansiennes
qui
regroupent
les
maladies
de
Hand-Shüller-Christian,
Letterer-Siwe,
Hashimoto-Pritzker
et
le
granulome
éosinophile
;
le
groupe
II
correspond
aux
histiocytoses
non
langerhan-
siennes
dont
les
plus
connues
sont
la
maladie
de
Whipple,
les
maladies
de
Gaucher
et
de
Niemann-Pick
et
la
maladie
d’Erdheim-Chester
;
le
groupe
III
correspond
aux
histiocytoses
malignes
[5–7].
L’histiocytose
langerhansienne
est
une
pathologie
proliféra-
tive
clonale
des
cellules
dendritiques
de
Langerhans,
pouvant
se
manifester
sous
forme
de
lésions
localisées
ou
généralisées.
Les
formes
radiocliniques
de
la
maladie
sont
[6,8]
:
la
maladie
de
Letterer-Siwe
est
la
forme
aiguë
systémique
du
nourrisson,
caractérisée
par
des
lésions
cutanées
étendues
et
une
atteinte
polyviscérale.
Cette
forme
est
d’évolution
généralement
rapide
et
de
mauvais
pronostic
;
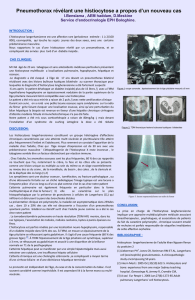
Fig.
1.
Radiographie
du
crâne
:
image
d’ostéolyse
au
niveau
de
l’os
temporal
gauche
(A).
TDM
du
rocher
:
processus
lésionnel
de
la
pyramide
pétreuse
gauche
avec
lyse
osseuse
étendue
(B).
Radiographie
du
fémur
droit
:
image
ostéolytique
du
tiers
inférieur
de
la
diaphyse
fémorale
droite
(C).
IRM
du
fémur
droit
:
lésion
tumorale
maligne
de
l’extrémité
inférieure
du
fémur
droit
(D).
TDM
scapulaire
:
plage
d’ostéolyse
scapulaire
droit
(E).
Skull
radiograph:
osteolysis
image
in
the
left
temporal
bone
(A).
CT-scan
of
the
rock:
lesional
process
of
left
petrous
pyramid
with
extensive
osteolysis
(B).
Right
femur
radiograph:
osteolytic
image
in
the
lower
1/3
of
the
right
femoral
shaft
(C).
Right
femur
MRI:
malignant
tumor
lesion
in
the
right
distal
femur
(D).
Scapular
range
CT-scan:
scapular
osteolysis
(E).
A.
Matrane
et
al.
/
Médecine
Nucléaire
36
(2012)
730–735732

la
maladie
de
Hand-Schüller-Christian
est
caractérisée
par
une
triade
clinique
comprenant
des
lacunes
osseuses
du
crâne,
un
diabète
insipide
et
une
exophtalmie
(souvent
unilatérale).
L’évolution
est
chronique
avec
des
séquelles
importantes
;
la
maladie
de
Hashimoto-Pritzker
(ou
histiocytose
congéni-
tale
auto-involutive)
touche
le
nouveau-né
et
est
d’évolution
spontanément
favorable
le
plus
souvent
;
le
granulome
éosinophile
(ou
atteinte
localisée
au
tissu
osseux)
peut
être
uni-
ou
multifocal,
généralement
de
bon
pronostic.
L’atteinte
osseuse
(ou
granulome
éosinophile)
est
la
plus
fréquente
des
localisations
de
l’HL
(50
à
70
%),
elle
prédomine
au
niveau
des
régions
médullaires
ayant
une
activité
hématopoïétique.
Le
granulome
éosinophile
peut
être
unique
(90
%)
ou
multiple
(10
%)
avec
des
atteintes
simultanées
ou
successives.
Son
siège
de
prédilection
est
l’os
plat
(crâne,
côtes,
sternum,
os
iliaques,
omoplate),
les
vertèbres,
mais
également
les
os
longs
(fémur,
humérus,
tibia).
Les
petits
os
des
mains
ou
des
pieds
sont
rarement
atteints
[9–11].
Sur
le
plan
clinique,
ces
lésions
peuvent
être
asymptoma-
tiques
et
de
découverte
radiologique
fortuite
(lacune
osseuse
à
l’emporte-pièce
sans
condensation
périphérique)
ou
respon-
sables
de
douleurs
localisées,
de
tuméfaction
douloureuse
des
parties
molles,
de
fracture
pathologique
ou
de
signes
neurologiques
en
rapport
avec
une
compression
médullaire
ou
radiculaire
secondaire
à
un
tassement
vertébral
et
un
recul
du
mur
postérieur
[12–15].
Dans
l’atteinte
de
l’os
temporal,
révélatrice
dans
notre
cas,
l’HL
peut
se
manifester
par
une
otorrhée,
une
hypoacousie
ou
des
otites
à
répétition.
Ces
signes
cliniques
ont
été
retrouvés
chez
notre
patient.
La
découverte
d’une
HL
impose
un
bilan
d’extension
radiologique
afin
d’apprécier
le
degré
de
dis-
sémination
de
l’affection
et
de
mieux
préciser
les
indications
thérapeutiques.
Les
radiographies
standard
ont
une
sensibilité
élevée,
mais
une
spécificité
faible.
Le
crâne
est
la
localisation
osseuse
préférentielle
;
les
os
les
plus
atteints
sont
l’os
temporal,
l’orbite,
la
voûte
crânienne
et
les
os
de
la
face.
Les
images
radiologiques
peuvent
être
normales
ou
montrent
classiquement
des
lésions
uniques
ou
multiples
typiquement
lytiques,
réalisant
des
lacunes
osseuses
dites
en
«
carte
de
géographie
»
ou
à
«
l’emporte-pièce
»
avec
ou
sans
sclérose
périphérique
[16,17].
Au
niveau
des
os
long,
les
lésions
sont
essentiellement
diaphysaires
réalisant
des
images
d’ostéolyse
ovalaire
avec
appositions
périostées,
souvent
lamellaires.
Certaines
lésions
lytiques
peuvent
contenir
des
séquestres
osseux.
Ces
aspects
radiologiques
ont
été
retrouvés
chez
notre
patient.
La
SO
à
l’HMDP-Tc
99m
est
une
technique
d’imagerie
fonctionnelle
qui
permet
le
diagnostic
topographique,
la
quantification
et
le
suivi
évolutif
de
lésions
osseuses.
C’est
un
examen
reproductible
et
très
sensible
qui
permet
en
un
seul
temps
d’explorer
l’ensemble
du
squelette.
Toutefois,
la
spécificité
de
la
SO
planaire
reste
médiocre
pour
le
diagnostic
de
certains
foyers
d’hyperfixation
du
radiotraceur,
en
particu-
lier
au
niveau
du
squelette
axial.
Fig.
2.
Scintigraphie
osseuse
à
l’HMDP-
99m
Tc.
Temps
osseux
précoce
:
asymétrie
de
captation
des
diaphyses
fémorales
en
faveur
du
côté
droit
(A).
Temps
osseux
tardif
(B.
Corps
entier
–
faces
antérieure
et
postérieure.
C.
Crâne
–
profils
droit
et
gauche)
:
hypofixation
temporale
gauche
entourée
d’un
liseré
d’hyperfixation
et
un
foyer
d’hyperfixation
intense
en
regard
de
l’épine
de
l’omoplate
droite.
HMDP-
99m
Tc
bone
scan.
Blood
pool
image:
increased
uptake
in
right
femoral
diaphysis
(A).
Delayed
planar
images
(B.
Total
body
–
anterior
and
posterior
views.
C.
Skull
–
right
and
left
profiles):
decrease
uptake
in
left
temporal
bone
surrounded
by
an
increased
uptake
and
high
uptake
in
the
edge
of
the
right
scapula.
A.
Matrane
et
al.
/
Médecine
Nucléaire
36
(2012)
730–735
733

Dans
l’HL,
elle
participe
au
bilan
d’extension
de
la
maladie
en
montrant
des
lésions
infracliniques
ou
infraradiologique
et
oriente
ainsi
la
recherche
pour
les
localisations
multiples
à
distance
[17–20].
La
SO
peut
montrer
des
foyers
d’hyperfixa-
tion
en
cas
de
lésions
ostéocondensantes
ou
des
foyers
d’hypofixation
en
cas
de
lésions
lytiques
pures
sans
réaction
œdémateuse.
La
normofixation
correspond
à
des
lésions
de
petite
taille
ou
à
des
lésions
où
la
tumeur
est
encore
cantonnée
au
canal
médullaire.
Les
localisations
au
niveau
du
rachis,
du
pelvis
ou
du
crâne
sont
mieux
analysées
par
l’imagerie
hybride
TEMP/TDM,
qui
permet
une
localisation
anatomique
précise
des
lésions
langerhansiennes
et
une
amélioration
de
la
spécificité
[18,19,21].
Cependant,
l’utilisation
de
la
TEMP/TDM
améliore
les
performances
de
l’examen
et
augmente
sa
sensibilité
dans
la
détection
des
lésions
osseuses,
en
particulier
sur
le
rachis.
Elle
contribue
à
diminuer
la
proportion
des
résultats
indéterminés
de
la
SO
(de
60
à
70
%)
et
réduit
la
nécessité
de
recourir
à
des
explorations
radiologiques
complémentaires.
En
effet,
de
nombreuses
études
ont
montré
le
gain
diagnostique
de
la
TEMP/TDM
par
rapport
à
la
TEMP
seule
et
la
scintigraphie
planaire
pour
caractériser
les
lésions
osseuses
dans
l’ensemble
des
indications
rhumatologiques
et
oncologiques
lorsque
ces
lésions
sont
indéterminées
[22,23].
Dans
notre
cas,
la
SO
a
permis
de
faire
un
bilan
d’extension
de
la
maladie
sur
l’ensemble
du
squelette
en
montrant,
en
plus
des
localisations
temporale
et
fémorale
droites
confirmées
sur
la
tomodensitométrie,
un
foyer
d’hyperfixation
intense
en
regard
de
l’épine
de
l’omoplate
droite,
compatible
dans
le
contexte
avec
une
autre
localisation
de
l’HL.
Dans
le
granulome
éosinophile,
la
SO
positive,
précocement
dès
les
premières
heures,
a
une
bonne
sensibilité
qui
augmente
significativement
pour
les
lésions
actives
et
multiples.
Elle
permet
de
localiser
d’éventuelles
autres
atteintes
sur
lesquelles
des
clichés
centrés
seront
effectués.
Dans
notre
cas,
la
localisation
scapulaire
a
été
confirmée
par
la
TDM
qui
a
montré
une
plage
d’ostéolyse
scapulaire
droite,
d’où
la
complémentarité
des
examens.
La
SO
est
également
utilisée
dans
la
surveillance
de
l’évolution
de
l’HL
et
dans
le
suivi
de
la
réponse
au
traitement.
La
tomographie
par
émission
de
positons
(TEP)
couplée
au
scanner
permet
une
meilleure
approche
tridimensionnelle
des
lésions.
Elle
réalise
en
un
seul
examen
une
cartographie
précoce
avec
une
bonne
analyse
des
lésions
osseuse
et
viscérale
qui,
du
fait
de
son
pronostic,
doit
faire
discuter
un
traitement
plus
agressif.
En
raison
de
sa
grande
sensibilité,
la
TEP
permet
de
détecter
précocement
des
lésions
asymptomatiques,
en
particulier
les
lésions
ne
fixant
pas
le
diphosphonate
technétié,
en
donnant
des
informations
sur
les
lésions
viscérales
et
sur
l’activité
des
lésions.
Elle
est
également
indiquée
pour
le
suivi
de
la
maladie
et
l’évaluation
de
la
réponse
thérapeutique,
avec
une
meilleure
sensibilité
que
la
SO
[20,24–26].
La
TEP/TDM
au
18
F-FDG
est
utile
au
bilan
d’extension
de
l’HL,
particulièrement
pour
les
lésions
de
petite
taille,
les
foyers
cantonnés
au
canal
médullaire
et
les
formes
pluritissulaires
[24].
La
tomodensitométrie
permet
de
confirmer
la
présence
d’une
ostéolyse
et
d’apprécier
l’importance
de
la
rupture
corticale
et
de
la
réaction
périostée.
Dans
certaines
localisa-
tions
difficiles
(la
base
du
crâne,
le
rachis
ou
les
ceintures),
la
TDM
est
utilisée
pour
sa
résolution
spatiale
pour
analyser
l’étendue
des
lésions
et
guider
la
biopsie
osseuse
nécessaire
au
diagnostic
[16,17,27,28].
C’est
un
examen
très
sensible,
souvent
prescrit
pour
localiser
une
lésion
non
vue
à
la
radiographie
mais
diagnostiquée
sur
une
hyperfixation
scintigraphique.
Dans
notre
cas,
guidée
par
le
foyer
d’hyperfixation
de
l’épine
de
l’omoplate
droite
sur
la
SO,
la
TDM
a
montré
une
plage
d’ostéolyse
scapulaire
droite
compatible
dans
le
contexte
avec
une
troisième
localisation
osseuse
de
l’HL.
Fig.
3.
Tomoscintigraphie
:
hyperfixation
modérée
et
hétérogène
avec
un
aspect
d’élargissement
médullaire
de
la
diaphyse
fémorale
droite.
SPECT:
a
moderate
and
heterogeneous
increase
uptake
with
an
extensive
cord
pattern
of
the
right
femoral
shaft.
A.
Matrane
et
al.
/
Médecine
Nucléaire
36
(2012)
730–735734
 6
6
1
/
6
100%