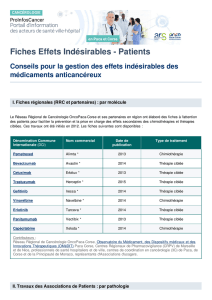
L`association d`une thérapie ciblée au traitement standard semble

La lettre d'information aux patients
La lettre d'information aux patients
Nov. 2011 - n° 19
Comité Editorial :
Pr David AZRIA (CLCC Montpellier)
Dr Eric DEUTSCH (IGR Villejuif)
Dr Jean GENEVE (R&D UNICANCER)
Béata JUZYNA (R&D UNICANCER)
Marie LANTA (LNCC)
Dr Françoise MAY-LEVIN (LNCC)
Conception-Réalisation :
Franck FONTENAY, RCP Communication
Impression :
IDEM 41
Les résultats de deux essais
L’association d’une thérapie ciblée
au traitement standard semble
trop toxique
Deux essais ont été entrepris par le groupe UNICANCER, qui réunit les
Centres de lutte contre le cancer, pour évaluer une thérapie ciblée dans
le traitement du cancer du canal anal et du cancer du rectum. Ces deux
essais visaient à déterminer si l’ajout de la thérapie ciblée permettait
d’améliorer l’efficacité du traitement par rapport au schéma standard.
Malheureusement, il a été constaté une toxicité importante dans l’un et
l’autre essai qui a amené à leur arrêt. Ces données conduisent à ne pas
recommander les traitements évalués chez les personnes présentant un
cancer du canal anal ou du rectum localement avancé.
[Cancer du canal anal et du rectum]

Qu’est-ce que le cancer du canal anal ?
Le canal anal est la partie terminale du tube digestif. Situé entre le rectum et la partie
extérieure de l’anus, il mesure de trois à quatre centimètres. Les cancers qui se développent
au niveau du canal anal sont rares puisqu’ils représentent de 1 % à 2 % de l’ensemble des
cancers de l’appareil digestif. Il semble cependant en augmentation, notamment chez les
hommes ayant des relations sexuelles avec d’autres hommes. Toutefois, ce type de cancer
reste globalement plus fréquent chez les femmes. Le cancer du canal anal survient le plus
souvent chez des personnes âgées de plus de 60 ans, deux tiers des patients ayant plus de
65 ans.
Le cancer du canal anal est fortement associé à l’infection par le papillomavirus (HPV), puisque
ce virus est retrouvé dans 80 % à 85 % des cas. Les autres facteurs de risque principaux sont
l’infection par le virus du sida (VIH) et le tabagisme.
Quels sont les traitements standards du cancer du canal anal ?
Jusqu’au milieu des années 80, le principal traitement du cancer du canal anal reposait sur une
intervention chirurgicale visant à retirer la tumeur. Ce type d’intervention n’était pas sans
répercussion, puisque la majorité des patients ainsi opérés devait subir une colostomie, c’est-
à-dire l’implantation d’une dérivation partant du colon et aboutissant sur la paroi cutanée
dans la région abdominale, afin de permettre l’évacuation des matières fécales. De plus, les
récidives étaient fréquentes. A l’heure actuelle, la chirurgie est pratiquée uniquement chez
les patients présentant une tumeur de petite taille.
Aujourd’hui, le traitement standard repose sur l’association d’une radiothérapie locale et d’une
chimiothérapie générale. La radiothérapie est habituellement réalisée sur plusieurs semaines.
La chimiothérapie, qui est délivrée pendant la radiothérapie, associe deux médicaments,
le 5-fluorouracil (ou 5-FU) et soit la mitomycine C, soit le cisplatine. Ce traitement peut
notamment s’accompagner d’une inflammation des muqueuses (mucite) de la région anale
nécessitant des soins locaux. Ces effets indésirables se résorbent généralement dans les
semaines qui suivent l’arrêt du traitement.
Ce type de traitement permet d’obtenir une rémission prolongée chez une majorité de patients.
[ UNE
PRÉSENTATION
AU CONGRÈS
DE L’ASCO ]
L’essai ACCORD 16/0708
était un « essai de phase
2 évaluant l’efficacité
et la tolérance d’un
traitement associant une
radiochimiothérapie par
cisplatine et 5-FU à un
traitement par cétuximab,
chez des patients ayant
un cancer anal localement
avancé ».
Ces résultats ont fait
l’objet d’une présentation
au congrès de l’American
Society of Clinical
Oncology qui s’est tenu à
Chicago (États-Unis) du
1er au 5 juin 2011.
RectumCanal anal
ACCORD 16/0708 – Cancer du canal anal
Une trop forte toxicité
Pourquoi l’essai ACCORD 16/0708 a-t-il été entrepris ?
Si les traitements standards actuels sont efficaces, ils ne le sont pas à 100 %
chez toutes les personnes atteintes d’un cancer du canal anal. Dès lors, les
recherches se poursuivent pour tenter d’améliorer l’efficacité des traitements.
C’est dans cet esprit qu’a été conçu l’essai ACCORD 16/0708.
Quel était l’objectif de l’essai ?
L’essai ACCORD 16/0708 visait à évaluer si l’adjonction d’une thérapie ciblée à
l’un des schémas thérapeutiques standards permettait d’améliorer l’efficacité
du traitement. La thérapie ciblée reposait sur l’administration d’un médicament
appelé cetuximab. Il s’agit de ce que l’on appelle un anticorps monoclonal :
c’est un médicament qui imite le fonctionnement des anticorps naturels
de l’organisme et qui agit sur une cible spécifique. En l’occurrence, la cible
du cetuximab est le récepteur EGFR (récepteur de croissance des cellules
épithéliales). Ce dernier est naturellement présent à la surface de toutes les
cellules du corps car il participe au bon fonctionnement de celles-ci. Il a été
montré dans plusieurs formes de cancers que le nombre de ce récepteur est
augmenté sur les cellules tumorales. Cette « surexpression » de l’EGFR favorise
la croissance de ces cellules et donc de la tumeur. En bloquant le récepteur
EGFR, les anticorps monoclonaux tels que le cetuximab contribuent à empêcher
les cellules cancéreuses de proliférer.
Dans des cancers de la sphère ORL, des essais ont mis en évidence que l’ajout
du cetuximab à une radiothérapie et une chimiothérapie permet d’améliorer
l’efficacité du traitement. L’objectif de l’essai ACCORD 16/0708 était de voir si
un effet similaire pouvait être obtenu chez des personnes atteintes d’un cancer
du canal anal.

Qui a participé à l’essai ?
L’essai ACCORD 16/0708 s’adressait à des patients présentant la forme la plus fréquente de
cancer du canal anal, celui-ci devant être à un stade dit « localement avancé ». Cela signifie
que la taille de la tumeur était relativement importante, mais que cette dernière ne touchait
pas les ganglions environnants et qu’elle ne s’était pas étendue à d’autres localisations à
distance (métastases).
L’essai, qui a débuté en mars 2009 dans une quinzaine de centres hospitaliers en France,
prévoyait d’inclure au total 77 patients. Une analyse des données recueillies auprès des 35
premiers participants était prévue qui devait permettre de déterminer si l’essai pouvait ou
non se poursuivre. En réalité, l’essai a été interrompu après l’inclusion de 16 patients (14
femmes et deux hommes).
Quel traitement ont-ils reçu ?
Le traitement proposé était le suivant :
- La thérapie ciblée par cetuximab pendant 6 semaines, administrée une fois par semaine par
perfusion intraveineuse.
- Une radiothérapie pendant 5 semaines, administrée 5 jours par semaine.
- Une chimiothérapie par 5-FU, administrée pendant 4 jours à deux reprises, et par cisplatine,
administré deux fois. Ces deux médicaments sont injectés par perfusion intraveineuse.
La thérapie ciblée commençait une semaine avant la radiothérapie, puis se poursuivait pendant
la durée de celle-ci. La chimiothérapie était elle aussi administrée pendant la radiothérapie,
lors de la première et de la dernière semaine de celle-ci.
Seulement la moitié des patients inclus ont reçu la totalité de ce traitement.
Pourquoi l’essai a-t-il été arrêté prématurément ?
La tolérance au traitement proposé a été médiocre. En effet, l’essai ACCORD 16/0708 a été
interrompu une première fois en juillet 2009 après l’inclusion de 10 patients lorsqu’il a été
constaté que trois d’entre eux ont présenté des effets indésirables graves. Après analyse
des dossiers des participants, les responsables de l’essai ont décidé de diminuer la dose du
5-FU, dans l’espoir d’améliorer la tolérance du traitement expérimental, et de reprendre les
inclusions en décembre 2009. Six patients supplémentaires ont alors été inclus, dont trois
ont présenté à nouveaux des effets indésirables sévères. Les inclusions ont dès lors été
suspendues en mai 2010, puis l’essai définitivement arrêté en novembre 2010.
Les effets indésirables les plus sérieux ont été une baisse importante de certaines cellules du
sang, exposant à un risque élevé d’infections, des diarrhées et des troubles cutané sous forme
d’acné ou de rougeurs s’apparentant à des coups de soleil. Chez trois patients, des effets
indésirables ont persisté pendant plusieurs mois.
Que faut-il penser de ce résultat ?
La conclusion à tirer de l’essai ACCORD 16/0708 est malheureusement évidente : le
traitement évalué, à savoir l’ajout d’une thérapie ciblée par cetuximab au traitement
standard, ne peut être recommandé pour traiter les personnes atteintes d’un cancer du
canal anal localement avancé. Même s’il est peut-être efficace (ce que l’essai ne peut
montrer compte tenu du faible nombre de patient inclus), ce schéma thérapeutique
expose à trop d’effets indésirables et présente donc trop de risque pour les patients.
Un tel résultat n’est jamais une bonne nouvelle ! C’est néanmoins une information
importante qui permettra d’éviter qu’à l’avenir d’autres patients se voient proposer le
traitement évalué et soient donc exposés à des risques d’effets indésirables graves. D’où
l’importance de faire connaître ce résultat auprès des médecins et des patients.
[ LEXIQUE ]
• Chimiothérapie : thérapie
comprenant un ou
plusieurs les médicaments
qui visent à détruire les
cellules cancéreuses ou
à les empêcher de se
multiplier, entraînant leur
mort. Ils peuvent être
administrés par perfusion
ou par voie orale.
• Effet indésirable :
réaction nocive et
non désirée liée à un
médicament.
• Radiothérapie :
traitement local du cancer
à l’aide d’un appareil qui
émet des rayons. Ces
rayons, dirigés vers la
tumeur, vont la détruire.
Ce traitement se fait dans
un service spécialisé de
radiothérapie. On parle
aussi de rayons ou de
séance de rayons.
• Récidive : réapparition
des signes ou des
symptômes signalant
la présence du cancer
après une rémission. Une
récidive peut survenir très
tôt après les traitements,
mais aussi après une
longue période de
rémission apparente.
• Rémission : diminution
ou disparition des signes
et des symptômes d’une
maladie.
ACCORD 14 et ACCORD 16 étaient des essais pilotes évaluant des traitements expérimentaux
auprès d’un nombre limité de patients. De tels essais sont indispensables au progrès médical. Si
les résultats sont prometteurs, ils permettent de pouvoir évaluer les nouveaux traitements auprès
d’un nombre beaucoup plus important de patients. Dans le cas contraire, de tels essais permettent
d’éviter d’exposer un grand nombre de patients à des traitements insuffisamment efficaces ou trop
toxiques. Comme tous les essais cliniques, ces essais pilotes font l’objet d’une surveillance très
précise, permettant de détecter rapidement les éventuels problèmes qui pourraient survenir. Pour
chaque essai, des professionnels spécialistes de la recherche clinique (Assistants de Recherche
Clinique et Département de pharmacovigilance) contrôlent en permanence les données recueillies,
notamment pour détecter tout événement susceptible de remettre en cause l’intérêt de l’essai.
C’est ce qui s’est produit pour ACCORD 14 et ACCORD 16.

ACCORD 14/0604 – Cancer du rectum
Toxicité importante et efficacité insuffisante
Quel était l’objectif de l’essai ?
L’essai ACCORD 14/0604 visait à évaluer un traitement associant une thérapie ciblée par
cetuximab à une radiothérapie et une chimiothérapie avant intervention chirurgicale pour
le traitement du cancer du rectum. La chimiothérapie associait deux médicaments, la
capécitabine et l’oxaliplatine. Une fois l’opération réalisée, le traitement était complété par
une nouvelle chimiothérapie par folfox4 (qui combine le 5-FU et l’oxaliplatine) associée à la
même thérapie ciblée.
Le traitement standard du cancer du rectum repose sur une radiothérapie et une chimiothérapie
par un médicament appelé capécitabine. L’objectif de l’essai ACCORD 14/0406 était notamment
de voir si l’intensification du traitement, notamment par l’ajout de la thérapie ciblée,
permettait d’obtenir une plus grande efficacité pour réduire la taille de la tumeur et ainsi
favoriser les chances de succès de l’intervention chirurgicale.
Qui a participé à l’essai ?
L’essai ACCORD 14/0604 s’adressait à des patients présentant un cancer du rectum dit
« localement avancé » avec des localisations secondaires (métastases) se situant à proximité
de la tumeur initiale et qui pouvaient a priori être retirées en même temps que cette dernière
lors de l’intervention chirurgicale.
L’essai a démarré en octobre 2007. Il était prévu de réaliser une analyse des données recueillies
auprès des 12 premiers patients avant de décider de la poursuite ou pas de l’essai.
Le recrutement des patients a ainsi été suspendu en novembre 2009, après l’inclusion de 19
patients, dont 12 ont reçu la totalité du traitement prévu. Il s’agissait de 14 hommes et de 5
femmes, dont l’âge médian était de 60 ans.
Quel traitement ont-ils reçu ?
Le schéma thérapeutique prévu était le suivant :
Avant l’intervention chirurgicale
- Une radiothérapie, 5 jours sur 7, pendant 5 semaines.
- Une chimiothérapie administrée une fois par semaine par perfusion intraveineuse pour
l’oxaliplatine et pris par voie orale 5 jours sur 7 pour la capécitabine.
- Une thérapie ciblée par cetuximab administrée une fois par semaine par perfusion
intraveineuse.
La chimiothérapie et la thérapie ciblée étaient administrées pendant les 5 semaines de la
radiothérapie.
Après l’intervention chirurgicale
- Une thérapie ciblée par cetuximab administrée une fois par semaine pendant 6 semaines.
- Une chimiothérapie par folfox4 administrée toutes les deux semaines pendant 12
semaines.
Quels ont été les résultats observés ?
L’analyse des informations recueillies auprès des 19 patients inclus a montré une fréquence
importante d’effets indésirables graves. Neuf participants ont ainsi présenté des effets
indésirables sérieux, en particulier des diarrhées importantes, conduisant à un arrêt du
traitement pour 5 d’entre eux. Par ailleurs, l’efficacité a été jugée insuffisante. Même si 13
patients ont pu être opérés, 7 ont ensuite présenté une progression de leur maladie au cours
des 12 mois qui ont suivi l’intervention.
Que faut-il penser de ces résultats ?
Au vu des résultats de l’analyse, les responsables de l’essai ont décidé l’arrêt de
l’essai en raison de la toxicité observée du traitement. Cette décision est justifiée
également par le manque d’efficacité constaté. Il apparaît ainsi clairement que
le traitement proposé ne peut pas être recommandé pour la prise en charge des
personnes atteintes d’un cancer du rectum localement avancé avec des métastases
à proximité.
Ligue Nationale Contre
le Cancer
14 rue Corvisart
75 013 Paris
www.ligue-cancer.net
UNICANCER
101 avenue de Tolbiac
75 013 Paris
www.unicancer.fr
Pour toute demande
d’exemplaires de ce
numéro, s’adresser à
Corinne Gamet
R&D UNICANCER
101 rue de Tolbiac
75 654 Paris cedex 13
c-gamet@unicancer.fr
Adresses utiles
1
/
4
100%