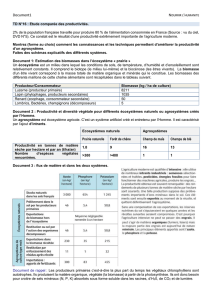
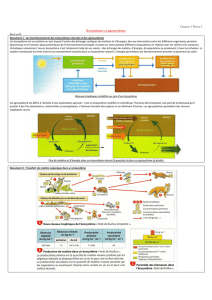
Approche pour l`évaluation et le suivi de la santé de l`écosystème

Approche pour l’évaluation et le suivi de la santé de
l’écosystème, avec application à la communauté à
Mya–Macoma
Susanne Mark, Lizon Provencher et Jean Munro
Direction Régionale des Sciences
Ministère des Pêches et des Océans
Institut Maurice-Lamontagne
850 route de la Mer
C.P. 1000
Mont-Joli, Québec, G5H 3Z4
2003
Rapport technique canadien des
sciences halieutiques et aquatiques 2491
Pêches
et Océans
Fisheries
and Oceans

Rapport technique canadien des
sciences halieutiques et aquatiques
Les rapports techniques contiennent des renseignements scientifiques et techniques qui constituent une
contribution aux connaissances actuelles, mais qui ne sont pas normalement appropriés pour la publication dans
un journal scientifique. Les rapports techniques sont destinés essentiellement à un public international et ils sont
distribués à cet échelon. Il n’y a aucune restriction quant au sujet; de fait, la série reflète la vaste gamme des
intérêts et des politiques du Ministère des Pêches et Océans, c’est-à-dire les sciences halieutiques et aquatiques.
Les rapports techniques peuvent être cités comme des publications intégrales. Le titre exact paraît au-
dessus du résumé de chaque rapport. Les rapports techniques sont indexés dans la base de données Aquatic
Sciences and Fisheries Abstracts.
Les numéros 1 à 456 de cette série ont été publiés à titre de rapports techniques de l’Office des
recherches sur les pêcheries du Canada. Les numéros 457 à 714 ont paru à titre de rapports techniques de la
Direction générale de la recherche et du développement, Service des pêches et de la mer, Ministère de
l’Environnement. Les numéros 715 à 924 ont été publiés à titre de rapports techniques du Service des pêches et
de la mer, Ministère des Pêches et de l’Environnement. Le nom actuel de la série a été établi lors de la parution
du numéro 925.
Les rapports techniques sont produits à l’échelon régional, mais numérotés à l’échelon national. Les
demandes de rapports seront satisfaites par l’établissement d’origine dont le nom figure sur la couverture et la
page du titre. Les rapports épuisés seront fournis contre rétribution par des agents commerciaux.
Canadian Technical Report of
Fisheries and Aquatic Sciences
Technical reports contain scientific and technical information that contribute to existing knowledge but
that are not normally appropriate for primary literature. Technical reports are directed primarily toward a
worldwide audience and have an international distribution. No restriction is placed on subject matter, and the
series reflects the broad interests and policies of the Department of Fisheries and Oceans, namely, fisheries and
aquatic sciences.
Technical reports may be cited as full publications. The correct citation appears above the abstract of
each report. Each report is indexed in the data base Aquatic Sciences and Fisheries Abstracts.
Numbers 1-456 in this series were issued as Technical Reports of the Fisheries Research Board of
Canada. Numbers 457-714 were issued as Department of the Environment, Fisheries and Marine Service,
Research and Development Directorate Technical Reports. Numbers 715-924 were issued as Department of
Fisheries and the Environment, Fisheries and Marine Service Technical Reports. The current series name was
changed with the report number 925.
Technical reports are produced regionally but are numbered nationally. Requests for individual reports
will be filled by the issuing establishment listed on the front cover and title page. Out-of-stock reports will be
supplied for a fee by commercial agents.


Rapport technique canadien des
sciences halieutiques et aquatiques 2491
2003
Approche pour l’évaluation et le suivi de la santé de l’écosystème, avec application à la
communauté à Mya–Macoma
Susanne Mark, Lizon Provencher et Jean Munro
Direction Régionale des Sciences
Ministère des Pêches et des Océans
Institut Maurice-Lamontagne
850 route de la Mer
C.P. 1000
Mont-Joli, Québec, G5H 3Z4

ii
©Ministre des Travaux publics et Services gouvernementaux Canada 2003
No. de Cat. Fs 97-6 /2491 ISSN 0706-6570
On devra citer la publication comme suit :
Mark, S., L. Provencher, et J. Munro, 2003. Approche pour l’évaluation et le suivi de la santé
de l’écosystème, avec application à la communauté à Mya–Macoma. Rapp. tech. can. sci.
halieut. aquat. 2491: ix + 85 pp.
This publication is also available in english.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
1
/
98
100%