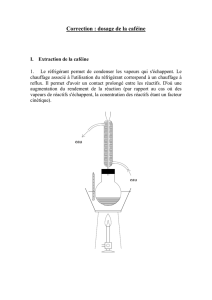
Correction de l`exercice : Préparation d`un médicament

Correction de l’exercice : Préparation d’un médicament
1) a) Le solvant apolaire est le benzène. En effet, la formule du benzène ne comporte que des atomes de
carbone et d’hydrogène (atomes ayant des électronégativités très proches, considérées comme
identiques).
b) L’indication de solubilité dans l’eau est cohérente. En effet, le benzène, étant apolaire, il ne peut
pas être soluble dans l’eau qui est un solvant polaire.
2) Oui. Une molécule d’eau possède 2 atomes d’hydrogène liés à un atome très électronégatif (O)
porteur de doublets non liants. Chacun de ces atomes d’hydrogène peut donc former une liaison
hydrogène avec un atome d’oxygène (très électronégatif…) de la molécule d’éther diéthylique (ou
d’acétate d’éthyle). (attention, les atomes d’hydrogène de l’éther diéthylique ou de l’acétate d’éthyle
ne le peuvent pas…)
3) Le solvant d’extraction et l’eau (solvant du café « expresso ») ne doivent pas être miscibles : d’après
le tableau, le benzène et le dichlorométhane répondent à cette condition.
Il faut aussi que la caféine (à extraire) soit plus soluble dans le solvant d’extraction que dans l’eau : la
caféine est très soluble dans le benzène et le dichlorométhane (et on suppose qu’elle y est plus soluble
que dans l’eau). Le dichlorométhane étant moins dangereux pour la santé que le benzène, c’est le
meilleur solvant (à utiliser sous la hotte, néanmoins…).
4) On a : Le dichlorométhane de densité 1,33
est plus dense que l’eau (deau = 1),
il va donc se retrouver en dessous
de la phase aqueuse.
5) On a : mcaféine = Cmcaféine × V = 12,5 × 10,0×10-3 = 0,125 g (correction du volume en terme de chiffres
significatifs pour plus de cohérence).
6) a) Il faut réaliser une dissolution.
b) A partir de l’échantillon recueilli de caféine, on pèse sur une balance (de précision) 0,125 g de
caféine. On introduit un peu d’eau distillée dans une fiole jaugée de 10 mL et on y introduit la caféine
pesée. On agite pour dissoudre le soluté. (il ne faut par terminer la solution tout de suite car il
manque un ingrédient…)
7) a) Cmacide citrique (citron) = macide citrique/Vcitron = 2,1/34×10-3 = 62 g/L
b) On calcule d’abord le rapport des concentrations massiques (en acide citrique) du jus de citron et
du médicament. On a : Cmacide citrique (citron)/Cmacide citrique = 62/12,5 = 5,0 (facteur de dilution).
Ainsi, le médicament doit être 5,0 fois moins concentrée que le jus de citron, il faut donc prélever un
volume 5,0 fois inférieur à celui du médicament : 10/5,0 = 2,0 mL.
c) Il faut prélever 2,0 mL de jus de citron à l’aide d’une pipette jaugée de 2,0 mL. On introduit le
volume dans la fiole jaugée de 10 mL (précédente). On complète avec de l’eau distillée jusqu’au trait
de jauge. On agite pour homogénéiser le médicament.
ampoule à décanter
dichlorométhane + caféine
phase aqueuse (ce qui reste du
café « expresso »)
potence
1
/
1
100%