YDBIO231 Biologie Cellulaire (II)

YDBIO231
Biologie Cellulaire (II)
Responsable : Virginie Faure
Coordonnées : [email protected]
Responsable : Claire Vourc'h
Coordonnées : [email protected]
Gestionnaire de scolarité : Estelle Tardy
Coordonnées : [email protected], tél : 0476635642
Site Web : https://espaces-collaboratifs.grenet.fr/share/page/site/UJFueDDBIO231/dashboard
Pré-requis :
DDBIO111
UE obligatoire dans les parcours :
BIO,CHB,SVT
Compétences visées :
Cours : Comprendre le fonctionnement des différents compartiments de la cellule animale et procaryote et les
mécanismes moléculaires associés à leurs fonctions.
TD : Connaitre le principe des différentes approches utilisées en biologie cellulaire: analyses in situ et in vitro des
molécules (localisation, quantification, partenaires, suivi et dynamiques d'interactions dans la cellules), notions de
fractionnement cellulaire.
TP 4 : Savoir produire, rédiger et interpréter une expérience. Initiation à la culture cellulaire, à l'analyse des constituants
cellulaires par des approches de fractionnement et des approches in situ.
ECTS : 6
Horaires :
Cours Magistral (CM) 30 h
Travaux Dirigés (TD) 13 h
TP 16 h
Heures encadrées 59 h
Travail personnel estimé 61 h
Le détail de la nature des épreuves de controle continu et des épreuves terminales de première et de deuxième session
sera communiqué au début du semestre.
Programme résumé :
Cours :
18 cours de 1h30
I- Les outils et techniques de biologie cellulaire
1- Notions d'échelles du vivant
2- Outils

- Antigènes-Anticorps, les précurseurs métaboliques, les sondes nucléiques, le microscope,
- l'électrophorèse, microscopie à fond clair et à fluorescence
3- Analyse des constituants cellulaires à partir d'extraits cellulaires et sur cellule fixées
- Southern blot, Northern Blot, Western blot
- Immunodétection/ hybridation in situ
4- Visualisation des constituants cellulaires sur cellules vivantes
- technique de pulse chase
- Marquage GFP
- La technique de FRAP
II- Le noyau cellulaire
1- L'organisation du génome dans le noyau par les approches in situ
- la chromatine (nucléosomes)
- collier de perle/solénoide/boucles territoires chromosomiques
- Organisation du génome dans le noyau
- Les lamines
- liens structure-fonction : organisation fonctionnelle
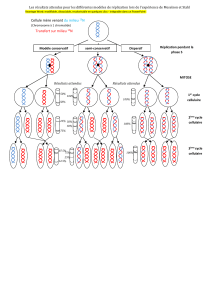
2- Réplication
- Rappel des grands principe de la réplication de l'ADN
- Mécanismes de la réplication : les fourches de réplication bidirectionnelles
- cas particulier de la réplication des télomères : la télomérase
- quelques exemples du contrôle de la réplication :
les couple cdk1/cycline B, Rb/E2F/Cdk4,6/cycline D.
Dommages de l'ADN : p53/p21,
- Cinétique de la réplication (timing de réplication/richesse en gène/euchromatine/ hétérochromatine)
- Analyse in situ de la réplication
3- la transcription et maturation
- Rappel des principes généraux de la transcription
- Promoteurs et unité de transcription
- Facteurs de transcription
- Polyadenylation, capping
- Epissage et épissage alternatif
- le nucléoles : regroupement fonctionnelle des gènes ribosomaux, synthèse et d'assemblage des ribosomes
- Analyse in situ de l'activité transcriptionnelle
4- Le transport nucleo-cytoplasmique
- les pores nucléaires
- la diffusion passive
- Les signaux NLS/NES
5- La reparation de l?ADN
- Excision de bases et de nucleotides
- Recombinaison par exchange
- Recombinaison homologue
- Fusion d?extrémités non homologues
III- La Traduction
1- Les acteurs de la traduction
1.1 les ARNm
- Les ARNm procaryotes
- Les ARNm eucaryotes

1.2 les ARNt
- Maturation
- Structure
- Fixation des acides aminés sur les ARNt,
- Interactions codon anticodon
1.3-Les ribosomes
- Structure
- Fonction
2- Mécanisme de la traduction
- L?initiation de la traduction chez les procaryotes et chez les eucaryotes
- L?élongation
- La terminaison
3- Mécanismes particuliers de la traduction
- Les ARNm monocistroniques et polycistroniques
- Initiations alternatives de la traduction
IV- Devenir des protéines néo-synthétisées
1- Le repliement des protéines et rôle des HSP
2- réticulum et Golgi
- Translocation des protéines dans le réticulum endoplasmique.
- composition (lipides, protéines)
- rôle
3-régulation du traffic vésiculaire
V- Les voies de dégradations : lysosome et protéasome
1- l?intérêt de contrôler le catabolisme et l?anabolisme protéique à l?échelle cellulaire
2- voies de dégradation des protéines dans la cellule (protéines soluble et protéines membranaires ou de sécrétion)
3- Définition et fonctionnent les lysosomes
4- Définition et fonctionnement du système lysosomes/protéasome
5- Définition et fonctionnement de la voie ubiquitine/protéasome
6- Action concertée entre les lysosomes et protéasome
VI- Energie dans la cellule
1- Thermodynamique pour la biologie
- Signification des grandeurs thermodynamiques
- Spécificités énergétiques du monde vivant
2- Les mitochondries
Ultra structure.
- Propriétés différentielles des deux membranes.
Biochimie
- La Respiration au niveau de l'organisme entier et au niveau cellulaire
- la synthèse de l'ATP
- Biosynthèse et élimination des mitochondries
3- Les péroxysomes
- Ultra structure
- Fonction
VII- Le cytosquelette
1- Les microtubules
- Localisation cellulaire et organisation
- Dynamique de la polymérisation
- Fonction: Kinésine et déplacement des organites
2- Les microfilaments

- Localisation cellulaire et organisation
- Dynamique de la polymérisation
- Fonction: Myosine contractilité et migration cellulaires
VIII- Membranes plasmiques et jonctions intra-cellulaires
IX- La cellule bactérienne
1- La membrane plasmique.
2- L'enveloppe cellulaire.
3- Les grands types d'échanges à travers ces structures: les phénomènes de
diffusion, les systèmes de transport actif (systèmes ABC, symport, antiport),
le système phosphoénolpyruvate phosphotransférase des sucres, le transport du
fer.
4- Les ribosomes.
5- Les structures externes à la cellule (capsule, pili, fimbriae, flagelles).
TP : 4 séances de 4 h organisées autour de :
- Fractionnement,
- Culture cellulaire
- Analyse des aggrégats protéiques
- Analyse in situ de cellules animales.
TD : 9 séances d'1h30 orientées autour des aspects méthodologiques
- Fractionnement cellulaire,
- Culture cellulaire et cycle cellulaire-
- Analyse de biomolécules in vitro
- Stabilité et traffic intracellulaire d?une protéine
- Analyse in situ de l?ADN, de l?ARN et des protéines-
- Dynamique des molécules dans la cellule vivante
- Oxygraphie
Epreuves de Contrôle Continu :
Type Nature Coefficient
CC1 examen de TP 0.40
CC2 controle continu de TD 0.40
Epreuve Terminale 1ère session (ET) :
Type Nature de l'épreuve Coefficient Durée
ET Interrogation écrite 1.20 1h30
NB : En cas de désaccord, ce sont les coefficients portés sur le règlement d'examen de la Licence qui prévalent.
La note finale de l'UE est une moyenne pondérée des notes de contrôle continu (CC1 et CC2) et de la note d'examen
terminal (ET), calculée selon la règle suivante.
Calcul de la note d'UE :
Règle 1 : moyenne pondérée des trois notes CC1, CC2 et ET avec leurs coefficients.
NF= noteCC1*coeffCC1+noteCC2*coeffCC2+noteET*coeffET
Si l'étudiant se présente en session 2, la note obtenue remplace la note d'examen terminal (ET) de session 1, sinon la

note (ET) de session 1 est reportée en session 2. Les notes de contrôle continu sont reportées.
Commentaires :
Connaissances évaluées dans l'UE :
examen terminal:
CONTENU DU COURS et des TD
CC2:
CONTENU DES TDs
CC1:
EXAMEN DE TP
Porte sur la capacité à reproduire une expérience et/ou à répondre à une question théorique, à légender un schéma
portant sur des connaissances abordées en TP.
1
/
5
100%