D M 1 4 DM14 • Énergétique et Cinétique

DM14 •M4|CC3
DM14 •´
Energ´etique et Cin´etique
I Mouvement d’un anneau sur une piste circulaire [ATS 2004]
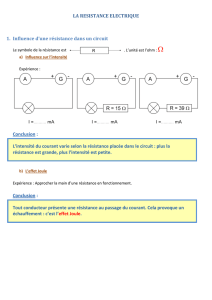
On consid`ere le dispositif de la figure ci-apr`es, o`u un anneau assimilable `a un point mat´eriel M
de masse mse d´eplace solidairement `a une piste fixe form´ee de deux parties circulaires (1) et
(2) de rayon R1et R2, de centre C1et C2, dans un plan vertical. On supposera R2> R1.
La verticale est ascendante, d’origine l’altitude du point B.
On rep`ere la position de l’anneau par un angle θpris `a partir de C1pour son mouvement sur la
partie (1), et `a partir de C2pour son mouvement sur la partie (2).
Sur la partie (1),θvarie
entre −π
2et π.
Sur la partie (2),θvarie
entre πet 5π
2.
On note gl’intensit´e
du champ de pesanteur
terrestre.
Dans tout le probl`eme,
on suppose le mou-
vement de l’anneau
s’effectue sans frotte-
ments.
On suppose dans un
premier temps que le
mouvement de l’anneau
s’effectue sur la partie
(1) du dispositif.
Lorsque l’anneau est au point E(θE= 0), il a une vitesse angulaire positive ˙
θE=dθ
dtE
>0.
1) En appliquant le th´eor`eme de l’´energie cin´etique, exprimer ˙
θ2`a un instant quelconque en
fonction de ˙
θE,R1,get θ
2) Exprimer l’´energie potentielle de pesanteur Epg de l’anneau Men supposant Epg(B) = 0 au
point B(θ=π). On distinguera les cas −π
2< θ < π et π < θ < 5π
2.
3) Tracer l’allure de Epg en fonction de θ. Pr´eciser les points correspondants sur le graphe de
Epg.
4) D´eduire graphiquement de la question pr´ec´edente qu’il existe trois positions angulaires
d’´equilibre de l’anneau, et pr´eciser leur stabilit´e.
5) V´erifier l’existence et la nature de ces trois positions d’´equilibre par le calcul.
•L’anneau ´etant initialement en A(θA=−π
2), il est lanc´e avec une vitesse v0sur le support fixe.
6) `
A quelle condition sur la vitesse v0,get R1l’anneau peut-il atteindre le point F?

DM14 •M4|CC3
Cin´etique formelle / Conductim´etrie 2011-2012
7) Cette condition ´etant remplie, donner l’expression de sa vitesse vFen F(θF=π), en fonction
des donn´ees du probl`eme.
8) La condition de la question 6) ´etant toujours remplie, y a-t-il une condition suppl´ementaire
sur v0pour que l’anneau sorte de la piste en S(θS=5π
2) ? D´eterminer vS.
II M´ecanisme de d´ecomposition du chlorure de sulfuryle
Le chlorure de sulfuryle SO2Cl2peut se d´ecomposer en phase gazeuse, selon le m´ecanisme
r´eactionnel suivant :
SO2Cl2
k1
−−−−→ •SO2Cl +Cl•(1)
•SO2Cl k2
−−−−→ SO2+Cl•(2)
Cl•+SO2Cl2
k3
−−−−→ Cl2+•SO2Cl (3)
•SO2Cl +Cl•k4
−−−−→ SO2+Cl2(4)
1) Montrer qu’il s’agit d’une r´eaction en chaˆıne en identifiant les diff´erentes phases du m´ecanisme.
2) Donner l’´equation chimique de la r´eaction de d´ecomposition du chlorure de sulfuryle.
L’´ecriture de cette ´equation chimique donne-t-elle un renseignement sur l’ordre de cette r´eaction ?
3) Identifier les interm´ediaires r´eactionnels et donner leur charge.
4) Que signifie le sigle AEQS ? En donner l’´enonc´e complet, et pr´eciser `a quelles esp`eces on peut
l’appliquer dans ce m´ecanisme.
5) En r´esolvant le m´ecanisme dans le cadre de l’AEQS, ´etablir que la r´eaction de d´ecomposition
de SO2Cl2est une r´eaction d’ordre 1. Exprimer la constante de vitesse ken fonction des
diff´erentes constantes kidu m´ecanisme.
6) On suppose que les vitesses des actes ´el´ementaires de la phase de propagation sont tr`es
grande devant les vitesse de la phase de terminaison ou d’initiation (approximation des « longues
chaînes »). Donner alors l’expression simplifiée de vet donc de kdans le cadre de cette approxi-
mation.
• Les actes élémentaires suivent tous la loi d’Arrhénius. On note Eai l’énergie d’activation de l’acte
élémentaire (i).
7) Montrer que, dans l’approximation des longues chaînes, la constante de vitesse de la réac-
tion de décomposition du chlorure de sulfuryle suit la loi d’Arrhénuis, et exprimer son énergie
d’activation Eacomme combinaison linéaire des différentes Eai du mécanisme.
8) L’énergie de liaison S-Cl est légèrement supérieure à l’énergie de liaison Cl-Cl : on note
∆χ=El(SCl)−El(ClCl). En déduire un profil énergétique plausible pour l’acte élémentaire (3)
du mécanisme.
On y fera apparaître :
- les grandeurs portées en abscisse et en ordonnée, écrites en toutes lettres
- la grandeur ∆χ
- l’énergie potentielle d’activation Ea3
2http://atelierprepa.over-blog.com/ Qadri J.-Ph. |PTSI

2011-2012
DM14 •M4|CC3
Cin´etique formelle / Conductim´etrie
Solution
I Mouvement d’un anneau sur une piste circulaire [ATS 2004]
1) Le système S={anneau}est étudié dans le référentiel terrestre supposé galiléen. Il est soumis
à son poids m−→
get à la réaction du support, normale à celui-ci car le mouvement s’effectue sans
frottement.
Dans le référentiel du laboratoire supposé galiléen, appliquons le théorème de l’énergie cinétique
entre les points E(θE= 0,˙
θE>0) et M(θ,˙
θ) :
∆Ek,E→M=W(m−→
g) + W(−→
R)
∆Ek,E→M=1
2mv2
M−1
2mv2
E=1
2m(R1˙
θ)2−1
2m(R1˙
θE)2
W(m−→
g) = −∆Epg,E→M=−(Epg(M)−Epg(E))
=−mg(zM−zE) = −mgR1(1 −cos θ)
W(−→
R) = ZM
E
−→
R·d−−→
OM = 0 car −→
R⊥d−−→
OM
On en déduit : ˙
θ2=˙
θ2
E−2g
R1
(1 −cos θ)
2) La verticale étant ascendante, :
Epg(M) = mgzM(en prenant l’origine de
l’énergie potentielle de pesanteur en z=zB=
0⇔θ=π).
cas −π
2< θ < π :Epg =−mgR1(1 + cos θ)
cas π < θ < 5π
2:Epg =−mgR2(1 + cos θ)
4) Graphiquement :
- 2 équilibres stables : Eet F
- 1 équilibre instable : B
3) Allure de l’énergie potentielle de pesan-
teur :
-mgR2
-mgR1
0
-π/2 5π/2
θ
π/2 π3π/2 2π
A
E
B
F
S
-2mgR2
5) • cas −π
2< θ < π :dEpg
dθ=mgR1sin θet d2Epg
dθ2=mgR1cos θ
-θE= 0 :dEpg
dθ(θE) = 0 et d2Epg
dθ2(θE)>0, donc : E est une position d’équilibre stable
-θB=π:dEpg
dθ(θB) = 0 et d2Epg
dθ2(θB)<0, donc : B est une position d’équilibre instable
• cas π < θ < 5π
2:dEpg
dθ=mgR2sin θet d2Epg
dθ2=mgR2cos θ
-θF= 2π:dEpg
dθ(θF) = 0 et d2Epg
dθ2(θF)>0, donc : F est une position d’équilibre stable
-θB=π:dEpg
dθ(θB) = 0 et d2Epg
dθ2(θB)<0, on retrouve que B est une position d’équilibre
instable
6) Le système est conservatif, les seules forces s’exerçant sur lui étant le poids (qui dérive de
l’énergie potentielle de pesanteur) et la réaction du support (qui ne travaille pas).
Autrement dit son énergie mécanique est constante (par application du ThmEm:dEm=δWN C =
0).
Donc Em=Cte =Em(A) = 1
2mv2
0−mgR1.
Puisque ∀MEm=Ek+Ep, toute position Matteinte par men partant de Anécessite Em≥Epg.
Qadri J.-Ph. |PTSI http://atelierprepa.over-blog.com/ 3

DM14 •M4|CC3
Cin´etique formelle / Conductim´etrie 2011-2012
Pour parvenir au point Fen partant du point A, la masse mdoit donc passer la « barrière
d’énergie potentielle » en B,i.e. ; atteindre le point Bavec une énergie cinétique non nulle.
On doit donc avoir, dans le cas où Matteint l’équilibre instable Bavec une vitesse non nulle :
Em(B)≥Epg(B)⇔Em(A)≥Epg(B)⇔1
2mv2
0−mgR1≥mgzB
|{z}
=0 car zB=0
⇔v0≥p2gR1
7) Le mouvement ayant lieu à énergie mécanique constante, on a :
Em(A) = Em(F)⇔1
2mv2
0−mgR1=1
2mv2
F−2mgR2⇔vF=qv2
0+ 2g(2R2−R1)
8) Puisque les conditions initiales sont réunies pour que le point Matteigne le point B, le
point Matteindra également tout autre point situé en-dessous de B, avec une énergie cinétique
supérieure à celle que possède Men Bpuisque Epg(B) = Epg,max (conservation de l’énergie mé-
canique : Em(A) = Em(B) = Em(S)).
Batteint donc le point Savec une vitesse : vS=qv2
0+ 2g(R2−R1)
II M´ecanisme de d´ecomposition du chlorure de sulfuryle
1) Le mécanisme proposé est celui d’une réaction en chaîne dont :
-(1) est la phase d’initiation (ou phase d’amorçage) : formation des premiers intermédiaire
réactionnels (porteurs de chaîne) — ici deux radicaux libres ;
-(2) et (3) est la phase de propagation : les porteurs de chaînes sont consommés puis régénérés
tour à tour en séquence fermée ;
-(4) est la phase de terminaison (ou phase de rupture) : les deux IR se recombinent en deux
molécules stables.
2) (1)+(2)+(3)+(4) :2SO2Cl2→2SO2+ 2Cl2
La simple écriture d’une équation chimique macroscopique ne donne aucun renseignement sur
l’ordre de la réaction. L’ordre, quand il existe, est déterminé par des études expérimentales ou
bien par la résolution du mécanisme s’il est connu, ce qui est l’objet de l’exercice.
3) Cl•désigne un atome de chlore, celui-ci possédant 7 électrons de valence donc un électron
célibataire. Donc Cl•est neutre. Par conservation de la charge dans l’étape (1), on en déduit
immédiatement que •SO2Cl est neutre également.
Cl : Cl•et •SO2Cl sont neutres
4) L’AEQS est l’Approximation des États Quasi-Stationnaires.
Proposée par Bodenstein en 1913, on peut l’énoncer comme suit : « Lorsque dans un mécanisme
réactionnel apparaissent des intermédiaires réactionnels très réactifs, alors leur concentration
reste très faible devant celle des réactifs et produits. Après une durée appelée temps d’induction,
très courte devant les temps caractéristiques de la réaction, on atteint un régime quasi stationnaire
où ces intermédiaires réactionnels sont produits et détruits sensiblement à la même vitesse. »
Ici, les deux intermédiaires •SO2Cl et Cl•sont des radicaux libres, donc a priori très réactifs.
On peut leur appliquer l’AEQS.
5) • Vitesse de la réaction complexe :
v=−d[SO2Cl2]
dt=v1+v3⇔v=k1[SO2Cl2] + k3[Cl•][SO2Cl2]⋆,
•
AEQS pour Cl•:d[Cl•]
dt=v1+v2−v3−v4a,
AEQS pour •SO2Cl :d[•SO2Cl]
dt=v1−v2+v3−v4b,
4http://atelierprepa.over-blog.com/ Qadri J.-Ph. |PTSI

2011-2012
DM14 •M4|CC3
Cin´etique formelle / Conductim´etrie
•(a,−b,2v2−2v3= 0 ⇒v2=v3⇔k2[•SO2Cl] = k3[Cl•][SO2Cl2]c,
a,+b,2v1−2v4= 0 ⇒v1=v4⇔k1[SO2Cl2] = k4[•SO2Cl][Cl•]d,
•c,→[•SO2Cl] = k3
k2
[Cl•][SO2Cl2]d,
−−→ k1
[SO2Cl2] = k4.k3
k2
[Cl•]
[SO2Cl2].[Cl•]
⇔[Cl•] = rk1k2
k3k4
e,
• En utilisant e,pour simplifier ⋆,on obtient : v=v1+v3= k1+rk1.k2.k3
k4![SO2Cl2]
• Comme la vitesse est de la forme v=k.[SO2Cl2], on conclut que la réaction est d’ordre 1,
de constante de vitesse k=k1+rk1.k2.k3
k4
6) L’énoncé nous dit que dans le cadre de l’approximation des « longues chaînes » la vitesse
d’initiation est négligeable devant les vitesse des actes élémentaires de la phase de propagation
— donc : v1≪v3. On en déduit : v=v1+v3≈v3=rk1.k2.k3
k4
.[SO2Cl2]et k≈rk1.k2.k3
k4
7) D’après l’énoncé, tous les actes élémentaires suivent la loi d’Arrhenius.
Donc : ki=Aiexp −Eai
RT (où les énergies d’activation sont en fait des énergies molaires
d’activation, par exemple en kJ.mol−1).
Donc : k=rk1.k2.k3
k4
=rA1.A2.A3
A4
.exp −Ea1+Ea2+Ea3−Ea4
2RT
La réaction globale suit donc la loi d’Arrhénius puisque sa constante de vitesse s’écrit sous la
forme : k=A.e−Ea
RT avec, par identification avec ce qui précède : Ea=1
2(Ea1+Ea2+Ea3−Ea4)
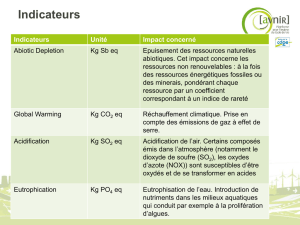
8) Puisque la liaison formée est moins forte que la liaison
rompue et que l’énergie potentielle du système est néga-
tive, l’énergie potentielle des produits est plus élevée que
celle des réactifs — on en déduit qu’on a à faire à un acte
élémentaire « endothermique ».
Cl + SO2Cl2
Cl2 + SO2Cl
∆χ
Ea3
Energie potentielle
Coordonnée
de réaction
Qadri J.-Ph. |PTSI http://atelierprepa.over-blog.com/ 5
1
/
5
100%