– UE VII: – Biochimie III) Biosynthèse

2016-2017 Métabolisme des acides aminés
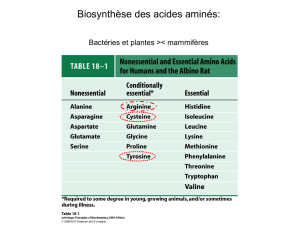
Les acides aminés
– UE VII: – Biochimie
Semaine : n°9 (du 31/10/16 au
04/11/16)
Date : 03/11/2016
Heure : de 8h00 à
9h00 Professeur : Pr. Gervois
Binôme : n° 23 Correcteur : n° 10
Remarques du professeur (Diapos disponibles, Exercices sur le campus, Conseils, parties importantes
à retenir, etc.)
•Préfère poser des questions sur les concepts
PLAN DU COURS
1/8
III) Biosynthèse
A) Incorporation de l'azote atmosphérique
B) Biosynthèse du squelette carboné
3) Six voies de synthèse distinctes
- Synthèse Proline
- Synthèse Arginine
- Synthèse Sérine
- Synthèse Glycine
- Synthèse Cystéine
- Synthèse Aspartate et Asparagine
- Synthèse Alanine
- Synthèse PHE et TYR
IV) Catabolisme
A) Elimination de l'azote
1) Conversion du groupement alpha-amine
2) Devenir du glutamate
3) Devenir de l'ammoniaque formé
a. Dans les tissus

2016-2017 Métabolisme des acides aminés
III) Biosynthèse
B) Biosynthèse du squelette carboné
3) Six voies de synthèses distinctes
➢Biosynthèse de la proline :
Le glutamate permet de transporter l'ammoniac et sert de précurseur à la synthèse d'autre AA.
Il a un rôle métabolique très important.
–On a une phosphorylation du glutamate qui permet de former le γ-glutamyl-phosphate gràce à la
Glutamate Kinase. Ici c'est le glutamate qui est greffé sur le phosphate d'où le « glutamyl »
Remarque : une kinase greffe un phosphate et une phosphatase permet de desphosphoryler
–On a une réaction d'oxydo-réduction qui donne un glutamate γ-sémialdéhyde sous l'action de la glutamate
déshydrogénase.
–Ensuite une réaction de déshydratation. Elle permet d'obtenir une Δ1pyrroline 5 carboxylate par
cyclisation spontanée.
–Le produit cyclisé permet ensuite d'aboutir à la proline sous l'action d'une réductase.
➢Biosynthèse de l'arginine :
2/8

2016-2017 Métabolisme des acides aminés
–On a une réaction d'acétylation du glutamate sous l'action de la transacétylase pour obtenir du N-Acétyl-
glutamate
–Ensuite on a la phosphorylation mais la différence c'est que ici au préalable on a d'abord une acétylation
puis une phosphorylation pour éviter la cyclisation spontanée.
–On obtient le N Acétylglutamate-γ-semialdéhyde.
–On a une réaction de trans amination par une amino-transférase donc on aboutit à un composé appelé
Ornithine
–Puis on arrive dans le cycle de l'urée qui permet d'éliminer le groupement NH2 des AA. Au cours de cycle
de l'urée on a formation de l'arginine.
C'est donc c'est une voie anabolique (formation d'un AA) et catabolique
Remarque :
•L'orinitine est le 21e AA à connaître mais ce n'est pas un AA constituant des protéines
•Acétylation empêche la cyclisation spontanée de la molécule
➢Biosynthèse de la sérine :
–3-P-Glycérate (produit de la glycolyse) qui est transformé en 3-Phospho Hydroxypyruvate par la
phosphoglycérate déshydrogénase
–Puis on a une trans-amination pour former la 3-Phospho Serine. Le 2e produit de la réaction est l'α-CG
–Puis déphosphorylation pour obtenir la Sérine
–La Sérine est elle même précurseur la Cystéine et la Glycine
➢Biosynthèse de la Glycine :
3/8

2016-2017 Métabolisme des acides aminés
–Réaction de transformation de la sérine en glycine par récupération d'un groupement méthyl. Le
cofacteur THF récupère le carbone.
–La glycine est un AA que l'on retrouve dans la voie de synthèse des nucléotides et elle sert aussi à
synthétiser les protéines.
–Le THF (tétrahydrofolate) est un transporteur d'unités mono-carbonées, il transporte des groupements
méthyl. C'est un dérivé de l'acide folique. Ce transfert de méthyl nécessite un complexe de vitamine B12
et B9. Apporté par l'alimentation.
–C'est la voie de biosynthèse de la glycine mais aussi celle de la dégradation de la sérine.
➢Biosynthèse de la Cystéine : pas à connaître par cœur
–La cellule a des difficultés pour modifier les paramètres physiques (température, pression) nécessaire à
la biosynthèse de la cystéine.
–Les enzymes servent à baisser l'énergie libre d'activation.
–La cystéine est un AA soufré. On remplace l'oxygène -OH de la sérine par un atome de soufre.
–Pour cela, on fair intervenir d'autres AA : la méthionine ainsi que l'homocystéine (= 22ème aa à
connaitre).
–Il y a une transformation de la méthionine qui agit avec un nucléoside pour former l'homocystéine.
–La méthionine réagit avec l'ATP qui relargue ses phosphates. On a un groupement adénosine (sucre +
base) qui est greffé à la méthionine par le soufre : ce qui donne la S-Adénosine-Méthionine
–Grace à la cystathionine synthase on forme un pont soufré entre la sérine et l'homocystéine pour obtenir la
cystathionine.
–Puis on coupe entre le CH2 et le S grâce à cystathionine lyase : on génére de la cystéine et de l'α-
kétobutyrate.
Détails : (pas à connaître)
4/8

2016-2017 Métabolisme des acides aminés
➢Biosynthèse de l'Aspartate et de l'asparagine :
–Réaction de transamination catalysé par ASAT
–On forme de l'aspartate à partir du glutamate et on libère aussi de l'α-cétoglutarate.
–Ensuite, le groupement NH2 provient de la glutamine qui réagit avec l'aspartate pour donner l'asparagine.
C'est donc une réaction de transamidation. On forme l'asparagine et le glutamate.
➢Biosynthèse de l'Alanine
–Réaction de transamination catalysée par ALAT
–Le pyruvate et le glutamate forment l'alanine et un alpha cétoglutarate.
–Le glutamate permet de synthétiser l'aspartate et l'asparagine qui sont des éléments essentiels
–L'alanine est un transporteur inter organe.
•Origine : On la retrouve dans les protéines (catabolisme), elle provient aussi de l'alimentation et à
partir du pyruvate musculaire on peut former de l'alanine (cycle du glucose-alanine dans le muscle)
•Devenir : on la retrouve dans les protéines, dans le transfert du NH2 (transformé un urée) et elle
5/8
 6
6
 7
7
 8
8
1
/
8
100%