Lire l'article complet

8 | La Lettre du Gynécologue • n° 355 - octobre 2010
DOSSIER La conférence Jean Cohen et les JTA 2010 : les temps forts
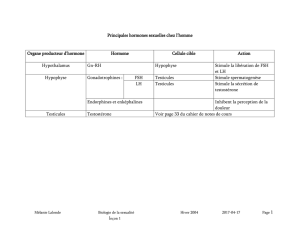
Insuffisance ovarienne
physiologique : diagnostic
et conduite à tenir
Ovarian deficiency: diagnostic and management
F. Olivennes*
L’
insuffisance ovarienne (IO) physiologique est
aujourd’hui mal définie dans la mesure où
elle regroupe des situations physiopatholo-
giques différentes. Il existe des femmes jeunes avec
des paramètres hormonaux perturbés, des femmes
jeunes avec des paramètres hormonaux normaux
mais une réserve folliculaire amoindrie, des femmes
dites "âgées" avec des dosages normaux ou patho-
logiques. À l’évidence, ces situations ont des causes
différentes qui sont aujourd’hui mal élucidées. On
peut imaginer qu’il existe de véritables épuisements
du stock folliculaire ou bien des problèmes de régu-
lation des phases de transition entre les différents
stades de follicules, amenant à un dysfonctionne-
ment du recrutement des follicules stimulables.
Le diagnostic d'IO peut être fortement suspecté sur
un élément clinique très évocateur : l’existence de
cycles courts (< 26 jours). En effet, le raccourcisse-
ment des cycles, premier signe clinique de l’IO, se
fait au dépend de la phase folliculaire. Il existe en
fait une imbrication de la phase lutéale précédente
avec la phase folliculaire. L'élévation de la FSH, qui,
normalement, se fait de manière synchrone avec
l’apparition des règles, est ici avancée. L’atrophie du
corps jaune en l’absence de grossesse et en situa-
tion normale entraîne une chute des estrogènes
qui provoque la sécrétion de FSH et le début de
la croissance folliculaire, puis l'effondrement de la
progestérone induit l’apparition des règles. En cas
d’IO, la FSH est sécrétée prématurément et entraîne
un début de croissance folliculaire en fin de phase
lutéale. Cela explique les observations des examens
complémentaires qui retrouvent souvent au début
du cycle un follicule de grande taille (> 10 mm) et
un taux d’estradiol élevé (> 60 pg/ml).
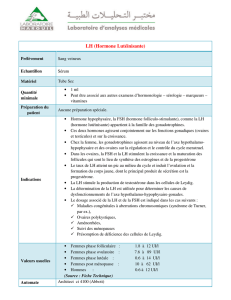
Le diagnostic d’IO peut être confirmé par différents
examens complémentaires. Les dosages hormonaux,
réalisés entre le 2e et le 4e jour du cycle, mesurent
la FSH qui doit toujours être couplée à l’estra-
diol. Il existe des variations dans les seuils jugés
pathologiques en fonction des kits de dosage des
hormones. Schématiquement, on peut considérer
que les valeurs de FSH supérieures à 10-12 UI/l sont
anormales. Concernant l’E2, les valeurs supérieures
à 60-80 pg/ml sont également pathologiques. Le
dosage de l’inhibine B tend a être abandonné car il
est influencé par la taille des follicules. Plus récem-
ment, c’est le dosage de l’hormone anti-mullérienne
(AMH) qui semble donner une très bonne corrélation
avec le comptage folliculaire. L’AMH est sécrétée
par les follicules antraux (FA) et ne varie pas avec le
cycle. Elle peut donc être dosée n’importe quand. Il
existe aujourd’hui deux kits de mesure. La technique
de dosage, qui n’est pas entièrement automatisée,
induit des variations de dosage qui pour l’instant
affaiblissent la valeur pronostique de l’AMH. Pour
ces raisons, il n’y a pas de valeur seuil définie. Cepen-
dant, les valeurs inférieures à 1,5 ng/ml indiquent en
général une réserve folliculaire amoindrie. En dessous
de 1 ng/ml, les grossesses sont rares.
L’échographie est devenue un outil indispensable
de l’évaluation des ovaires. On peut considérer que
même si la mesure du volume ovarien est un bon
élément de l’appréciation de la réserve ovarienne
(RO), le paramètre essentiel de cette évaluation
repose sur le compte des FA. On mesure au début
du cycle (J2-J4) le nombre de follicules entre 2
et 10 mm. On considère la réserve diminuée en
dessous de 10 follicules sur les deux ovaires. À moins
de 5 follicules, la mise en œuvre d’un traitement
quel qu’il soit est contestable. La mesure des FA
pose cependant différents problèmes. La capacité
à repérer des images de quelques millimètres dépend
de la qualité des appareils utilisés et de l'échogra-
* Centre de FIV Eylau, clinique de la
Muette, 46-48, rue Nicolo, 75116
Paris.
I. Quel examen permet le
dépistage de l’insuffisance
ovarienne ?
➊ La mesure de la
progestérone à J20.
➋ La mesure de la FSH à J3.
➌ La mesure de la FSH et de
l’E2 à J3.
➍ La mesure de l’inhibine B
à J3.
II. En cas de stimulation
ovarienne pour fécondation
in vitro chez une patiente en
insuffisance ovarienne, quel
est le protocole susceptible
de donner la meilleure
réponse ovarienne parmi
ceux proposés ?
➊ Le protocole long avec
triptoréline retard injecté à J1.
➋ Le protocole long avec
triptoréline retard injecté
à J20.
➌ Le protocole long avec
triptoréline 0,1 mg
commencé à J1.
➍ Le protocole long avec
triptoréline 0,05 mg
commencé à J20.
Quiz
Réponses : I : 3 ; II : 4.

10 | La Lettre du Gynécologue • n° 355 - octobre 2010
Résumé
phiste. Le compte des FA peut être sous-estimé
par une machine obsolète ou un échographiste
peu entraîné.
A contrario, les machines les plus performantes
peuvent détecter des images anéchogènes et circu-
laires qui peuvent être des vaisseaux ou des artefacts.
La RO sera alors surestimée. Dans une revue récente
de la littérature, il a été montré que les paramètres
les plus à même de prédire la réponse ovarienne
sont la FSH, l’AMH et le compte de FA. Il convient
cependant de rappeler que la mesure de la FSH doit
systématiquement être couplée à celle de l’estradiol
dont l’élévation baisse "artificiellement" la FSH. Il a
aussi été montré que ces tests ont une faible valeur
prédictive sur la grossesse, en particulier chez les
femmes jeunes, en dehors bien sûr des valeurs très
anormales.
La prise en charge de l’infertilité des patientes
présentant une IO doit répondre aux mêmes règles
que les infertilités à RO normale même s'il convient
de ne pas perdre de temps, car la situation tend à
se dégrader. Cependant, il n’existe aucune donnée
permettant d’évaluer la vitesse de dégradation de la
RO et aucune étude n’a montré la nécessité de passer
rapidement la patiente en fécondation in vitro (FIV).
De fait, la FIV ne représente en rien un traitement
de l’IO. La stimulation ovarienne n’améliore pas
la qualité ovocytaire, qui est le principal problème
des patientes en IO. De plus, les traitements lourds
des protocoles de stimulation en FIV ont des effets
néfastes, en particulier sur l’endomètre et donc sur
l’implantation embryonnaire.
Il a aussi été décrit un certain nombre de grossesses
spontanées chez des patientes en IO (voire en méno-
pause pour certaines), ce qui indique que la nécessité
de la FIV est loin d’être démontrée. Il semble donc
préférable de respecter les indications de FIV par
l’existence de facteurs d’infertilité associés à l’IO,
ou de proposer la FIV après l’échec des traitements
plus simples (stimulation avec ou sans insémination).
L'âge de la patiente est aussi un élément capital. L’IO
chez les patientes de plus de 38 ans est associée à
des résultats catastrophiques et ne doit pas donner
lieu à un acharnement thérapeutique inutile et dont
l’innocuité n’est pas démontrée.
En l’absence d’indication de FIV, deux options s’op-
posent dans la prise en charge de ces patientes. Il
L’insuffisance ovarienne est constatée de plus en plus fréquemment. Tout d’abord car les femmes font des
enfants de plus en plus tard mais aussi chez des femmes jeunes pour des raisons inconnues. Le diagnostic
se fait par la réalisation de dosages hormonaux au troisième jour du cycle. On recherche une élévation de
la FSH et ou de l’estradiol et une baisse de l’hormone anti-mullérienne. L’échographie est aussi un examen
clef avec l’évaluation du nombre de follicules antraux. Si des anomalies de ces paramètres sont constatés, la
prise en charge de la stimulation ovarienne fait appel à des protocoles de stimulation ovarienne spécifiques.
Mots-clés
Insuffisance ovarienne
Dosages hormonaux
Échographies
Follicules antraux
Protocoles de
stimulation
Keywords
Ovarian deficiency
Hormonal assesments
Ultrasounds
Antral follicles
Stimulation protocols
n’existe pas d’étude permettant de départager ces
deux attitudes. Pour les uns, il faut "taper fort" en
proposant des protocoles de stimulations ovariennes
à doses fortes : association d'une dose de départ
entre 150 et 300 UI par jour dès le 2e jour du cycle
avec éventuellement des antagonistes du GnRH
pour éviter les ovulations intempestives fréquentes
chez ces patientes. Il est aussi possible d’utiliser le
protocole court associant les agonistes du GnRH
du 2
e
au 9
e
jour et des gonadotrophines (150 à
300 UI par jour) commencées au 4e jour du cycle.
Pour d’autres, une approche plus physiologique est
préférable. On peut tenter de corriger l’imbrication
des phases lutéale et folliculaire et stimuler à faible
dose (75 à 100 UI/l). La prévention de la montée
prématurée de FSH en fin de phase lutéale peut être
obtenue en donnant des estrogènes (valérate d’es-
tradiol, 4 mg par jour à partir du 20
e
ou du 22
e
jour
du cycle et jusqu’au premier jour des règles) ; puis
des agonistes du GnRH (par exemple triptoréline,
0,1 ou 0,05 mg par jour) dès le 20 ou le 22e jour
du cycle jusqu’au premier jour des règles ou une
injection unique d’antagoniste du GnRH (cétrorélix,
3 mg) un peu plus tardivement (J22 ou J24). Cette
préparation est suivie de la stimulation ovarienne.
Dans le cadre de la FIV, il n’existe aucun consensus
sur le choix du protocole de stimulation ovarienne.
Trois sont principalement proposés, dont le proto-
cole long avec GnRH-a en doses quotidiennes
commencées en phase lutéale (J20) et administrées
en demi-doses (0,05 mg/j) jusqu’au déclenchement
de l’ovulation. Il n’y a pas d’intérêt à stopper les
agonistes en début de stimulation, cela n’amélio-
rerait pas les résultats et exposerait la patiente à
des ovulations prématurées. On peut également
utiliser le protocole court associant les agonistes du
GnRH du 2
e
au 9
e
jour et des gonadotrophines (225
à 375 UI par jour) commencées au 4e jour du cycle.
Enfin, les protocoles antagonistes ont aussi montré
leur intérêt par l’absence de blocage préalable.
Dans le cas des protocoles GnRH-a court ou anta-
gonistes, les problèmes de croissance folliculaire
accélérée (cf. supra) peuvent aboutir à des cohortes
folliculaires désynchronisées donnant des résultats
peu encourageants. Le protocole de FIV peut alors
être précédé des traitements évoqués plus haut
(estrogènes ou antagonistes à J20). Aucun de ces
Références
bibliographiques
1. Akman MA, Erden HF, Tosun SB,
Bayazit N, Aksoy E, Bahceci M. Addi-
tion of GnRH antagonist in cycles
of poor responders undergoing IVF.
Hum Reprod 2000;15:2145-7.
2. al-Mizyen E, Sabatini L, Lower AM,
Wilson CM, al-Shawaf T, Grudzinskas
JG. Does pretreatment with proges-
togen or oral contraceptive pills in
low responders followed by the
GnRHa flare protocol improve the
outcome of IVF-ET? J Assist Reprod
Genet 2000;17(3):140-6.
3. Balasch J, Fabregues F, Penarrubia
J et al. Pretreatment with trans-
dermal testosterone may improve
ovarian response to gonadotrophins
in poor responder IVF patients with
normal basal concentrations of FSH.
Hum Reprod 2006; (epub ahead of
print).
4. Balasch J, Fabregues F, Penarrubia
J et al. Pretreatment with trans-
dermal testosterone may improve
ovarian response to gonadotrophins
in poor responder IVF patients with
normal basal concentrations of FSH.
Hum Reprod 2006; (epub ahead of
print).
5. Barri PN, Coroleu B, Martinez F,
Veiga A. Stimulation protocols for
poor responders and aged women.
Mol Cell Endocrinol 2000;166(1):15-
20.
6. Barri PN, Martinez F, Coroleu B,
Tur R. The role of GnRH antagonists
in assisted reproduction. Reprod
Biomed Online 2002;5,Suppl
1(3):14-9.
7. Bassil S, Godin PA, Donnez J.
Outcome of in-vitro fertiliza-
tion through natural cycles in
poor responders. Hum Reprod
1999;14:1262-5.
8. Benadiva CA, Davis O, Kligman I,
Liu HC, Rosenwaks Z. Clomiphene
citrate and hMG: an alternative
stimulation protocol for selected
failed in vitro fertilization patients.
J Assist Reprod Genet 1995;12:8-12.

La Lettre du Gynécologue • n° 355 octobre 2010 | 11
DOSSIER
trois protocoles n’a fait la preuve indiscutable de
sa supériorité. Par ailleurs, l’utilisation de doses très
fortes (> 375 UI par jour) augmente le nombre d’ovo-
cytes et d’embryons mais n’a jamais montré son
efficacité sur les taux de grossesses dans plusieurs
études randomisées.
Concernant les traitements adjuvants, il n’existe à ce
jour aucun traitement étiologique de l’IO. Des essais
ont été effectués avec plusieurs molécules pour tenter
d’améliorer la RO. La testostérone, la DHEA, les corti-
coïdes, la pilule, la mélatonine, les inhibiteurs de l’aro-
matase et la GH ont été proposés. La DHEA a donné
des résultats intéressants mais il n’existe aucune large
étude randomisée permettant de recommander son
usage. Dans deux méta-analyses récentes, les auteurs
concluent à une efficacité démontrée de la GH mais
Références bibliographiques
le nombre total de patientes traitées reste faible.
Au total, et quelle que soit l’attitude thérapeutique
choisie, les patientes atteintes d’IO ont des résultats
faibles en dehors des patientes jeunes (< 35 ans) chez
qui les résultats cumulés peuvent être satisfaisants.
A contrario, il faut s’abstenir de traiter les patientes
de plus de 38-40 ans avec des dosages très altérés
(FSH > 12 IU/l ; AMH < 1 ng/ml) et/ou un compte
folliculaire très bas (< 5 FA). Chez ces patientes, on
peut être amené à proposer une prise en charge simple
et limitée dans le temps. Chez les patientes de plus 38
ans ayant moins de 5 ovocytes, les résultats de la FIV
sont catastrophiques. Primum non nocere, évitons d’ex-
poser ces patientes à de multiples traitements voués à
l’échec et associés à un retentissement psychologique
non négligeable. ■
9. Biljan MM, Mahutte NG, Dean N, Hemmings R, Bissonnette
F, Tan SL. Effects of pretreatment with an oral contracep-
tive on the time required to achieve pituitary suppression
with gonadotropin-releasing hormone analogues and on
subsequent implantation and pregnancy rates. Fertil Steril
1998;70(6):1063-9.
10. Cheung LP, Lam PM, Lok IH et al. GnRH antagonist versus
long GnRH agonist protocol in poor responders undergoing
IVF: a randomized controlled trial. Hum Reprod 2005;20:616-
21.
11. Copperman AB. Antagonists in poor responder patients.
Fertil Steril 2003;80,Suppl.1:S16-24.
12. Craft I, Gorgy A, Hill J, Menon D, Podsiadly B. Will GnRH
antagonists provide new hope for patients considered "diffi-
cult responders" to GnRH agonist protocols? Hum Reprod
1999;14:2959-62.
13. De Placido G, Alviggi C, Mollo A, Strina I, Varricchio MT,
Molis M. Recombinant follicle stimulating hormone is effec-
tive in poor responders to highly purified follicle stimulating
hormone. Hum Reprod 2000;15(1):17-20.
14. Dirnfeld M, Fruchter O, Yshai D, Lissak A, Ahdut A, Abra-
movici H. Cessation of gonadotropin-releasing hormone
analogue (GnRH-a) upon down-regulation versus conven-
tional long GnRH-a protocol in poor responders undergoing
in vitro fertilization. Fertil Steril 1999;72:406-11.
15. Dor J, Feldman B, Seidman DS et al. In vitro fertilization
following natural cycles in poor responders. Gynecol Endo-
crinol 2001;15(5):328-34.
16. Faber BM, Mayer J, Cox B et al. Cessation of gonadotropin-
releasing hormone agonist therapy combined with high-dose
gonadotropin stimulation yields favorable pregnancy results
in low responders. Fertil Steril 1998;69:826-30.
17. Fasouliotis SJ, Laufer N, Sabbagh-Ehrlich S, Lewin A,
Hurwitz A, Simon A. Gonadotropin-releasing hormone
(GnRH)-antagonist versus GnRH-agonist in ovarian stimu-
lation of poor responders undergoing IVF. J Assist Reprod
Genet 2003;20:455-60.
18. Feldberg D, Farhi J, Ashkenazi J, Dicker D, Shalev J, Ben-
Rafael Z. Minidose gonadotropin-releasing hormone agonist is
the treatment of choice in poor responders with high follicle-
stimulating hormone levels. Fertil Steril 1994;62:343-6.
19. Feldman B, Seidman DS, Levron J et al. In vitro fertiliza-
tion following natural cycles in poor responders. Gynecol
Endocrinol 2001;15:328-34.
20. Garcia-Velasco JA, Isaza V, Requena A et al. High doses
of gonadotrophins combined with stop versus non-stop
protocol of GnRH analogue administration in low responder
IVF patients: a prospective, randomized, controlled trial. Hum
Reprod 2000;15:2292-6.
21. Hanoch J, Lavy Y, Holzer H et al. Young low responders
protected from untoward effects of reduced ovarian response.
Fertil Steril 1998;69:1001-4.
22. Klinkert ER, Broekmans FJ, Looman CW, Habbema JD,
Velde ER. Expected poor responders on the basis of an antral
follicle count do not benefit from a higher starting dose of
gonadotrophins in IVF treatment: a randomized controlled
trial. Hum Reprod 2005;20(3):611-5.
23. Kolibianakis E, Zikopoulos K, Camus M, Tournaye H, Van
Steirteghem A, Devroey P. Modified natural cycle for IVF does
not offer a realistic chance of parenthood in poor responders
with high day 3 FSH levels, as a last resort prior to oocyte
donation. Hum Reprod 2004;19:2545-9.
24. Kovacs P, Barg PE, Witt BR. Hypothalamic-pituitary
suppression with oral contraceptive pills does not improve
outcome in poor responder patients undergoing in vitro
fertilization-embryo transfer cycles. J Assist Reprod Genet
2001;18:391-4.
25. Land JA, Yarmolinskaya MI, Dumoulin JC, Evers JL. High-
dose human menopausal gonadotropin stimulation in poor
responders does not improve in vitro fertilization outcome.
Fertil Steril 1996;65:961-5.
26. Lashen H, Ledger W. Management of poor responders in
IVF. Hum Reprod 1999;14:1919.
27. Lindheim SR, Barad DH, Witt B, Ditkoff E, Sauer MV.
Short-term gonadotropin suppression with oral contracep-
tives benefits poor responders prior to controlled ovarian
hyperstimulation. J Assist Reprod Genet 1996;13:745-7.
28. Massin N, Cedrin-Durnerin I, Coussieu C, Galey-Fontaine
J, Wolf JP, Hugues JN. Effects of transdermal testosterone
application on the ovarian response to FSH in poor responders
undergoing assisted reproduction technique: a prospective,
randomized, double-blind study. Hum Reprod 2006;21:1204-11.
29. Mitwally MF, Casper RF. Aromatase inhibition improves
ovarian response to follicle-stimulating hormone in poor
responders. Fertil Steril 2002;77(4):776-80.
30. Mohamed KA, Davies WA, Allsopp J, Lashen H. Agonist
"flare-up" versus antagonist in the management of poor
responders undergoing in vitro fertilization treatment. Fertil
Steril 2005;83:331-5.
31. Mohamed KA, Davies WA, Allsopp J, Lashen H. Agonist
"flare-up" versus antagonist in the management of poor
responders undergoing in vitro fertilization treatment. Fertil
Steril 2005;83:331-5.
32. Morgia F, Sbracia M, Schimberni M et al. A controlled trial
of natural cycle versus microdose gonadotropin-releasing
hormone analog flare cycles in poor responders undergoing
in vitro fertilization. Fertil Steril 2004;81:1542-7.
33. Olivennes F, Righini C, Fanchin R et al. A protocol using
a low dose of gonadotrophin-releasing hormone agonist
might be the best protocol for patients with high follicle-
stimulating hormone concentrations on day 3. Hum Reprod
1996;11:1169-72.
34. Out HJ, Braat DD, Lintsen BM et al. Increasing the daily
dose of recombinant follicle stimulating hormone (Puregon)
does not compensate for the age-related decline in retrievable
oocytes after ovarian stimulation. Hum Reprod 2000;15:29-
35.
35. Padilla SL, Dugan K, Maruschak V, Shalika S, Smith RD.
Use of the flare-up protocol with high dose human follicle
stimulating hormone and human menopausal gonadotro-
pins for in vitro fertilization in poor responders. Fertil Steril
1996;65:796-9.
36. Pellicer A, Ardiles G, Neuspiller F, Remohi J, Simon C,
Bonilla-Musoles F. Evaluation of the ovarian reserve in young
low responders with normal basal levels of follicle-stimulating
hormone using three-dimensional ultrasonography. Fertil
Steril 1998;70:671-5.
37. Pellicer A, Lightman A, Diamond MP, Russell JB,
DeCherney AH. Outcome of in vitro fertilization in women
with low response to ovarian stimulation. Fertil Steril
1987;47(5):812-5.
38. Raga F, Bonilla-Musoles F, Casan EM, Bonilla F. Recombi-
nant follicle stimulating hormone stimulation in poor respon-
ders with normal basal concentrations of follicle stimulating
hormone and estradiol: improved reproductive outcome.
Hum Reprod 1999;14(6):1431-4.
39. Schmidt DW, Bremner T, Orris JJ, Maier DB, Benadiva
CA, Nulsen JC. A randomized prospective study of microdose
leuprolide versus ganirelix in in vitro fertilization cycles for
poor responders. Fertil Steril 2005;83:1568-71.
40. Serafini P, Stone B, Kerin J, Batzofin J, Quinn P, Marrs RP.
An alternate approach to controlled ovarian hyperstimulation
in "poor responders": pretreatment with a gonadotropin-
releasing hormone analog. Fertil Steril 1988;49:90-5.
41. Kyrou D, Kolibianakis EM, Venetis CA, Papanikolaou
EG, Bontis J, Tarlatzis BC. How to improve the probability
of pregnancy in poor responders undergoing in vitro ferti-
lization: a systematic review and meta-analysis. Fertil Steril
2009;91(3):749-66.
1
/
3
100%