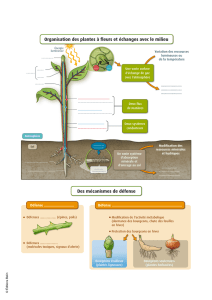
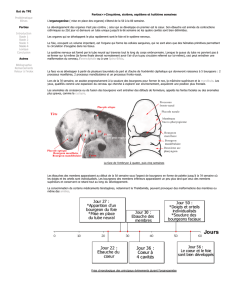
JOHANNE TüRCOTiE ALLOCATION DES RESSOURCES CHEZ LE
publicité

JOHANNE TüRCOTiE ALLOCATION DES RESSOURCES CHEZ LE SAULE PLANIFOLIÉ (SALIX PLANIFOLIA PURSH) AU QUÉBEC SUBARCTIQUE Mémoire présenté à la Faculté des études supérieures de l'université Laval pour l'obtention du grade de maître ès sciences (M.%.) Département de biologie FACULTÉDES SCIENCES ET DE GENIE UNIVERSITÉ LAVAL Décembre 1997 O Johanne Turcotte, 1997 1+1 National Library .,anaci, Bibliothbque nationale du Canada Acquisitions and Bibliographie Services Acquisitions et services bibliographiques 395 Wellington Street Ottawa ON K IA ON4 Canada 395. rue Wellington Ottawa ON K1A ON4 CaMda The author has granted a nonexclusive licence allowing the National Library of Canada to reproduce, loan, distribute or sell copies of this thesis in microform, paper or electronic formats. L'auteur a accordé une licence non exclusive permettant a la Bibliothèque nationale du Canada de reproduire, prêter, distribuer ou vendre des copies de cette thèse sous Ia fonne de rnicrofiche/fïh, de reproduction sur papier ou sur format électronique. The author retains ownership of the copyright in this thesis. Neither the thesis nor substantial extracts from it may be printed or otherwise reproduced without the author's permission. L'auteur conserve la propriété du droit d'auteur qui protège cette thèse. Ni la thèse ni des extraits substantiels de celle-ci ne doivent être imprimés ou autrement reproduits sans son autorisation. Chez les plantes dioïques, les individus femelles allouent généralement plus de ressources à la reproduction que les individus mâles, à cause de la production des fruits. Cet investissement supérieur affecterait davantage leur croissance, leur survie et leur défense contre les ennemis. Nous avons vérifié l'existence d'un coût différentiel de reproduction entre les sexes pour le saule planifolié en milieu subarctique. Nos résultats démontrent que l'effort reproducteur des individus femelles est effectivement supérieur à celui des individus mâles parce qu'elles produisent des fruits. Les conflits d'allocation se manifestent non pas entre la reproduction et la croissance courantes, mais entre la reproduction courante et la reproduction future. Cependant, ces conflits ne s'expriment pas de façon plus marquée chez les individus femelles. Plusieurs facteurs peuvent expliquer l'atténuation des conflits d'allocation de ressources chez les individus femelles, dont un taux de photosynthèse plus élevé et une plus grande efficacité d'utilisation des ressources. REMERCIEMENTS La réalisation d'un projet de recherche ne peut se faire sans l'aide et le soutien de gens et d'organismes. En premier lieu, je tiens à remercier mon directeur de recherche, Gilles Houle, pour sa supervision, son dévouement et sa grande disponibilité. Je remercie aussi les mémoire Line Lapointe, à Stéphane Boudreau, Plamondon pour leur dévouement constant. Jacqueline Bouchard, nordiques (cÉN). membres de mon comité et de mon jury de Pierre Morisset et Alison Munson. Un gros merci Jean-Michel Gagné, Manuel Lafortune et Julie assistance technique et, en particuiier, leur Je tiens aussi I souligner la disponibilité de administratrice-adjointe au Centre d'études Je m'en voudrais de ne pas mentionner aussi le support logistique du CEN ainsi que le soutien financier du Ministère des affaires indiennes et du nord canadien. TABLE DES MATIERES 1 .5 Objectifs~~...~~~~~~~~.---....-..-.--...---....-.-.------.--.......... 8 .. 1.6 Espèce étudiee....................................----.----.--.-.-..--.---.-................... 9 I . Chapitre II Materiel et méthodes---........---.-----.-.------.-..----.--...-.............. II 2.5 Échantillonnage de rameaux............. ........................................................... 1 2.6 Échantillonnage de structures reproductrices sur d'autres . . . i n d ~ v i d u.............................................................................................................. s 1; . . 2.7 Analyses statistiques.................................................................................... 1; Chapitre II1 Résultats..................................................................................................... 1: ' 3.1 Mesures pré-expérimentales....................................................................... 1 3.1.1 Masse et composition chimique des structures reproductrices......................................................................................1' 3.1.2 Nombre initial de bourgeons floraux.......................................... 2; 3.1.3 Quantité de carbone, d'azote et de phosphore par rameth--2 . 3.2 Mesures exper~mentales ................................................................................ 2 f 3.2.1 Nombre de feuilles, et surface et masse foliaires.............. 2 f 3.2.2 Transpiration et résistance stomatique des feuilles... ......3( 3.2.3 Nombre de bourgeons végétatifs, et nombre et masse des bourgeons reproducteurs.................................................................. 3 l 3.2.4 Masse des rameaux............................................................................. 4 1 3.2.5 Composition chimique des structures végétatives et reproductrices......................................................................................4~ . Effort reproducteur différentiel en fonction du sexe......................5; Transpiration et résistance stomatique des feuilles......................5L Croissance raméale......................................................................................... 5 C Production de feuilles.................................................................................... 6 ( 4.5 Production de bourgeons reproducteurs................................................. 61 4.6 Conclusion...........................................................................................................6f 4.1 4.2 4.3 4.4 LISTE DES FIGURES Figure 2. Effort reproducteur total par rarnet en termes d e quantité de carbone, d'azote et de phosphore, en fonction du sexe 26 LISTE DES TABLEAUX Tableau 2. Analyse de variance (factorielle à deux facteurs) pour la masse individuelle d'un bourgeon reproducteur et d'une inflorescence 21 *------.---*~.-~~.*-~-.---.-----.-----------..--*-~---.----.-------Tableau 3. Analyse de variance (factorielle à un facteur) pour la ..---**-* Tableau 4. Nombre initial de bourgeons floraux par ramet pour chaque traitement, en fonction du sexe des individus.---......-------..-..--24 Tableau 7 a, b et c. Analyse de variance (factorielle à quatre facteurs) pou le nombre a), la surface b) et la masse c) de feuilles par ramet ____. f.CII.---_.l.-.....----.--..--..-.-..-.......----.......-..-...-.-.-.--...-...-...-.--.---.....-.--.---.. 31-33 Tableau 8. Valeurs de transpiration et de résistance stomatique des feuilles en fonction des traitements et du sexe des individus, différentes périodes de la saison.*-----*-.-------.------.............34 4 Tableau 9 a et b. Analyse de variance à mesures répétées (factorielle à cinq facteurs) sur la transpiration a) et la résistance stomatique b) des feuilles à huit reprises durant la saison de croissance------.-.------------------- ----- ---..--.-..-..*-.---.---------------36-37 * * * * - * ---.---*-- Tableau 10. Nombre de bourgeons végétatifs, nombre et masse des bougeons reproducteurs par ramet pour chaque traitement, en fonction du sexe des individus à la fin de la période . expe rimentale................................................................... 39 . Tableau 11. Analyse de variance (factorielle à quatre facteurs) pour le nombre de bourgeons végétatifs, et le nombre et la masse des 40 bourgeons reproducteurs par ramet..----..-..---..-.---.-..----.--*.--- Tableau 12. Masse des rameaux persistants et des rameaux caduques, et masse totale des rameaux par ramet pour chaque traitement, en fonction du sexe des individus à la fin de la période .. experlmentale.-..--..---.-.---.........-.-.-..+.--.--7-..-.-.--.....-..------------.-----...--42 Tableau 13. Analyse de variance (factorielle à quatre facteurs) pour la masse des rameaux persistants et des rameaux caduques, et 43 la masse totale des rameaux par ramet........................................... Tableau 14. Composition chimique de différentes structures végétatives ou reproductrices en fonction des traitements et du sexe des . .. individus...................................................................................................... 46 Tableau 15 a, b, c et d. Analyse de variance (factorielle à quatre facteurs) pour la cornpositon chimique des feuilles a), des rameaux persistants b), des rameaux caduques c) et des 48-51 bourgeons reproducteurs d).....--..--.....-.---.-.-.....-.-..-.-.-...--..*..-- CHAPITRE I INTRODUCTION 1.1 Allocation des ressources, conflits et compromis Le principe d'allocation des ressources, élaboré à partir de modèles animaux, propose que, parce que les ressources disponibles aux organismes sont ultimement limitées, I'investissement dans une fonction limite l'investissement ailleurs (Gadgil et Bossert IWO). Ainsi, on suppose que ce qui est alloué à la reproduction limite l'allocation à la croissance courante, à la défense contre les ennemis ou encore à la reproduction future (Williams 1966; Gadgil et Bossert 1970; Bell 1980; Emlen 1984; Stearns 1989). Bref, on présume qu'il peut y avoir un conflit entre la reproduction et les autres fonctions, et que ce conflit peut engendrer des comptomis au niveau de l'allocation aux différentes fonctions d'un organisme i.e. un coût de la reproduction courante en termes de survie ou de reproduction future réduites. Chez les végétaux, i.e. des organismes autotrophes et à croissance indéterminée, les ressources proviennent à la fois de l'assimilation foliaire (photosynthèse) et racinaire (absorption des nutriments). Certaines études ont mis en évidence un coût de reproduction chez des plantes pbrennes, se manifestant par une réduction de la croissance courante (e.g. Fragaria chiloensis, Hancock et Bringhurst 1980; Rh us typhina, Luken 1987) ou de la reproduction future (e.g. Salix alaxensis, Fox et Stevens 1991) ou des deux fonctions (e.g. Cypripedium acaule, Primack et Hall 1990; Salix rigida, Elmqvist et al. 1991). Cependant, les conflits peuvent ne pas se manifester lorsque les ressources sont abondantes (Leonard 1962; Sachs 1977; Horvitz et Schemske 1988). Selon Wardlaw (1990), en général la formation des fruits et des graines constitue un puits prioritaire par rapport à celle des structures végétatives; par contre, les fleurs semblent peu compétitives face à d'autres puits dans des conditions limitant la productivité des sources. La démonstration d'un coût de reproduction chez les plantes peut être dépendante de la méthode employée pour mesurer les compromis (Reznick 1985, 1992) et associée à la difficulté d'estimer l'effort reproducteur chez les plantes (Thompson et Stewart 1981; Bazzaz et Reekie 1985; Reekie et Bazzaz l987a). Par exemple, I'investissement au niveau de la reproduction est souvent estimé de façon statique, Le. e n déterminant la biomasse totale ou la quantité de nutriments des structures reproductrices (Hickman et Pitelka 1975; Lovett Doust 1989; Abrahamson et Caswell 1982; Ashman 1994; aussi discuté dans Goldman et Willson 1986). Selon Ashman (1994), ces estimations statiques ne reflètent pas le coût réel puisqu'elles ne tiennent pas compte des processus dynamiques reliés à la reproduction. Par exemple, le coût réel est sous-estimé lorsqu'on ne considère pas le coût respiratoire associé au maintien des structures reproductrices. Par ailleurs, le coût peut aussi être surestime et ce, si on ne tient pas compte de deux autres processus dynamiques, soient l'activité photosynthétique des structures reproductrices, et la réabsorption des nutriments et la retranslocation des sucres (voir sections 1.3.2 et 1.3.3). Si la biomasse est une devise souvent considérée pour estimer l'allocation des ressources, c'est qu'elle est facile à déterminer et qu'elle peut être convertie en allocation calorifique ou nutritive si on connaît la valeur calorifique des tissus ou leur concentration respective en nutriments (Hickman et Pitelka 1975; Abrahamson et Caswell 1982). Le carbone est important comme devise puisqu'il constitue une mesure indirecte du gain et de la dépense d'énergie (Chapin 1989). Le patron d'allocation tel que dbterminé pour une devise comme l'azote peut être différent de celui obtenu pour des devises comme l'énergie ou la biomasse (Abrahamson et Caswell 1982). C'est donc dire que le choix d'une devise peut être déterminant pour la démonstration de l'existence ou non d'un coût de reproduction selon que la devise retenue représente la ressource la plus limitante. Dans un milieu où l'azote est la ressource la plus limitante, Chapin (1989) mentionne que son utilisation comme devise permet une bonne approximation du coût réel. 1.2 Dioecie Le concept d'effort reproducteur, basé sur les ressources allouées à la reproduction, a été d'abord présenté par Ogden (1968)' élaboré par Harper et Ogden (1970), et par la suite utilisé par plusieurs auteurs. Selon Putwain et Harper (1 972) et Bawa (1980), une utilisation différentielle des ressources en fonction du sexe chez les plantes dioi'ques peut impliquer un coût reproducteur différentiel entre les sexes. Chez certaines espèces dioïques, des auteurs ont rapporté entre les sexes des différences au niveau morphologique, physiologique et écologique. Ainsi, chez Chamaelirium luteum, Meagher et Antonovics (1982) ont démontré que, par rapport aux mâles, les femelles sont de plus grande dimension, produisent des inflorescences plus volumineuses et ont une mortalité plus élevée. De leur côté, Dawson et Bliss (1989) concluent que les individus de Salix arctica ont un rapport des sexes biaisé en faveur des femelles, que comparativement aux mâles, les femelles occupent de meilleurs sites (plus humides, plus riches en nutriments), en plus d'avoir une conductance stomatique des feuilles plus élevée. On reconnaît généralement que les femelles investissent proportionnellement plus dans la reproduction que ne le font les mâles, puisqu'elles allouent des ressources pour produire à la fois des fleurs et des fruits, l'effort reproducteur des mâles étant limité à la production de fleurs (Putwain et Harper 1972; Lloyd 1973; Bawa et Opler 1975; Freeman et al. 1976; Wallace et Rundel 1979; voir aussi les références dans Lloyd et Webb 1977). C'est donc au niveau de l'effort reproducteur total que les femelles investissent davantage puisqu'au niveau de la floraison, ce sont souvent les mâles qui investissent le plus, e.g.: Fragaria chiloensis, Hancock et Bringhurst 1980; Aralia nudicaulis, Barrett et Helenurm 1981; Silene alba, Gross et Soule 1981; Oemleria ce rasiformis, Allen et Antos 1988; Chamaedora tepejilote, Oyama et Dirzo 1988; Xanthoxylum americanum, Popp et Reinartz 1988; Z a m ia p u m i l a , Tang 1990; llex opaca, Carr 1991; Rumex acetosa et R . acetosella, Korpelainen 1992; Lindera benzoin, Niesenbaum 1992. Par contre, des études ont démontré que le coût reproducteur supplémentaire de la part des femelles ne s'exprime qu'au-delà d'un certain seuil de reproduction. Ceci s'applique pour Simmondsia chinensis (Wallace et Rundel 1979), Silene alba (Gross et Soule 1981) et Rubus chamaemorus (Agren 1988). Un effort reproducteur plus important de la part des femelles pourrait contribuer à diminuer leur croissance ou leur survie comparativement aux mâles (Freeman et al. 1976; Lloyd et Webb 1977) dans la mesure où les ressources sont limitées et qu'il y a ainsi compétition entre les différentes fonctions (Cody 1966; Gadgil et Bossert 1970; Reekie et Bazzaz 1987~).Ceci a été mis en évidence pour plusieurs espèces dioïques mentionnées précédemment et d'autres espèces dont: Lindera benzoin, Cipollini et Whigham 1994; Rumex acetosella, Houssard et a1.1994. Cependant, aucun coût différentiel de reproduction n'a été mis en &idence chez les femelles de Populus tremuhïdes, Mitton et Grant 1980 et Sakai et Burris 1985; Rumex hastatulus, Conn 1981; Acer negundo, Willson 1986; Rumex acetosella, Lovett Doust et Lovett Doust 1987; Populus grandidentata, Sakai et Sharik 1988; Zamia pumila, Tang 1990; Buchloe dactyloides, Quinn 1991. Dans certains cas, les femelles peuvent même avoir une plus grande croissance (e.g. P o p u l u s tremuloïdes, Grant et Mitton 1979 et Sakai et Burris 1985; Salix spp., Crawford et Balfour 1990). Pour plusieurs espèces de plantes, on considère que les ressources allouées à la reproduction peuvent avoir un impact non seulement sur la croissance mais aussi sur la défense (e.g. Bazzaz et al. 1987; Briggs et Schultz 1990). En effet, selon Elmqvist et al. (1991) lorsque pour une saison donnée les ressources allouées a la reproduction augmentent, la production de métabolites secondaires peut être réduite la saison suivante, ce qui par conséquent peut contribuer à augmenter la susceptibilité à la prédation. Chez les espèces dioiques, dans la mesure où l'effort reproducteur des femelles est supérieur à celui des mâles, l'ampleur de I'herbivorie, devrait être plus importante chez les femelles. Par contre, selon plusieurs études, les mâles sont souvent plus vulnérables que les femelles (e.g. Danell e t al. 1985; Elmqvist et al. 1988; Alliende 1989; Boecklen et al. 1990). 1.3 Atténuation des conflits 1. X I Capacité photosynthétique accrue L'hypothèse selon laquelle I'activité photosynthétique des feuilles (source) pourrait être ajustée a la demande en hydrates de carbone de certaines structures (puits) a été débattue depuis longtemps (Boussingault 1868; Neales and lncoll 1968; Farrar 1993). Ainsi, la plante pourrait compenser pour les hydrates de carbone alloués à la reproduction en augmentant l'activité photosynthétique des feuilles avoisinant les structures reproductrices ou des feuilles de toute la couronne (Neales et lncoll 1968; Wardlaw 1968; Geiger 1979; Gifford et Evans 1981). Ceci laisse supposer que la plante ne dispose pas nécessairement d'un budget fixe en termes de production d'hydrates de carbone. Ainsi, pour les femelles de Salix arctica, Dawson et Bliss (1989) ont démontré qu'elles pouvaient augmenter leur activité photosynthétique en fonction de puits supplémentaires. Les individus matures peuvent ainsi avoir une activité photosynthétique plus élevée que celle des juvéniles, en raison de leurs puits plus importants (Dawson et Bliss 1993; mais voir Primack et al. 1994; Schecter et al. 1994). Chez d'autres espèces, les femelles peuvent, contrairement aux mâles, retarder leur période de reproduction jusqu'à ce qu'elles aient produit plus de tissus photosynthétiques (e.g. Rumex acetosa et R . ace tosella, Putwain et Harper 1972; Simmondsia chinensis, Wallace et Rundel 1979; Hebe subalpina (subdioïque), Delph 1990). 1.3.2 Activité photosynthétique de la part des structures reproductrices Si les structures reproductrices sont photosynthétiques, le coût de carbone associé à la reproduction peut être au moins partiellement absorbé (Bauaz et Carlson 1979; Bazzaz et al. 1979; Reekie et Bazzaz 1987a et b). Alors, les conflits entre les fonctions de reproduction et de croissance peuvent être davantage reliés à la disponibilité des nutriments qu'à celle des hydrates de carbone (Abrahamson et Caswell 1982; Chapin 1989; mais voir Reekie et Bazzaz 1987a et b). Plusieurs fleurs et fruits sont verts et une partie de l'énergie et du carbone peut provenir de I'activité photosynthétique de ces structures. Cet ajustement pourrait s'appliquer davantage chez les femelles (ou les structures reproductrices femelles dans le cas de plantes monoïques) en présumant que leur effort reproducteur est supérieur à celui des mâles (Bauaz et Carlson 1979; Bazzaz et ai. 1979; Dawson et Bliss 1993). Chez Ambrosia trifida (monoïque) par exemple, Bazzaz et Carlson (1979) ont démontré que l'activité photosynthétique des structures reproductrices contribuait jusqu'à 41% et 51% de la quantité de carbone requise pour la production des inflorescences mâles et femelles, respectivement. 1.3.3 Réabsorption des nutriments et retranslocation des sucres Lors de la sénescence des feuilles, des nutriments peuvent être réabsorbes par la plante et se diriger vers les feuilles en développement ou vers les tissus reproducteurs (Williams 1955; Woolhouçe 1978; Peoples et Dalling 1988), ou stockés dans des tissus persistants, augmentant ainsi les nutriments disponibles pour la fonction de la croissance future (Bormann et al. 1977; Ryan et Bormann 1982; Waring et Schlesinger 1985; Chapin et al. 1990). Une fois la reproduction terminée, une proportion significative des nutriments investis dans les structures reproductrices peut aussi être réabsorbée et réinvestie à d'autres fonctions, atténuant ainsi les coûts réels de la reproduction (Thompson et Stewart 1981; Goldman et Willson 1986; Chapin 1989). Les ressources (nutriments, hydrates de carbone) peuvent être réabsorbées a partir de structures comme le calice, la corolle, les ovaires et ovules non fécondés, et les structures supportant les anthères. L'allocation des nutriments à de telles structures comprendrait jusqu'a plus de 60% de la depense totale de la reproduction (Ashman 1994), et leur réabsorption diminuerait substantiellement les coûts de la reproduction. Toujours en rapport avec l'effort reproducteur supérieur des femelles, le mécanisme de réabsorption des nutriments devrait être plus important chez les femelles que chez les mâles. Cependant, la littérature n'en fait pas beaucoup mention. 1.4 Ségrégation spatiale entre les sexes Si l'effort reproducteur des individus femelles est supérieur à celui des individus mâles, il peut s'ensuivre à long terme une mortalité plus importante des femelles, particulièrement sur les sites les plus pauvres (Freeman et al. 1980; Charnov 1982). 11 en découlerait alors un rapport des sexes biaisé en faveur des mâles, particulièrement sur les sites les plus limitatifs, comme cela a été mis en évidence pour plusieurs espéces de plantes dioïques (e.g. Lloyd 1973; Lloyd et Webb 1977; Opler et Bawa 1978). Cependant, chez les saules (Salix spp.), on rapporte souvent un rapport des sexes biaisé en faveur des femelles (Crawford et Balfour 1983; Danell et al. 1985; Dawson 1987). Par ailleurs, les femelles qui occupent de meilleurs sites auraient une meilleure survie que celles qui se retrouvent sur les sites les plus pauvres. En effet, l'effort reproducteur additionnel qu'implique les fruits peut être partiellement attdnué par un plus grand apport en eau et en nutriments (Freeman et al. 1976). Donc, une mortalité différentielle des femelles sur les sites les plus pauvres peut entralner, chez les adultes, une ségrégation spatiale apparente entre les sexes. En effet, diverses études ont démontré l'existence d'un tel processus à partir de plantes dioïques se retrouvant le long d'un gradient environnemental (e.g. Dodson 1962 Grant et Mitton 1979; Wade et al. 1981; lovett Doust et Cavers 1982). 1.5 Objectifs Les objectifs de la presente étude sont les suivants: Évaluer I'investissement dans la reproduction chez les mâles et le: femelles d'une espèce dioïque, le saule planifolié (Saiix planifolia Purst spp. planifolia), en utilisant diverses devises. Par expérimentation, déterminer la présence d'un coût à la reproduction en conditions limitatives de nutriments (dunes) et de clima (subarctique) où les conflits devraient être plus évidents. S'il y a un coût à la reproduction, vérifier s'il se manifeste davantagt chez les femelles que chez les mâles puisque celles-ci produisent de: fruits et des graines en plus des fleurs. De plus, démontrer si ce coût s'exprime par l'existence de conflits entrt la reproduction et la croissance courantes ou entre la reproductior courante et la reproduction future. Évaluer l'impact de I'investissement a la reproduction courante sur z I production de feuilles et l'ampleur de I'herbivorie. Vérifier que le saule planifolié dispose d'un budget fixe quant i l'allocation de carbone, à partir de mesures indirectes de l é photosynthèse (transpiration et résistance stomatique des feuilles). Bien que ce projet se soit déroulé dans un laps de temps relativemen court, il constitue une contribution originale en ce sens qu'il fait appel È plusieurs variables pour estimer l'allocation des ressources. Ainsi contrairement à certaines études qui s'étalent sur plus d'une année, dan$ le cadre de ce projet nous avons eu recours, outre les variables reliée: aux mesures statiques (biomasse et nutriments), a d'autres variables ayant trait aux mesures dynamiques (transpiration et résistance stomatique des feuilles). De p!üs, l'ampleur de I'herbivorie a été estimée, facteur important puisqu'il peut avoir un lien avec la production de métabolites secondaires qui, elle, peut aussi impliquer des dépenses significatives pour la plante. 1.6 Espèce étudiée Une angiosperme dio't'que, le saule planifolié (Salix planifolia Pursh ssp planifolia) est un taxon nord-américain qui se retrouve du Labrador à l'Alberta, atteignant au sud la côte Nord et les montagnes de la Gaspésie du Québec, Terre-Neuve et la Nouvelle-Angleterre (Fernald 1950). Dans l'ensemble de son aire de répartition, cet arbuste atteint 1 à 4 m de hauteur. Comme la majorité des espèces de ce genre, Salix planifolia se retrouve principalement dans les milieux humides, le long des cours d'eau et sur les rives des lacs, mais aussi dans les milieux plus secs comme sur les affleurements rocheux (Lavoie et Morisset 1987). Chez S. planifolia, chaque genet comporte généralement plusieurs ramets issus d'un collet commun partageant le même système racinaire. Les bourgeons reproducteurs sont initiés à la fin de l'été et s'ouvrent au printemps suivant. Ceux-ci se distinguent des bourgeons végétatifs principalement par leur dimension; en effet, les bourgeons reproducteurs sont environ trois à cinq fois plus gros que les bourgeons végétatifs. Pour ce qui est des feuilles, de forme elliptique ou lancéolée, leur déploiement s'amorce normalement vers la fin juin et continue pour envi ton trois semaines. La reproduction sexuée est généralement abondante. La floraison a lieu avant le deploiement des feuilles, ce qui correspond, en général, à la mijuin pour les régions nordiques. Les fleurs se présentent sous forme d'épis (chatons) à la base desquels on retrouve quelques bractées foliaires. La pollinisation se fait par les insectes. Du début de la floraison 2i la fin de la pollinisation, il s'écoule trois quatre semaines. Une fois la pollinisation terminée, les inflorescences mâles se déssèchent et tombent, tandis que les inflorescences femelles se développent en infrutescences (un épi de capsules). Quant aux graines, elles sont munies de fins poils soyeux, ce qui facilite leur dissémination. En milieu nordique, les graines se forment généralement vers la fin juillet et la dissémination est terminée après environ deux à trois semaines. Il y a beaucoup de variabilité que ce soit au niveau du nombre de capsules par infrutescence, 30 à 154, ou du nombre de graines par capsule, 1 à 15 (observation personnelle). CHAPITRE II Ce projet s'est déroulé au Québec subarctique, sur la côte est de la bai€ d'Hudson, plus précisément à Whapmagoostui-Kuujjuaraapik (55" 17' N 77" 46' 0) (Figure 1). Cette région est caractérisée par une température moyenne annuelle de -4'3 O C et elle reçoit 650 mm de précipitations annuelles, dont 40% sous forme de neige. De plus, la saison sans gel e s d'environ 80 jours et s'étend de la mi-juin à la mi-septembre (Atmospheric Environment Service 1981 et 1982). 2.1 Site d'étude Le site d'étude est à environ 1 km au nord de Whapmagoostui. Kuujjuaraapik. II consiste en un système dunaire (Dune du Camp Nord: dont la zone de déflation centrale est occupée par différentes espèce3 d'arbustes, principalement le saule planifolie. Ce dernier se réparti' dans toute l'aire de déflation et la population est bien circonscrite pai les flancs de la dune. FIGURE 1, localisation du site d'étude. Parmi les autres especes végétales présentes sur le site. nous retrouvons: deux autres espèces de saules S. glauca L. et S. bebbiana Sarg., le bouleau glanduleux (Betula glandulosa Michx), le genévrier commun (Juniperus communis L.), l'épinette blanche (Picea glauca (Moench) Voss), la camarine noire (Empetrum nigrum L.), ainsi que différentes especes herbacées telles le pois de mer (Lathyrus japonicus W i d ) , I'élyme des sables (Elymus mollis Trin.) et le rhinanthe (Rhinanthus minor L.). 2.2 Choix des individus et application des traitements Au début juin 1995. 24 individus (genets), répartis dans toute I'aire de déflation, ont été sélectionnés (12 mâles et 12 femelles) en fonction des critères suivants: l'authenticité du genet (i.e. que les ramets identifiés appartiennent tous au même genet), le nombre de ramets par genet et le nombre de bourgeons floraux par ramet. II faut préciser qu'en prenant en considération les individus de toute I'aire de déflation et qu'en tenant compte de tous les critères de sélection mentionnés précédemment, les 24 genets retenus semblaient les plus appropriés. Afin d'éviter les perturbations, I'authenticité des genets a initialement été vérifiée en observant l'orientation de la base des ramets. Ainsi, un genet était choisi lorsque la direction de la base de ses ramets convergeait vers un point commun. La façon la plus objective de vérifier qu'un ensemble de ramets ne constitue qu'un seul genet consiste à creuser à la base des ramets afin de trouver le collet commun et à s'assurer que chacun des ramets y es1 relié. Cependant, il en résulte une perturbation notable et nous avons fait cette vérification seulement à la fin de l'expérimentation, alors que toutes les mesures avaient été prises. A ce moment, quatre individus on1 du être retranchés des analyses, à raison de trois mâles et une femelle. L'analyse des résultats porte donc sur neuf mâles et 11 femelles. La dimension des 20 individus sélectionnés était variable, la hauteur allant de 1'0 à 2,1 m et I'aire de la couronne, de 1,3 à 27,6 m2 . Le sexe de chaque genet a été déterminé à partir des inflorescences. II est important de mentionner qu'à cette période de l'année, c'est-à-dire en début juin, les inflorescences ne sont habituellement pas épanouies. Cependant, en raison des conditions particulièrement favorables ayant prévalu pendant quelques jours en mai, certaines inflorescences commençaient a se déployer au moment de l'application des traitements. Sur chaque genet, quatre ramets ont été choisis en fonction de leur nombre de bourgeons floraux; ainsi, pour un rarnet, tous les bourgeons floraux étaient comptes et le choix était maintenu si et seulement si le ramet avait un nombre de bourgeons floraux équivalent à celui des autres rarnets déjà choisis. Ceci a été fait dans le but de nous assurer une constance de l'effort reproducteur entre ramet. Par la suite, à chaque ramet était assigné aléatoirement une combinaison particulière de traitements (voir plus bas). Un des ramets a donc servi de témoin, un autre a été soumis à l'éradication de tous ses bourgeons floraux. Un troisième ramet a subi I'annelage, technique qui consiste à enlever B l'aide d'une lame une section de l'écorce d'une largeur d'environ 5 mm et ce, sur tout le périmètre du tronc, à la base du ramet. Le xylème ainsi exposé a été recouvert d'une membrane de parafilm (Tukey 1978). L'application de cette technique a permis d'éliminer l'effet d'intégration physiologique entre les ramets d'un même genet et l'importation depuis ou l'exportation vers les racines d'hydrates de carbone. Cette manipulation s'est faite au moment où les feuilles étaient entièrement déployées, soit durant la première semaine de juillet 1995. À ce moment, l'activité photosynthétique était en cours. Finalement, un quatrième ramet a subi a la fois l'éradication de ses bourgeons floraux et I'annelage de sa tige. Les facteurs expérimentaux considerés étaient donc premièrement la présence/absence de structures reproductrices (éradication des bourgeons reproducteurs) et deuxièmement I'importation/exportation d'hydrates de carbone aux rametddepuis les ramets (annelage de la tige). 2.3 Échantillonnage de feuilles Sur chacun des quatre ramets sélectionnés de chacun des genets, toutes les feuilles ont été comptées. Elles ont été classées en deux catégories, 2 selon leur taille: normales, c'est-à-dire 2 1,5 cm et réduites, c'est-àdire c 1,5 cm2 de surface. En plus, pour chaque catégorie de taille de feuilles, le décompte s'est fait en tenant compte de la présence d'herbivorie. Le tout a été effectué durant les deux premières semaines de juillet 1995. Pour un échantillon de 20 feuilles par ramet (10 normales et 10 réduites, prélevées aléatoirement), la surface foliaire individuelle a été mesurée. Les moyennes respectives de surface foliaire ont été multipliées par le nombre de feuilles pour chaque ramet, nous fournissant ainsi une estimation de la surface foliaire totale pour chaque ramet. L'appareil ayant servi a mesurer la surface foliaire est de type portatif (CI - 202 de CID. lnc.), sa précision est au centième de cm2* Les échantillons de feuilles prélevées pour la surface foliaire ont été séchés à l'étuve à 75°C pendant 48 heures et la biomasse de chaque feuille a été déterminée. Ici encore, la biomasse foliaire moyenne a été multipliée par le nombre de feuilles (normales et réduites) nous fournissant une estimation de la biomasse foliaire totale par ramet. Les pesées ont été effectuées avec une balance "Mettler" dont le degré de précision est de 0,0001 g. Les mesures de surface foliaire et de biomasse ont été effectuées durant la dernière semaine de juillet 1995. Une fois pesées, les feuilles de chaque ramet ont été broyées pour fin d'analyses chimiques (concentration d'azote, de phosphore et de carbone). Ces analyses ont été effectuées au département des Sciences du bois et de la forêt de l'université Laval. L'azote a et4 analysé avec un appareil de type "Kjeltec Auto 1030 Analyser (micro-kjeldahl)". Quant au phosphore, il a été analysé avec un appareil de type "ICP modèle P40 de Perkin-Elmer (spectrométrie d'émission atomique au plasma)" (Parkinson et Allen 1975). Finalement, le carbone organique a été dosé par perte au feu (Gallardo et al. 1987). 2.4 Mesures physiologiques Pour les quatre ramets de chaque genet, des mesures physiologiques ont été effectuées périodiquement (transpiration et résistance stomatique). L'appareil ayant servi a prendre ces mesures est un porometre (LI-1600 de LI-COR).Pour chaque ramet à chaque période de mesure, la feuille sur laquelle la transpiration et la résistance stomatique étaient mesurées devait recevoir un maximum d'irradiance. De plus, la feuille était choisie à l'intérieur d'une portion délimitée du ramet. Autant que possible, ces mesures étaient effectuées lors de journées ensoleillées ou, du moins, alors que les conditions étaient constantes d'un ramet à l'autre pour un même genet. La prise de mesures s'est échelonnée du 15 juillet au 14 août 1995 inclusivement, à raison d'une ou deux fois par semaine selon les conditions d'ensoleillement. 2.5 Échantillonnage de rameaux À la fin de la saison de croissance, soit vers la fin septembre 1995, tous les rameaux de l'année en cours ont été prélevés. Ceux-ci ont été idenfifiés à l'aide des cicatrices laissées par les bourgeons terminaux. Les bourgeons végétatifs ont été dénombrés et leur biomasse a été incluse avec celle des rameaux. Les bourgeons reproducteurs ont aussi été dénombrés, mais leur biomasse a été déterminée séparément. Nous avons également évalué séparément la biomasse des rameaux persistants et celle des rameaux caducs. Ces derniers étaient facilement reconnaissables par leur coloration jaunâtre. Les mesures de biomasse ont été effectuées après que les tissus aient été séchés à l'étuve à 75°C pendant 48 heures. Pour chaque type de structures, soit les bourgeons reproducteurs, les rameaux persistants et les rameaux caducs, tout le matériel a été broyé. Lorsqu'il y avait un surplus, une partie seulement a été utilisée pour effectuer aussi des analyses de concentration d'azote, de phosphore el de carbone comme précédemment. 2.6 Échantillonnage de structures individus reproductrices sur d'autres Vingt autres individus (10 mâles et 10 femelles) ont été sélectionnés aussi en fonction de I'authenticité du genet dans l'aire d'étude afin de prélever des bourgeons reproducteurs, des inflorescences et des infrutescences. Nous avons choisi des genets autres que les genets expérimentaux afin de ne pas perturber ces derniers. Pour chacune de ces structures reproductrices, de 20 à 50 unités ont été prélevées aléatoirement au niveau de la couronne de chaque genet, dans le bu1 d'effectuer des analyses de concentration d'azote, de phosphore et de carbone. Les tissus, après séchage à l'étuve (75°C'48 heures), ont été broyés et analysés comme précédemment. Ces analyses chimiques el celles qui sont mentionnées précédemment ont été effectuées à l'automne 1995. Sur 20 autres genets (10 mâles et 10 femelles) ayant aussi été choisis au hasard toujours selon l'authenticité du genet, dix bourgeons reproducteurs, dix inflorescences et dix infrutescences ont été préievés et leur biomasse individuelle a été déterminée après séchage comme précédemment. Que ce soit pour la composition chimique ou la biomasse individuelle, l'échantillonnage de ces structures s'est effectué en fonction de la phénologie de l'espèce: inflorescences, début juin; infrutescences, début juillet; bourgeons reproducteurs, début octobre. 2.7 Analyses statistiques Mentionnons tout d'abord que chaque genet correspondant à chacun des 20 individus expérimentaux constituait un bloc complet: en effet, chacun des quatre traitements était représenté à l'intérieur de chaque genet. Nous voulions considérer cette source de variation liée au genet et l'exclure de nos analyses par l'intermédiaire du blocage, les comparaisons s'effectuant alors entre les traitements, à I'intérieur des genets. Les résultats relatifs aux 20 individus expérimentaux sur lesquels plusieurs variables furent estimées ont été analysés par l'entremise d'analyses de variance. Pour chaque variable à l'étude, I'analyse de variance correspondante comporte quatre facteurs ou critères de classification: le sexe (mâle ou femelle), le genet emboîté à 11int6rieut du sexe, l'éradication (oui ou non) et I'annelage (oui ou non). En ce qui concerne les variables "transpiration" et "résistance stomatique' des feuilles, l'analyse de variance (ANOVA) correspondante est une ANOVA à mesures répétées, puisque les mesures ont été prises à huit périodes durant la saison sur les mêmes unités expérimentales. Pour de qui est 20 autres individus sur lesquels des structures reproductrices (bourgeons, inflorescences et infrutescences) ont été prélevées afin de déterminer la composition chimique de chacune, I'analyse de variance correspondante comportait un seul facteur ou critère de classification soit le sexe (mâle ou femelle). Pour ce qui est de l'autre série de 20 individus ayant servi à déterminer la biomasse individuelle des bourgeons reproducteurs et des inflorescences, nous avons aussi eu recours au blocage. L'analyse de variance correspondante pour la biomasse de ces deux structures reproductrices comporte deux facteurs ou critères de classification, soient le sexe et I'individu emboîté à I'intérieur du sexe. Évidemment seulement un critère de classification était relié à la biomasse individuelle d'une infrutescence, soit I'individu (uniquement pour les femelles). Toutes les analyses de variance ont 6té réalisées avec la version 6.03 de SAS (SAS Institute Inc. 1989). CHAPITRE III 3.1 Mesures pré-expérimentales 3.1.1 Masse et composition chimique des structures reproductrices Au Tableau 1 figurent les données relatives à la masse et à la composition chimique de bourgeons reproducteurs, dlinfIorescences et d'infrutescences, en fonction du sexe des individus. Rappelons tout d'abord que chaque structure a été prélevée en fonction de la phénologie de l'espèce: les inflorescences au début juin, les infrutescences au début juillet et les bourgeons reproducteurs au début octobre. Si on considère chaque structure individuelle, la masse bu bourgeon reproducteur mâle est légèrement plus élevée que celle du bourgeon reproducteur femelle, mais la différence n'est pas significative (p > 0,05; Tableaux 1 et 2). Cependant, l'inflorescence mâle a une masse significativement plus élevée (1,34 fois) que celle de l'inflorescence femelle (p I 0,05; Tableaux 1 et 2). Pour ce qui est de l'infrutescence, sa masse est nettement plus élevée que celle du bourgeon reproducteur (mâle: 11,3 fois ou femelle: 14,1 fois) ou de l'inflorescence (mâle: 3,2 fois ou femelle: 4,3 fois; Tableau 1). Tableau 2. Analyse de variance (factorielle a deux facteurs) pour la masse individuelle d'un bourgeon reproducteur et d'une inflorescence. Sources de variation dl AK F P Bourgeon reproducteur Sexe Individu (sexe) Erreur lnf lorescence Sexe f ndividu (sexe) Erreur En ce qui concerne la composition chimique des structures, la concentration en carbone des bourgeons reproducteurs et des infiorescences ne diffère pas entre les sexes (p > 0,05;Tableaux 1 et 3). Par contre, la concentration en azote et en phosphore est significativement plus élevée pour les bourgeons reproducteurs mâles que pour les bourgeons reproducteurs femelles ( I l l 1 fois et 1,12 fois, respectivement) et pour les inflorescences femelles que pour les inflorescences mâles (1,12 fois et 1,22 fois, respectivement; tous les p I 0,05; Tableaux 1 et 3). La concentration des trois composantes chimiques (C, N, et P) pour les infrutescences est comparable à celle des autres structures reproductrices, bourgeons et inflorescences, mâles ou femelles (Tableau 1). Tableau 3. Analyse de variance (factorielle à un facteur) pour la composition chimique de bourgeons reproducteurs et d'inflorescences. - - Sources de variation A C dl F P Bourgeons reproducteurs a) Carbone Sexe Erreur b) Azote Sexe Erreur c) Phosphore Sexe Erreur Inflarescences a) Carbone Sexe Erreur 1 0,Ot 18 0,08 1 0,60 18 0,07 b) Azote Sexe Erreur c) Phosphore Sexe Erreur 1 9790202 18 295970 33,08 0,0001 La quantité (et non la concentration) de carbone, d'azote ou de phosphore présente dans chacun des types de structures résulte donc de la masse multipliée par la concentration spécifique: ainsi, les bourgeons reproducteurs et les inflorescences males contiennent plus de ces éléments chimiques que les structures femelles équivalentes. Un bourgeon reproducteur mâle contient, par rapport à un bourgeon reproducteur femelle, 1,24 fois plus de carbone, 1,33 fois plus d'azote la concentration spécifique supérieures) (ce qui est relié à la masse et mais une quantité comparable de phosphore. II y a 1,34 fois plus de carbone, 1,20 fois plus d'azote et 1,25 fois plus de phosphore dans une inflorescence mâle que dans une inflorescence femelle (ce qui est du à la masse élevée). Par contre, une infrutescence comporte beaucoup plus de carbone, d'azote et de phosphore que les autres structures reproductrices, mâles ou femelles (Tableau 1): ceci est directement relié à sa masse importante et non à la différence marquée de la concentration en carbone, en azote et en phosphore. Pour un même sexe, l'investissement (au sens statique du terme) de carbone, d'azote ou de phosphore diffère entre les structures reproductrices. Ainsi, chez les individus mâles, une inflorescence contient 3,4 fois plus de carbone, 6,O fois plus d'azote et 5'0 fois plus de phosphore qu'un bourgeon reproducteur. Chez les individus femelles, une inflorescence contient 3,2 fois plus de carbone, 6,7 fois plus d'azote et 4,O fois plus de phosphore qu'un bourgeon reproducteur. Une infrutescence, par contre, comporte 4,3 fois plus de carbone et 3,3 fois plus d'azote et de phospore qu'une inflorescence femelle. 3.1.2 Nombre initial de bourgeons floraux Le nombre initial de bourgeons floraux par ramet (Tableau 4) ne diffère pas significativement en fonction des traitements ou du sexe des individus (p > 0,05; Tableau 5). Cependant l'analyse de variance révèle des différences significatives entre les genets (individus) à l'intérieur d'un sexe (p = 0,0001). C'est dire que le blocage contribue a réduire de façon significative la variabilité globale et donne ainsi plus de Tableau 4. Nombre initial de bourgeons floraux par ramet pour chaque traitement, en fonction du sexe des individus. Entre parenthèses, écart-type de la moyenne. Traitements Mâles Femelles n= 9 n = 11 T:témoin; 6: bourgeons floraux éradiqués; A: tige annelée; BA: bougeons floraux éradiqués et tige annelée. Tableau 5. Analyse de variance (factorielle a quatre facteurs) pour le nombre initial de bourgeons floraux par ramet. Sources de variation Sexe Individu (sexe) Éradication Annelage Sexe"6radication Sexe'annelage Sexe'6radication"annelage @radication"annelage Erreur di MC F P puissance aux tests statistiques réalisés. Néanmoins, les ramets femelles semblent porter moins de bourgeons floraux que les ramets mâles: 51,5 f 6,4 et 69,9 f 8,5 respectivement. 3.1.3 Quantité de carbone, d'azote et de phosphore par ramet La figure 2 représente la quantité totale de carbone, d'azote et de phosphore contenue dans toutes les inflorescences d'un rarnet mâle ou dans toutes les infrutescences d'un ramet femelle. Cette valeur résulte de la multiplication de la quantité de C, N et P d'une structure reproductrice individuelle (inflorescence pour les mâles et infrutescence pour les femelles) par le nombre total de structures reproductrices d'un ramet de chaque sexe (ramet témoin; Tableau 4). Ainsi, la quantité totale de C investie dans les infrutescences d'un ramet femelle est environ 2,5 fois supérieure à celle investie dans les inflorescences d'un rarnet mâle. Pour ce qui est de la quantité totale de N et de P, les infrutescences d'un ramet femelle en contiennent environ 2,O fois plus que les inflorescences d'un ramet mâle. 3.2 Mesures expérimentales II est à noter que la prise des mesures expérimentales a débuté environ un mois après l'application des traitements d'bradication. Quant aux traitements d'annelage de la tige, ils ont été appliqués environ un mois après les traitements d'bradication, donc immediatement avant le début de la prise des mesures expérimentales. 3.2.1 Nombre de feuilles, et surface et masse foliaires Aux Tableaux 6a, b et c figurent les données relatives au nombre de feuilles, et à la surface et à la masse foliaires par ramet, en fonction des traitements, de la présence d'herbivorie et du sexe. Ces valeurs et Femelles O e (II O al .CI N (II Figure 2. Effort reproducteur total par ramet en termes de quantité (mg) de carbone, d'azote et de phosphore, en fonction du sexe. Tableau 6 a. Nombre de feuilles normales et réduites, et nombre total de feuilles par ramet, en fonctii Entre parenthéses, &art-type de la moyenne. Variables Sans herbivorie Traitements Males Femelles n=9 n=ll Mâle n= Nombre de feuilles nonnales T a B b BA b a A Nombre de feuilles rdduites T B BA A Nombre total de feuilles T B BA A T: ternoin; 8: bourgeons floraux éradiqués; A: tige annelAe; BA: bourgeons floraux éradiqués et tige z a, b: Des lettres différentes indiquent des différences significatives entre les traitements, pour chat euilles par ramet, en fonction des traitements. de la présence d'herbivorie et du sexe. Total Avec herbivorie Mâles n=9 Femelles n =II is floraux éradiqués et tige annelée. ? les traitements, pour chaque variable (P s 0,05; Tableau 7a). Mâles n=9 Femelles n= Il Tableau 6 b. Surface des feuilles normales et réduites, et surface totale des feuilles par ramet. en 1 Entre parenthéses, écort-type de la moyenne. Variables Sans herbivorie Traitements Males n=9 Femelles n = 11 Surface des feuilles normales (cm2) T a 3996.1 (678,8) B b 4854.6 (894.8) BA b 5679.7 (1292.9) A a 3818.2 (711,O) Surface des feuilles réduites (cm2) T 1 19,9 (44.4) B 204,4 (34.4) BA 247,l (47.7) A 165,2 (23.2) Surface totale des feuilles (cm21 T a 4196,O (716.9) B b 5059,O ( 9 19,6) BA b 5926,Q (1337,2) A a 3983.3 (729.6) T: témoin; B: bourgeons floraux éradiqubs; A: tige annelée; BA: bourgeons floraux dradiqués et tige a. b: Des lettres différentes indiquent des différences significatives entre fes traitements, pour ch !uilles par ramet. en fonction des traitements. de la présence d'herbivorie et du sexe. Avec herbivorie Mâles n =9 Femelles n=ll loraux éradiqués et tige annelée. ?s traitements, pour chaque variable (P I0.05; Tableau 7b). Total Mâles n =9 Femelles n = 11 Tableau 6 c. Masse des feuilles normabs et réduites, et masse totale des feuilles par ramet, en fonction Entre parenthèses, écart-type de la moyenne. - - Variables Sans herbivorie Màles n=9 Traitements Femelles n = Il Avec Mâles n= 9 Masse des feuilles normales (g) T a 30,077 (5,266) B b 35,631 (6,396) BA b 42,473 (9,530) A a 29,117 (5,363) Masse des feuilles réduites (g) T 1,264 (0,267) 1,401 (0,256) 0,303 (0,071) B 1,358 (0.234) 1,576 (O, 4 4 2 ) 0,200 (0,044) BA 1,640 (0,291) 1,492 ( 0 , 2 1 2 ) 0,216 (0,029) A 1,092 (O, 1 4 6 ) 1,738 ( 0 , 3 6 1 ) 0,254 (O. 0 47) Masse totale des feuilles (g) T a 31,341 (5,511) B b 36,988 (6,547) BA b 44.1 14 (9,786) A a 30,209 (5,479) T: témoin; B: bourgeons floraux éradiques; A: tige annelée; BA: bourgeons floraux éradiqués et tige am a, b: Des lettres différentes indiquent des différences significatives entre les traitements, pour chaquc lies par ramet, en fonction des traitements, de la presence d'herbivorie et du sexe. Avec herbivorje Mâles n=9 Femelles n = 11 floraux éradiquds et tige annelée. es traitements, pour chaque variable ( P S 0.05; Tableau 7c). Mâles n=9 Femelles n = 11 les analyses de variance présentées aux Tableaux 7a, b et c indiquent que I'herbivorie semble se manifester moins sur les feuilles des ramets dont les bourgeons floraux ont été éradiqués (réduction d'environ 25 O h du nombre de feuilles avec herbivorie; p I 0,05; Tableaux 6a et 7a) et ce, indépendamment de la dimension des feuilles. L'ampleur de I'herbivorie ne différe pas sigificativement en fonction des traitements d'annelage de la tige et du sexe des individus (p > 0,05), quoique les feuilles des individus femelles semblent être généralement moins affectées par I'herbivorie que celles des individus mâles. Le nombre total de feuilles ne diffère pas en fonction des traitements d'éradication ou d'annelage, ou du sexe (1479 pour les mâles et 1529 pour les femelles; p > 0,05; Tableau 7a). Par contre, la surface et la masse foliaires sont plus importantes pour les ramets dont les bourgeons floraux ont été éradiqués et ce, indépendamment du sexe (pour les mâles: éradication: 6197 cm2 et 45,8 g; non-éradication: 5052 cm2 et 38,O g; pour les femelles: éradication: 5535 cm2 et 40.5 g; nonéradication: 4995 cm2 et 34,4 g pour la surface foliaire totale et la masse foliaire totale, respectivement: p 5 0,05; Tableaux 7b et c). Cependant aucune de ces variables (nombre de feuilles, et surface et masse foliaires) ne diffère en fonction de I'annelage (p > 0,05; Tableaux 6a, b et c et 7a, b et c). 3.2.2 Transpiration et résistance stomatique des feuilles La résistance stomatique est souvent plus élevée chez les individus mâles que chez les individus femelles (e.g. résukats du 15, 20 et 28 juillet, et du 14 août; Tableau 8)' alors que la transpiration est souvent plus élevée chez les individus femelles. De plus, la résistance stomatique semble généralement plus dlevée, et la transpiraticn moins élevde, lorsque les tiges ont été annelées (e.g. resultats du 15, 20, 25 et 28 juillet; Tableau 8). Pourtant, les analyses de variance à mesures repétdes (Tableaux 9a et b) ne décélent aucune différence significative, au niveau de la transpiration et de la résistance stomatique, en fonction des traitements (annelage ou éradication) ou du sexe des individus (tous avec herbivorie Sexe Individu (sexe) hadication Annelage Sexe*Bradication Sexe'annelage Sexe'Bradication'annelage kradication'annelage Erreur c ) Nombre total de feuilles Sexe Individu (sexe) Eradication Annelage Bexe'éradication Sexenannelage Sexe'Bradlcation*annelage Bradication'annelage ~rreur Tableau 7 b. Analyse de variance (factorielle h quatre facteurs) pour la surface foliaire par ramet. Sources de variation a ) Surface foliaire sans herbivorie Sexe Individu (sexe) 1 Éradication Annelage Sexe'6radication Sexe'annelage Sexe'6radication'annelage Éradication*annelage Erreur 1 1 54 808641 0,89 2,64 0,1099 193162,91 O, 06 0,8026 1 18 1039784,17 537200,60 1,94 6,35 0,1811 0,0001 1 61nlRfl RQ 7 31 n nnaa 3061 565,63 b ) Surface foliaire avec herbivorie Sexe lndividu (sexe) kadication trreur b ) Surface foliaire avec herbivotle Sexe Individu (sexe) Éradication Annelage Sexe'6radlcation Sexe"annelage Sexe"Bradicatlon'annelage Éradicatlon*annelage Erreur c ) Surface foltalre L totale Sexe Individu (sexe) Éradication Annelage Sexe'dradication SexB*annelage Sexe*6radication'annelage ~radication'annetage Erreur Tableau 8. Valeurs de transpiration et de résistance stomatique des feuilles en fonction des traitements et du sexe des individus, à differentes périodes de la saison. Entre parentheses. Bcarî-type de la moyenne. Dates Transpiration Résistance stomatique (pg cm-2 s o l) Traitements 15 juillet (18.7; (S Mâles Femelles Mâles Femelles n=9 n = 11 n=9 n = Il 18,3)* T 6.16 (0.43) 7,33 (0.63) B 6.33 (0,43) 5.92 (0,44) W4 5.47 (0,70) 6,12 (0.55) A 5.44 (0,59) 6,85 (0,53) 20 juillet ( 1 7 1 17,7)' T 5,91 (0,33) 6,80 (0,49) B 6,21 (0,38) 7,10 (0,50) BA 5.85 (0,77) 6,34 (0,43) A 5,81 (0,53) 6,51 (0,57) 25 juillet (14,6; 14.5)' T 4.02 (0.15) 4.19 (0,30) B 4,02 (0,32) 3,79 (0,19) BA 3,36 (0,28) 3,78 (0,25) A 3,72 (0,23) 28 juillet cm-') 3,94 (0,23) (32,9; 32.0)' T 7,82 (0,65) 8,15 (0,85) B 7,68 (0,78) 8.08 (0.74) BA 7,76 (1 ,08) 7,79 (0.62) A 6.29 (1,14) 7,86 (0,65) Tableau8. (suite) 4 août (12.2; 11,5)* T 3.43 (0,23) 2.98 (0.35) B 3,19 (0,22) 2,86 (0,29) BA 3.09 (0.31) 2.88 (0.38) A 3.33 (0,28) 3,15 (0,44) 7 août (32.3; 31,9)* T 10.34 (0.88) 12,22 (0.85) B 11,Il (0.63) 10,53 (0,50) BA 9,79 (1.32) 11,15 (0,76) A 9,84 (1.41) 10,79 (1,03) 11 août (18.7; 19,1)* T 7.61 (0.42) 7.27 (0,35) B 7.49 (0.43) 7.72 (0,43) BA 7,45 (0,26) 7,36 (0.42) A 7,22 (0,47) 7,81 (0.47) 14 août (18,O; 17.3)' T 6.28 (0.80) 7,48 (0.60) B 6.53 (0,83) 7.89 (0,61) BA 6,03 (0,95) 7,28 (0.28) A 6,4l (0,94) 7,70 (0,62) T: t6moin; 6: bourgeons floraux Bradiqués; A: tige anneMe; BA: bourgeons floraux éradiqubs et tige annelée. température moyenne ( O C ) A la surface de la feuille pour les mâles et les femelles, respectivement. Tableau 9 a. Analyse de variance a mesures répétées (factorielle à cinq facteurs) sur la transpiration des feuilles a huit reprises durant la saison de croissance. Sources de variation dl MC F Sexe Individu (sexe) Éradication Annelage Sexe'éradication Sexe'annelage Sexe'éradication'annelage Éradication'annelage Erreur 1 Date Date'sexe Dateeindividu(sexe) Date'éradication Date'annelage Date'sexe'6radication Date*sexeeannelage Date'sexe'érad'annelage Y~?e'&adication'annelage Erreur 2 1VaIeurs ajustees de Greenhouse-Geisser pour les sources impliquant le facteur "date". + Seuil inferieur de probabilitd. P Tableau 9 b. Analyse de variance à mesures répétées (factorielle 2i cinq facteurs) sur la rbsistance stornatique des feuilles A huit reprises durant la saison de croissance. Sources de variation dl MC F PI Sexe Individu (sexe) Éradication Annelage Sexe'eradication Sexe'annelage Sexe'éradication'annelage Éradication'annelage Erreur 1 Date Date'sexe Dateeindividu(sexe) Date'éradication Date'annelage DateYsexe*éradication Date7sexe'anneIage Date'sexe'&ad'annelage Date'éradication'annelage Erreur 2 Valeurs ajustées de Greenhouse-Geisser pour les sources impliquant le facteur 'daten. ' Seuil infërieur de probabilit6. les p > 0,05), bien qu'elles mettent en évidence des différences significatives en fonction du temps. Cependant, le facteur "annelage de la tige" est marginalement significatif pour ce qui est de la variable "résistance stomatiquen (P = 0,0526; Tableau 9b). 3.2.3 Nombre de bourgeons végétatifs, et nombre et masse des bourgeons reproducteurs Le nombre de bourgeons végétatifs par ramet (à la fin de la période expérimentale, à l'automne 1995) ne diffère pas significativement entre les sexes et entre les traitements d'éradication ou d'annelage (Tableau 10 et 11) pourtant, les individus mâles semblent avoir moins de bourgeons végétatifs que les individus femelles (de 7 à 31% moins; p > 0,05; Tableaux 10 et 11). La masse des bourgeons reproducteurs (automne 1995) est plus importante pour les ramets dont les bourgeons floraux ont été éradiqués: environ 7% pour les mâles et 61% pour les femelles (p = 0,0204; Tableau 11). Chez les individus mâles, la masse des bourgeons reproducteurs est 111% plus élevée que chez les individus femelles (p = 0,0334; Tableaux 10 et 11). Des tendances semblables semblent se manifester au niveau du nombre de bourgeons reproducteurs, mais ici, les différences entre les traitements ou entre les sexes ne sont pas significatives (p > 0,05; Tableaux 10 et 11). Par contre, le nombre et la masse des bourgeons reproducteurs ne diffèrent pas en fonction de I'annelage de la tige (p > 0,05). Tableau 10. Nombre de bourgeons végétatifs, nombre et masse des bourgeons reproducteurs par ramet pour chaque traitement, en fonction du sexe des individus à la fin de la periode exp6rirnentale. Entre parenthéses, écart-type de la moyenne. Variables Femelles Traitements n=l l Nombre de bourgeons v6gdtatifs T 540,6 B 500,4 (83,8) BA 543,3 (97,2) A 451,7 (89,s) (69,5) Nombre de bourgeons reproducteurs T 120,4 (34,6) B 123,6 ( 3 7 , 9 ) BA 114,1 ( 2 5 , 9 ) A 112,3 (39,O) Masse des bourgeons reproducteurs (g) T a' 1 '711 ( 0 , 4 1 1 ) B b' 1,812 ( 0 , 4 4 9 ) 84 b' 1,647 (0,384) A a' 1,532 (0,432) b T: t6moin; B: bourgeons floraux BradiquBs; A: tige anneMe; BA: bourgeons floraux Bradlques et tige anneMe. a, b; a', b': Des lettres differentes indiquent des differences significatives entre les sexes (a, b) ou entre les traitements (a', b'). P a 0,05; Tableau 11. Tableau 11. Analyse de variance (factorielle à quatre facteurs) pour le nombre de bourgeons v6g8tatifsI et le nombre et la masse des bourgeons reproducteurs par ramet. Sources de variation dl a ) Nombre de bourgeons v4gdtatifss Sexe lndividu (sexe) Éradication Annelage Sexen6radication Sexe'annelage Sexe'6radication'annelage Éradication'annelage Erreur b ) Nombre de bourgeons reproducteurs Sexe Individu (sexe) Éradication Annelage Sexe'Bradication Sexe*annelage F P 3.2.4 Masse des rameaux II n'y a aucune différence significative entre les sexes et entre les traitements d'éradication ou d'annelage pour les variables reliées à la croissance raméale courante, soient la masse des rameaux persistants, celle des rameaux caducs et la masse totale des rameaux (tous les p > 0,05;Tableaux 12 et 13). Cependant, chez les individus femelles, la masse des rameaux persistants est supérieure d'environ 9% à celle des individus mâles, alors que la masse de leurs rameaux caducs est inférieure d'environ 40% à celle des individus mâles. Tableau 12. Masse des rameaux persistants et caducs, et masse totale des rameaux par ramet pour chaque traitement, en fonction du sexe des individus & la fin de la periode expdrimentale. Entre parenthhses, kart-type de la moyenne. Variables Traitements Mâles Femelles n=9 n = 11 Masse des rameaux persistants (g) T B BA A Masse des rameaux caduques (g) T B B4 A Masse totale des rameaux (g) T 6 BA A T: ternoin; 8: bourgeons floraux dradiquds; A: tige annelée; BA: bourgeons floraux dradiquds et tige anneMe. 3.2.5 Composition chimique des structures végétatives et reproductrices Les valeurs moyennes de la composition chimique des feuilles (Tableau 14) et l'analyse de variance associée (Tableau 15a) démontrent que chez les individus femelles, les feuilles sont plus riches en azote (environ 10%) que celles des individus mâles (P = 0,0161). Par contre, les feuilles des individus femelles ont une concentration en carbone légèrement moins élevée que celle des feuilles des individus mâles (P = 0,0156). Les feuilles portées par les ramets annelés ont une concentration en azote et en phosphore moins élevée, mais une concentration en carbone plus élevée, que les feuilles des rarnets témoins ou des ramets sur lesquels les bourgeons floraux ont été éradiqués (tous les p 5 0,05;Tableaux 14 et 15a). L'éradication des bourgeons floraux n'a donc pas d'effets significatifs sur la composition chimique des feuilles (Tableaux 14 et 15a). Pour ce qui est de la composition chimique des rameaux persistants et des rameaux caducs (Tableau 14), on n'observe aucune différence significative en fonction du sexe, de l'éradication des bourgeons floraux ou de Iaannelagedes tiges (tous les p > 0,05;Tableaux 14, et 15 b et c). Cependant, on peut remarquer certaines tendances. Les rameaux persistants et les rameaux caducs des individus femelles ont une concentration en azote plus élevée, mais une concentration en phosphore plus faible que celle des rameaux des individus mâles. La concentration en carbone pour les rameaux caducs est aussi légèrement plus élevée chez les individus femelles. Les valeurs moyennes concernant la composition chimique des bourgeons reproducteurs (N, P et C) et l'analyse de variance correspondante (Tableaux 14 et 15 d) suggèrent que les bourgeons reproducteurs des ramets dont les bourgeons floraux ont été éradiques chez les individus femelles ont une concentration en azote, en phosphore et en carbone Mgèrement plus élevée que ceux des rarnets témoins ou annelés; cependant, ces différences ne sont pas détectées chez les individus mâles (interaction "sexe*éradicationu significative pour les trois variables, p 5 0,05; Tableau 15d). Chez les individus mâles, les bourgeons reproducteurs présentent souvent une concentration en phosphore supérieure à celle des bourgeons reproducteurs des individus femelles; pourtant, ces différences ne sont pas significatives (p > 0,05; Tableau 14). Ces derniers résultats confirment les mesures préexpérimentales présentées à la page 20. h h h - h h h h - - - 0 0 0 0 0 - 0 0 Y Y Y Y ? a -c o- m ln ln ln ln l n l n l n l n ai 2 al C C Q al -- 0) C al V) .Q, a m 5 E 'al X 3 -! O Ln c 8 D O n ü m iÿ" 9, a c t m .-al 0) C ü .- V) 'al 7 u ü L a X a E O E V) t O al F 8 n ii -E E 2 t= * m c u m . r 0 C U 0 0 0 r 0 0 0 0 C 0 L - 0 - 0 - ô o ô ô o o o o o D rnospnore Sexe lndividu (sexe) kadication Annelage Sexe*Bradication Sexeaannelage Sexe*Bradication*annelage hadication*annelage Erreur c ) Carbone Sexe lndividu (sexe) Éradication Annelage Sexe"6radication Sexeaannelage SexeaBradicationaannelage E!radication*annelage Erreur Tableau 15 c. Analyse de variance (factorielle quatre facteurs) pour la composltlon chimique des rameaux caducs. Sources de variation a ) Azote Sexe Individu (sexe) hadication Annelage Sexe'6radication Sexe'annelage Sexe*Bradication*annelage Éradication*annelage Erreur b ) Phosphore Sexe Individu (sexe) fhadlcatlon Annelage Sexe'6radlcation Sexe'annelage di rtK: F P b ) Phosphore Sexe Individu (sexe) hadication Annelage Sexe'Bradlcation Sexe'annelage Sexe'6radication'anne tage Éradication'annelage Erreur c ) Carbone Sexe Individu (sexe) Eradication Annelage Sexe*8radication Sexe'annelage Sexe*Bradication'annelage Éradlcation*annelage Erreur 1 Tableau 15 d. Analyse de variance (factorielle & quatre facteurs) pour la composition chimique des bourgeons reproducteurs. Sources de variation a ) Axote Sexe Individu (sexe) Eradication Annelage Sexe'8radication Sexe*annelage Sexe*Bradication*annelage l%adlcation*annelage Erreur b ) Phosphore Sexe Individu (sexe) Éradication Annelage Sexd6radication Saxn*~nn~~I~n~i dl IMC F P CHAPITRE IV DISCUSSION 4.1 Effort reproducteur différentiel en fonction du sexe L'effort reproducteur d'un organisme représente la proportion de ressources allouées à la reproduction et peut être estimé de différentes façons (Elazzaz et Reekie 1985); il est souvent défini comme la proportion de biomasse totale allouée aux structures reproductrices (Reekie et Bazzaz 1987a). Plusieurs études ont compare les patrons d'allocation à la reproduction en termes de biomasse ou de nutriments et ont démontré que ces patrons pouvaient varier selon la devise utilisée (van Andel et Vera 1977; Abrahamson et Caswell 1982). En conséquence, l'utilisation d'une seule devise peut donner une image non-réaliste de l'effort. Idéalement, les ressources les plus lirnitantes devraient être utilisées pour déterminer I'effort reproducteur. Par contre, l a disponibilité des ressources peut être différente pour les individus d'une même population ou, pour un même individu, en fonction de sa phénologie (Bazzaz et Reekie 1985). Dans la présente gtude, les devises utilisées sont la biomasse, le carbone, l'azote et le phosphore. Dans le cadre d'une autre étude, réalisée dans le même secteur que celui de la présente étude et aussi pour le compte du saule planifolié, Gamache (1997) a démontré que le phosphore est l'élément le plus limitant dans le sol et que sa concentration diffère entre les individus. Pour revenir à la présente étude, lorsqu'on considère la quantité de carbone, d'azote et de phosphore investie dans un bourgeon reproducteur ou une inflorescence, I'effort reproducteur des mâles apparaît supérieur à celui des femelles. Si on considère les bourgeons reproducteurs, I'effort reproducteur supérieur des mâles provient B la fois de la plus grande concentration spécifique en azote et en phosphore, et de sa masse plus importante par rapport aux structures des femelles. La concentration en carbone est cependant équivalente entre les bourgeons reproducteurs des deux sexes. Pour les inflorescences, I'effort reproducteur supérieur des mâles provient essentiellement de la plus grande masse des structures, car la concentration spécifique en azote et en phosphore est supérieure chez les femelles. Ici encore, la concentration en carbone est équivalente entre les inflorescences de chaque sexe. En ce qui concerne I'effort reproducteur associé aux infrutescences, il surpasse de beaucoup celui des autres structures reproductrices, mâles ou femelles. Cet investissement supérieur provient de la très grande masse des infrutescences et non pas d'une concentration spécifique plus élevée en carbone, en azote ou en phosphore; en effet, celle-ci est comparable à celle des bourgeons et des inflorescences des deux sexes. Cette comparaison de I'effort reproducteur entre les mâles et les femelles, qui repose esentiellement sur les structures individuelles, n'est cependant pas complète; il y a lieu de se demander si les mâles ont davantage de bourgeons reproducteurs ou d'inflorescences que les femelles. Ce qui viendrait alors compenser pour leur effort moindre au niveau des structures individuelles. Dans le cadre de la présente étude, les bourgeons floraux ont été comptés initialement et le nombre est équivalent entre les sexes, quoique les femelles semblent en porter environ 1,4 fois moins (Tableau 4). Pourtant, I'effort reproducteur des femelles est globalement supérieur à celui des mâles. Ainsi, I'effort reproducteur correspondant au carbone investi dans toutes les infrutescences d'un ramet femelle, est environ 2,s fois plus élevé que I'effort reproducteur correspondant au carbone investi dans toutes les inflorescences d'un ramet mâle. En ce qui concerne le même type de comparaison pour l'azote et le phosphore, I'effort reproducteur des femelles est aussi supérieur à celui des mâles, mais d'environ 2,O fois plus. Selon quelques études, les mâles investissent davantage dans la production des fleurs que ne le font les femelles; mais au niveau de l'effort reproducteur total, les femelles investissent davantage à cause de la production des fruits (Oemleria cerasiformis, Allen et Antos 1988 et 1994; Chamaedorea tepejilote, Oyama et Dirzo 1988). Chez Oemleria cerasiformis, Allen et Antos (1988) ont trouvé que les mâles produisent en moyenne 2,9 fois plus de fleurs que les femelles. Cependant, l'effort reproducteur total des femelles (incluant les fruits) est de 4,1 fois supérieur. D'autres études ont aussi démontré que non seulement la plus grande biomasse des fruits, mais aussi leur quantité importante de nutriments, pouvait contribuer a I'effort reproducteur supérieur des femelles (Putwain et Harper 1972; Hancock et Bringhurst 1980; Bullock 1984). 4.2 Transpiration et résistance stomatique des feuilles La transpiration et la résistance stomatique des feuilles sont des mesures dynamiques indirectes de la photosynthèse, qui peuvent permettre de vérifier l'existence d'un budget fixe quant au carbone. Bien que ces deux variables ne démontrent aucune différence significative en fonction des traitements d'éradication et du sexe, elles laissent cependant entrevoir certaines tendances chez le saule planifolié. Ainsi, la transpiration des feuilles est plus élevée chez les femelles à cause d'une plus grande ouverture des stomates (résistance stomatique plus faible), ce qui permet vraisemblablement une plus grande entrée de CO2 dans l e m&ophylle. Ceci pourrait suggérer que les femelles ont une activité photosynthétique plus élevée que les mâles ce qui, par conséquent, pourrait impliquer qu'elles fixent davantage de carbone (ou du moins qu'elles diminuent leur coût respiratoire). Cette augmentation de l'activité photosynthétique de la part des femelles pourrait découler de leur plus grand effort reproducteur, qui constitue une plus grande demande en carbone, et pourrait démontrer que leur budget de carbone n'est pas nécessairement fixe. Cette hypothèse peut être renforcée par le fait que les feuilles des femelles sont plus riches en azote que celles des mâles. En effet, il y a une corrélation positive entre le taux de photosynthèse et la concentration en azote des feuilles, celle-ci étant directement reliée à la concentration de la RUBISCO (Evans 1989). Cependant, le degré d'ouverture des stomates peut varier non seulement en fonction du sexe, mais aussi en fonction du type d'habitat occupé par chacun des sexes. Ainsi, chez Saiix arctica, les femelles maintiennent une plus grande conductance stomatique des feuilles que les mâles, mais a condition qu'elles soient dans un milieu humide, tandis que les mâles maintiennent une plus grande conductance stomatique que les femelles même en milieu plus sec (Dawson et Bliss 1989). En ce qui concerne le saule planifolié, puisqu'il ne semble pas y avoir de ségrégation spatiale entre les sexes (Gamache 1997), la disponibilité de l'eau est fort probablement équivalente pour les mâles et les femelles. D'ailleurs, une conductance stomatique plus élevée peut impliquer une augmentation de I'activité photosynthétique, même lorsque le potentiel hydrique de la feuille est faible (Turner et Jones 1980, Ehleringer 1983), ce qui peut avoir d'importantes répercussions sur la fixation de carbone (Turner et Jones 1980). Chez le saule planifolié, les résultats suggèrent que l'activité photosynthetique ne diminue pas même si l'importance des puits est moindre. En effet, la transpiration n'est pas moins élevée (et la résistance stomatique n'est pas plus élevée) sur les feuilles des ramets dont les bourgeons floraux ont été éradiqués. Par conséquent, ceci peut laisser entendre qu'une plus grande partie des ressources demeure disponible pour d'autres fonctions. De plus, la résistance stomatique semble géndralement plus élevée (et la transpiration moins élevée) lorsque les ramets ont été annelés. En toute hypothèse, ceci pourrait signifier que les hydrates de carbone produits ne peuvent être stockés au niveau des racines, s'accumulent au niveau de la tige, et contribuent ainsi à diminuer l'activité photosynthétique. 4.3 Croissance raméale Peu importe les devises utilisées (biomasse, C, N, et P) et sans égard au sexe, il ne semble pas exister de conflits entre la reproduction et la croissance courante. Donc, les ressources non allouées à la reproduction courante (i.e. pour les traitements d'éradication) ne semblent pas l'avoir été davantage à la croissance des rameaux de l'année. II est possible cependant que le carbone non alloue à la reproduction courante ait été investi dans la production de nouveaux bourgeons reproducteurs (voir section 4.5) ou, mis en réserve. L'allocation du carbone à d'autres fonctions semble assez probable étant donné que l'activité photosynthétique ne semble pas avoir diminué malgré des puits moins importants. D'autre part, le carbone non utilisé pourrait aussi avoir contribué à la formation additionnelle de métabolites secondaires, e.g. composés phénoliques solubles (Chapin et al. 1990; voir section 4.4). Que nous n'ayons pas trouvé de conflits entre les fonctions de reproduction et de croissance courante chez le saule planifolié et ce, pour une durée d'étude correspondant à une saison de croissance, ne signifie pas nécessairement que ces conflits soient inexistants. II se peut que ce type de conflits soit davantage susceptible de se manifester a plus long terme. En effet, en manipulant l'effort reproducteur de Salix alaxensis, Fox et Stevens (1991) ont démontré qu'après une saison de croissance, il n'y avait pas de conflits évidents entre la reproduction et la croissance courante. De là, ils ont suggéré qu'une étude à plus long terme pourrait éventuellement mettre en évidence un effet cumulatif sur la croissance. Par contre, Elmqvist et al. (1991) ont démontré que pour les individus femelles de Salix rigida, des conflits s'exprimaient entre la reproduction et la croissance courante, et ce, après une seule saison de manipulations expérimentales. Nous devons également considérer que, dans notre étude, les bourgeons floraux qui ont été éradiquds en tout début de saison avaient atteint un stade de développement relativement avancé à cause d'une saison hâtive (voir Matériel et méthodes). Si l'éradication avait été effectuée plus tôt, il y aurait eu encore moins de ressources allouées à la reproduction et il se peut que ces ressources l'auraient été a la croissance raméale. E n effet, en comparant la masse moyenne des bourgeons floraux éradiqués en début de saison (moyenne I écart-type: mâles: 2,306 -t 0,364 g; femelles: 1,066 I 0,183 g) à celle de bourgeons reproducteurs durant la 0,411 g; femelles: 0,561 4 0,134 g), période de dormance (mâles: 1,711 on note une différence appréciable. Ainsi, pour les mâles, les bourgeons floraux éradiqu6s avaient une masse 1,3 fois plus élevée que ceile des bourgeons avant leur ouverture; pour les femelles, le rapport est de 1,9. + Bien entendu, la participation possible des structures reproductrices à leur propre budget de carbone (chez le saute planifolié, les bractées à la base des structures reproductrices et tes fruits sont verts) peut contribuer à diminuer les conflits potentiels de reproduction et, par conséquent, les coûts. L'activité photosynthétique des fruits de Acer, Cercis, Liquidambar, Magnolia et Tilia, par exemple, contribue jusqu'au quart ou plus au poids sec des fruits (Bazzaz et al. 1979). C'est donc dire que le carbone alloué à la reproduction ne reflète pas le coût exact de reproduction (Reekie et Bazzaz 1 9 8 7 ~ ) . Pour le saule planifolié, l'absence de conflits entre les fonctions de croissance et de reproduction courante ne signifie pas pour autant que le coût de reproduction soit complètement atténué puisque les résultats présentés ici suggèrent que ce coût semble se manifester davantage par une diminution de la reproduction future (Voir section 4.5). En supposant que les structures reproductrices du saule planifolié contribuent en partie à leur propre budget de carbone, cela suffirait peut-être à amoindrir le coût de reproduction au point d'atténuer les conflits avec la croissance courante, mais pas avec la reproduction future. En ce qui concerne la croissance future du saule planifolié, estimée à partir du nombre de bourgeons végétatifs (méristèmes donnant naissance à des rameaux et à des feuilles), il ne semble pas non plus y avoir de conflits entre cette fonction et la reproduction courante. En effet, sur les ramets dont les bourgeons floraux ont été éradiqués, le nombre de bourgeons végétatifs n'est pas plus important. Ceci laisse donc supposer que les ressources non allouées B la reproduction courante ne l'ont pas été davantage à la croissance future. Entre les sexes, on remarque que les mâles ont moins de bourgeons végétatifs que les femelles. Ils investiraient donc moins au niveau de la croissance future que les femelles. Pourtant les mâles du saule planifolié ont un effort reproducteur global plus faible que celui des femelles. Une étude réalisée par Gamache (1997) a démontré que, chez le saule planifolié, les mâles les plus âgés (> 40 ans) ont tendance à maintenir une meilleure croissance que celle de femelles d'âge équivalent. C'est donc dire que l'effort reproducteur supplémentaire des femelles peut avoir des répercussions sur la croissance, mais à plus long terme. Par contre, la même étude (Gamache 1997) démontre aussi que les femelles les plus jeunes (< 20 ans) maintiennent une meilleure croissance que les mâles. Par conséquent, les résultats des deux études suggèrent que, du moins chez les individus les plus jeunes, les femelles peuvent investir davantage que les mâles à la fois au niveau de la reproduction et de la croissance. D'autres facteurs pourraient aussi contribuer à atténuer les conflits potentiels d'allocation de ressources: il s'agit de la retranslocation des sucres et de la reabsorption des nutriments contenus dans les feuilles ou d'autres structures végétatives caduques, ou dans les structures reproductrices en sénescence. Selon Chapin et Kedrowski (1983), la capacité de réabsorption des nutriments se retrouve chez plusieurs plantes, mais cette habileté peut varier considérablement selon les espèces (Small 1972; Luxmoore et al. 1981; Chapin et Kedrowski 1983; Gray 1983; Killingbeck 1984 et 1985; Killingbeck et Costigan 1988). Par exemple, Killingbeck et Costigan (1988) ont trouvé que Quercus ilicifolia était relativement efficace en matière de réabsorption de l'azote et du phosphore à partir de feuilles sénescentes (70% et 59 %, respectivement). De plus, May et Killingbeck (1992) ont déterminé que la réabsorption des nutriments pouvait contribuer a augmenter la valeur adaptative de Q. ilicifolia en termes de biomasse foliaire, de croissance radiale et de production de fruits. On peut se demander si la reabsorption des nutriments ne peut être ajustée en fonction de puits supplémentaires tels que le développement des rameaux. Chapin et al. (1990) laissent entendre que la croissance est maintenue d'abord par l'apport de nutriments en provenance du sol, mais qu'en période de croissance rapide, les plantes peuvent dépendre substantiellement des réserves de nutriments. Les nutriments en réserve interviendraient lorsque les nutriments du sol ne peuvent suffire à la demande. Ce qui pourrait s'appliquer davantage en région subarctique puisque les nutriments du sol semblent plus limités (particulièrement sur un sol sablonneux). L'azote, par exemple, est mobile et peut être réabsorbé lors de la sénescence des fleurs et des fruits (Antos et Allen 1990). Dès que les feuilles sénescent, une partie significative de I'azote est réabsorbée dans les rameaux (Kozlowski et al. 1991). En ce qui concerne le carbone retransloqué, il ne semble pas contribuer beaucoup à la fonction de croissance (Chapin et al. 1990). Ainsi, pour 40 espèces d'arbres des régions tempérées, Chapin et Kedrowski (1983) ont signalé qu'une plus grande proportion d'azote et de phosphore est réabsorbée comparativement a celle du carbone. L'importance de la réabsorption et de la retranslocation n'a pas été estimée, dans la présente étude, mais la concentration en azote et en phosphore des rameaux caduques est plus faible que celle des autres structures (feuilles, rameaux persistants et bourgeons reproducteurs). On peut alors supposer qu'il y a réabsorption de l'azote et du phosphore des rameaux caducs vers les rameaux persistants. Ceci pourrait, par conséquent, contribuer à atténuer les conflits potentiels entre les fonctions de reproduction et de croissance courante. En ce qui concerne la concentration en carbone, elle est plutôt équivalente entre les structures ci-haut mentionné. Les structures reproductrices, constituant des puits importants, peuvent moduler l'activité photosynthétique des tissus végétatifs avoisinants (Kozlowski et Keller 1966; Weaver et Johnson 1985; Wardlaw 1990). Dawson et Bliss (1993) ont trouvé que pour les ramets de Salix arctica comportant des structures reproductrices (chatons), le taux de photosynthese des feuilles était sup8rieur. Ceci pourrait s'expliquer par les puits importants que constituent les chatons. En effet, il semble y avoir une importante corrélation entre l'importance des puits et le taux de photosynthese (Kozlowski et al. 1991). Autrement dit, comme la plus grande demande en carbone de la part des structures reproductrices peut être compensée, en partie, par une augmentation de la photosynthese, cela peut contribuer à diminuer les conflits internes d'allocation entre les fonctions de reproduction et de croissance. Selon Harper (1977), en général la croissance des arbres n'est pas limitée par le carbone puisque la photosynthese peut facilement augmenter avec l'apparition de nouveaux puits. La photosynthese pourrait aussi être ajustée en fonction de facteurs hormonaux, mais on ne s'entend pas sur leur importance relative par rapport à celle des puits (Neales et lncoll 1968; Hanson et al. 1988). Dans la présente étude, le taux de photosynthese ne semble pas augmenter en fonction de puits supplémentaires puisque la transpiration des feuilles portées par les ramets dont les bourgeons floraux n'ont pas été éradiqués n'est pas plus élevée. Cela ne signifie pas pour pourtant que, pour le saule planifolié, l'activité photosynthétique ne soit pas modulée par une demande supplémentaire. En effet, une "representation plus appropriée" des taux de photosynthèse, pour toute la saison de croissance, aurait consisté à prendre des mesures à des intervalles plus rapprochées et à divers endroits de la couronne. De plus, la transpiration et la résistance stomatique des feuilles sont des mesures indirectes qui ne reflètent peut-être pas toujours les taux de photosynthèse correspondants. 4.4 Production de feuilles Chez le saule planifolié, l'ampleur de I'herbivorie diffère en fonction de l'éradication en ce sens qu'elle semble se manifester moins sur les feuilles des rarnets dont les bourgeons floraux ont été éradiqués. Chez cette espèce, ce sont presque exclusivement les insectes qui causent des dommages aux feuilles (observations personnelles). II est possible que les ressources non allouées A la reproduction l'aient été à une production supplémentaire de métabolites secondaires. En effet, selon plusieurs études (en laboratoire ou en milieu naturel), l'ampleur de I'herbivorie est inversement proportionnelle à l a quantité de métabolites secondaires (McKey et al. 1978; Coley 1983). Ces substances, en particulier des glycosides phénoliques, ont été retrouvées au niveau des feuilles et de l'écorce chez plusieurs espèces de saules, dont des espèces "apparentées" au saule planifolié (Palo 1984; Tahvanainen et al. 1985; Julkunen-Tiitto 1986). Chez Salix cinerea, par exemple, lorsque la floraison est très importante, il s'ensuit généralement un taux élevé d'herbivorie de la part d'invertébrés, l'année suivante (Alliende 1989). De même, on a détermine à partir de rameaux de saules, de peupliers, de sorbiers et de bouleaux sur lesquels on avait éradiqué des bourgeons reproducteurs, qu'ils étaient moins comestibles, dans ce cas pour des petits mammifères, que les rameaux qui portaient des bourgeons (Danell et al. 1987). Ces résultats laissent supposer que la défense contre les ennemis peut aussi entrer en conflit avec les autres activités de l'organisme puisqu'une partie des photo-assimilats doit être utilisée pour la production de métabolites secondaires (Kozlowski et al. 1991). Cependant, dans la présente étude, I'herbivorie ne diffère pas significativement entre les sexes quoiqu'on peut remarquer une certaine tendance, Le. que les feuilles des femelles semblent généralement être moins affectées que celles des mâles, ce qui correspond, en général, à ce qu'on retrouve dans la littérature. Chez les saules, on a proposé que la préférence des herbivores envers les individus mâles pourrait être reliée a la concentration des tissus en sucres et en nutriments (Danell et al. 1985; Boecklen et al. 1990) ou en glycosides phénoliques et en tannins (Palo 1984). Que les femelles du saule soient moins affectées par I'herbivorie que les mâles pourrait suggérer que leurs tissus contiennent davantage de métabolites secondaires. Ceci effectivement s'applique pour plusieurs espèces de saules pour lesquelles les femelles contiennent des concentrations plus élevees de glycosides phénohques et de tannins au niveau des rameaux et de l'écorce (Boecklen et al. 1990). II semble donc que les femelles puissent investir davantage que les mâles A la fois dans la reproduction et dans la formation de métabolites secondaires. La concentration des feuilles en nutriments peut aussi influencer la prdférence des herbivores. Chez Salix lasiolepis, Boecklen et al. (1990) ont détermine une plus grande concentration foliaire en azote, phosphore et potassium pour les mâles que les femelles. Alliende (1989) est arrive à la même conclusion pour ce qui est de la concentration en azote de5 feuilles de Salix cinerea. Ceci n'est cependant pas le cas pour le saule planifolié, puisque ce sont les feuilles des femelles qui ont une plu: grande concentration en azote. De plus, notre expérimentation démontre que la production de feuillez est plus importante en termes de surface et de masse lorsque l'investissement dans la reproduction est diminuée par l'éradication dc bourgeons reproducteurs (marginalement significatif pour la variabk surface et significatif pour la variable masse). C'est donc dire qu'il peus y avoir conflit entre la reproduction et la production de feuilles. Tuorn et al. (1982) ont aussi trouvé que, chez Betula pendula les branche5 comportant des chatons avaient des feuilles de plus petite dimension. 4.5 Production de bourgeons reproducteurs Dans la présente étude, en tout début de saison, les structurez reproductrices ont été dénombrées (composante de l'effort reproducteu initial) et leur nombre était équivalent entre les traitements et entrc les sexes, quoique les ramets mâles semblaient en porter un peu plu5 que les rarnets femelles. Nos résultats expérimentaux suggèrent I E présence de conflits entre la reproduction courante et la reproductior future, le sexe confondu. Chez le saule planifolié, le coût de reproductior semble donc se manifester à ce niveau (différences significatives) Ainsi, pour les ramets dont les bourgeons floraux ont été éradiqués, ;1 masse des bourgeons reproducteurs (prélevés à l'automne) est plu: élevée. II semble donc que les ressources non allouées à la reproductior courante semblent l'avoir été à la reproduction future. Peu d'études expérimentales démontrent l'expression de conflits entrc ces deux fonctions. Par conséquent, selon Reznick (1985), l'interactior entre la reproduction courante et la reproduction future n'est pas bier comprise sur une base expérimentale. Chez Salix rigida, Elmqvist et al (1991) ont déterminé la présence de conflits entre la reproductior courante et la reproduction future mais pour les femelles seulement et ce, pour une seule saison de croissance. Pourquoi les conflits se manifestent-ils davantage à un niveau qu'à un autre? L'aspect phénologique est fort probablement important. Ainsi, comme la production de rameaux de l'année en cours (croissance courante) a lieu avant la production de nouveaux bourgeons reproducteurs, il se peut que la fonction de croissance monopolise les ressources au détriment de la fonction de reproduction future. De plus, en rapport avec les résultats de la présente étude qui d h o n t r e n t l'absence de conflits entre la reproduction et la croissance courante, on pourrait aussi se demander si ces deux fonctions compétitionnent pour les mêmes ressources. Selon Bazzaz et Reekie (1985) il n'est pas certain que la reproduction et la croissance soient limitées par les mêmes ressources. Ces auteurs mentionnent aussi qu'il est possible que la reproduction et la croissance ne compétionnent pas directement, que les ressources ne soient pas librement échangés entre ces deux fonctions et, finalement, que le décalage de temps restreigne l'allocation des ressources entre ces fonctions. Cependant, ces conflits ne s'expriment pas plus chez les femelles, même si elles investissent davantage au niveau de la reproduction. Comme il n'y a pas de ségrégation spatiale en fonction du sexe (Gamache, 1997), l'atténuation de l'effort reproducteur supérieur des femelles pourrait s'expliquer par une augmentation de l'activité photosynthétique en réponse à des puits plus importants, une contribution des structures reproductrices à leur propre budget de carbone, une retranslocation des sucres et une réabsorption des nutriments depuis les structures caduques, des mécanismes discutes précédemment. Le coût différentiel de reproduction des femelles semble plutôt s'exprimer en fonction de la concentration en azote, en phosphore et en carbone de leurs bourgeons reproducteurs initiés à la fin de la saison de croissance. Ainsi, les bourgeons reproducteurs prélevés à l'automne sur les ramets femelles dont les bourgeons floraux ont été éradiqués au printemps ont une concentration en N, en P et en C plus élevée que celle des bourgeons reproducteurs des ramets femelles témoins. Ceci suggère que chez le saule planifolié, l'azote, le phosphore et le carbone non alloués a la reproduction courante auraient pu l'être à la reproduction future. Le coût différentiel de reproduction s'exprimerait donc en terme de concentration spécifique plutôt que de biomasse. De là, l'hypothèse suivante peut être émise: A plus long terme, le coût de reproduction pourrait s'exprimer en terme de biomasse. La littérature ne semble pas faire 6tat de l'expression d'un coQt de reproduction en terme de concentration de nutriments, Que ce soit au niveau de la croissance courante ou de la reproduction future, le traitement d'annelage de la tige chez le saule planifolié ne semble pas avoir eu d'impacts. Ainsi, bien que les ramets annelés ont dû accumuler davantage d'hydrates de carbone que les autres ramets, ces ressources ne semblent pas avoir été alloués à la croissance des rameaux de l'année ou à la production des bourgeons reproducteurs de la saison subséquente. Autrement dit, la masse ou la concentration en carbone des rameaux ou des bourgeons reproducteurs n'est pas plus élevée sur les ramets annelés. C'est au niveau des feuilles que la concentration en carbone (non la masse) varie en fonction de I'annelage. En effet, la concentration en carbone est plus élevée pour les feuilles portées par les ramets annelés. D'autre part, et toujours selon le principe d'allocation des ressources, il est possible d'émettre I'hypothèse que les hydrates de carbone accumulés au niveau des ramets annelés aient pu aussi être mis en réserve en majeure partie dans les rameaux. 4.6 Conclusion Chez le saule planifolié, l'investissement dans la reproduction est plus important chez les femelles que chez les mâles, à cause de la production supplémentaire de fruits. Les conflits d'allocation de ressources se manifestent entre la reproduction courante et la reproduction future, et non entre la reproduction et la croissance courante. Cependant, les conflits ne s'expriment pas de façon plus marquée chez les femelles, en dépit de leur effort reproducteur supérieur. Comme la transpiration des feuilles tend à être plus élevée chez les femelles, ceci suggère un taux de photosynthèse plus élevé de leur part, ce qui peut expliquer I'atténuation des conflits d'allocation de ressources. D'autres facteurs peuvent aussi expliquer I'atténuation de tels conflits chez le saule planifolié, en particulier chez les femelles: une plus grande efficacité d'utilisation des ressources, la retranslocation des sucres et la réabsorption de nutriments depuis les structures végétatives ou reproductrices en sénescence, et l'activité photosynthétique de la part de structures reproductrices. Abrahamson W.G. & H. Caswell. 1982. On the comparative allocation of biornass, energy and nutrients in plants. Ecology 63: 982-991. Agren J. 1988. Çexual differences in biomass and nutrient allocation in the dioecious Rubus chamaemorus. Ecology 69: 962-973. Allen G.A. & J.A. Antos. 1988. Relative reproductive effort in males and fernales of the dioecious shrub Oemleria cerasiformis. Oecologia (Berlin) 76: 111-118. Allen G.A. & J.A. Antos. 1994. Biomass allocation among reproductive structures in the dioecious shrub Oemleria cerasiformis - a functional interpretation. Journal of Ecology 82: 21-29. Alliende M.C. 1989. Demographic studies of a dioecious tree. II. The distribution of leaf predation within and between trees. Journal of E C O I O ~77: Y 1048-1058. Antos J.A. & G.A. Allen 1990. A cornparison of reproductive effort in the dioecious shrub Oemleria cerasiformis using nitrogen, energy and biomass as currencies. American Midland Naturalist 124: 254-262. Ashman T.L. 1994. A dynamic perspective on the physiological cost of reproduction in plants. American Naturalist 144: 301-316. Atmospheric Environment Service. 1981. Canadian clirnate normals. S Environment a Canada, Atmospheric Environment Service. Atmospheric Environment Service. 1982. Canadian climate normals. Frost. 1951-1980. Environment Canada, Atmospheric Environment Service. Barrett S.C.H. & K. Helenurm. 1981. Floral sex ratios and life history in Aralia nudicaulis (Araliaceae). Evolution 35: 752-762. Bawa K.S. 1980. The evolution of dioecy in flowering plants. Review of Ecology and Systematics 11: 15-39. Bawa K.S. & P.A. Opler. 1975. Evolution 29: 167-179. Annual Dioecisrn in tropical forest trees. Bazzaz F.A. & R.W. Carlson. 1979. Photosynthetic contribution of flowets and seeds to reproductive effort of an annual colonizer. New PhytoIogist 82: 223-232. Bazzaz F.A., R.W. Carlson & J.L. Harper. 1979. Contribution to reproductive effort by photosynthesis of flowers and fruits. Nature 279: 554-555. Bazzaz F.A. & E.G. Reekie. 1985. The meaning and measurement of reproductive effort in plants. Pages 373-387 in J. White, editor. Studies on plant demography. Academic Press, London, England. Bazzaz F.A., N.R. Chiariello, P.D. Coley & L.F. Pitelka. 1987. resources to reproduction and defense. BiaScience 37: 58-67. Allocating Bell G. 1980. The costs of reproduction and their consequences. American Naturalist 116: 45-76. Boecklen W.J., P.W. Price & S. Mopper. 1990. Sex and drugs and herbivores: sex-biased herbivory in arroyo willow (Salix lasiulepis). 581-588. E c o ~ o 71~: ~ Bormann F.H., G.E. Likens & L M . Melillo. 1977. Nitrogen budget for an aggrading northern hardwood forest ecosystem. Science 196: 981-983. Boussingault J.B. 1868. Agronomie, chimie agricole et physiologie, 2d edn. Mallet-Bachelier, Paris. 7v. Briggs M.A. & J.C.Schultz. 1990. Chemical defense production in Lotus corniculatus L. II. Trade-offs among growth, reproduction and defense. Oecologia (Berlin) 83: 32-37. Bullock S.H. 1984. Biomass and nutrient allocation in a neotropical dioecious palm. OecoIogia (Berlin) 63: 426-428. Carr D.E. 1991. Sexual dimorphism and fruit production in a dioecious understory tree, Ilex opaca Ait. Oecologia (Berlin) 85: 381-388. Chapin F.S. Ili 1989. The cost of tundra plants structures: concepts and currencies. American Naturalist 133: 1-19. Evaluation 01 Chapin F.S. III & R.A. Kedrowski. 1983. Seasonal changes in nitrogen and phosphorus fractions and autumn retranslocation in evergreen and deciduous taiga trees. Ecology 64: 376-391. Chapin F.S. III E.D. Schulze & H.A. Mooney. 1990. The ecology and economics of storage in plants. Annual Review of Ecology and Systematics 21 : 423-447. Charnov E.L. 1982. The theory of sex allocation. Press, Princeton. New Jersey. 355 p. Princeton University Cipollini M.L. & D.F. Whigham. 1994. Sexual dimorphism and cost of reproduction in the dioecious shrub Lindera benzoin ( L a u raceae) . Arnerican Journal of Botany 81: 65-75. Cody M.L. 1966. A general theory of clutch size. Evolution 20: 174-184. Coley P.D. 1983. Herbivory and defensive characteristics of tree species in a lowland tropical forest. Ecolological. Monographs 53: 209-233. Conn J.S. 1981. Phenological differentiation between the sexes of Rumex hastatulus: niche partitioning or different optimal reproductive strategies? Bulletin of the Torrey Botanical Club 108: 374-378. Crawford R. M. M. & J. Balfour. 1983. Female predominant sex ratios and physiological differentiation in arctic willows. Journal of Ecology 71: 149-16 0 . Crawford R. M. M. & J. Balfour. 1990 Female-biased sex ratios and differential growth in arctic willows. Flora 184: 291 -302. Danell K., T. Elmqvist, E. Ericson & A. Salomonson. 1985. Sexuality in willows and preferences by bark eating voles: defense or not? Oikos 44: 82-90. Danell K., T. Elmqvist, L. Ericson & A. Salomonson. 1987. Are there general patterns in bark-eating by voles on different shoot types from woody plants? Oikos 50: 396-402. Dawson T.E. 1987. Comparative ecophysiological adaptations in arctic and alpine populations of a dioecious shrub, Salk arctica. Dissertation, University of Washington, Seattle, USA. Dawson T.E. & L.C. Bliss. 1989. Patterns of water use and the tissue water relations in the dioecious shrub, Salix arctica: the physiological basis for habitat partitioning between the sexes. Oecologia (Berlin) 79: 332-343. Dawson T.E. & L.C. Bliss. 1993. Plants as mosaics: leaf-,ramet-, and gender-level variation in the physiology of the dwarf willow, S a l i x arctica. Functional Ecology 7: 293-304. Delph L.F. 1990. Sex-differential resource allocation patterns in the subdioecious shrub Hebe subalpina. Ecology 71: 1342-1351. Dodson C.H. 1962. Pollination and variation in the subtribe Catasetinae (Orchidaceae). Annals of the Missouri Botanical Garden 49: 35-36. Ehleringer J.R. 1983. Ecophysiology of Amaranthus palmeri, a Sonoran Desert summer annual. Oecologia (Berlin) 57:107-112. Elmqvist T., L. Ericson, K. Danell & A. Salomonson. 1988. Latitudinal sex ratio variation in willows, Salix spp., and gradients in vole herbivory. Oikos 51: 259-266. Elmqvist T., R. G. Cates, J.K. Harper & H. Gardfjell. 1991. Flowering in males and females of a Utah willow, Salix rigida, and effects on growth, tannins, phenolic glycosides and sugars. Oikos 61: 65-72. Emlen J.M. 1984. Population biology: the coevolution of population dynamics and behavior. Macmillan, New York, New York, USA. 547 p. Evans J.R. 1989. Photosynthesis and nitrogen relationships in leaves of CJ plants. Oecologia (Berlin) 78: 9-1 9. Farrar J.F. 1993. Sink strength: what is it and how do we measure it? Plant Cell and Environment 16: 1013-1046. Fernald M.L. 1950. Gray's manuai of botany. New York, USA. 1632 p. Van Nostrand, New York, Fox J.F. & C.C. Stevens. 1991. Costs of reproduction in a willow: experimental responses vs. natural variation. Ecology 72: 1013-1 023. Freeman D.C., L.G. Klikoff & K.T. Harper. 1976. Differential resource utilization by the sexes of dioecious plants. Science 193: 597-599. Freeman D.C., K. T. Harper & EL. Charnov. 1980. Sex change in plants: old and new observations and new hypotheses. Oecologia (Berlin) 47: 222232. Gadgil M. & W.H. Bossert. 1970. Life historical consequences of natural selection. American Naturalist 104: 1-24. Gallardo J.F., J. Saavedra, T. Martin-Patino & A. Millan. 1987. Soil organic matter determination. Communications in Soil Science and Plant. Analysis 18: 699-707. Gamache 1. 1997. Structure spatiale d'une population d'arbustes dioïques, Salix planifolia, le long d'un gradient successionnel en milieu dunaire subarctique. Mémoire de maîtrise. Faculté des Sciences et de Génie, Université Laval, Québec. Geiger D.R. 1979. Control of partitioning and export of carbon in leaves of higher plants. Botanical Gazette 140: 241 -248. Gifford R.M. & L.T. Evans. 1981 . Photosynthesis, carbon partitioning, and yield. Annual Review of Plant Physiology 32: 485-509. Goldman D.A. & M.F. Willson. 1986. Sex allocation in functionally hermaphroditic plants: a review and critique. Botanical Review 52: 157194. Grant M.C. & J.B. Mitton. 1979. Elevational gradients in adult sex ratios and sexual differentiation in vegetative growth rates of P o p u l u s tremuloides Michx. Evolution 33: 914-918. Gray J.T. 1983. Nutrient use by evergreen and deciduous shrubs in southern California. 1. Community nutrient cycling and nutrient-use efficiency. Journal of Ecology 71: 21-41. Gross K.L. & J.D. Soule. 1981. Differences in biomass allocation to reproductive and vegetative structures of male and fernale plants of a dioecious perennial herb, Silene alba (Miller) Krause. American Journal of Botany 68: 801-807. Hancock J.F. Jr. & R.S. Bringhurst. 1980. Sexual dimorphism in the strawberry Fragaria chiloensis. Evolution 34: 762-768. Hanson P.J., J.G. Isebrands, R E Dickson & R.K. Dixon. 1988. Ontogenetic patterns of CO2 exchange of Quercus rubra L. leaves during three flushes of skdot growth. 1. Median flush leaves. Forest Science 34: 55-68. Harper J.L. & J. Ogden. 1970. The reproductive strategy of higher plants. 1. The concept of strategy with special feference to Senecio vulgaris L. Journal of Ecology 58: 681 -698. Harper J.L. 1977. Population biology of plants. Academic Press, New York, New York, USA. 892 p. Hickman J.C. & L.F. Pitelka. 1975. Dry weight indicated energy allocation in ecological strategy analysis of plants. Oecologia (Berlin) 21 : 117121. Horvitz C. & D.W. Schernske. 1988. Demographic cost of reproduction in a Neotropical herb: an experimental study. Ecology 69: 1741-1746. Houssard C., J.D. Thompson & J. Escarré. 1994. Do sex-related differences in response to environmental variation influence the sexratio in the dioecious Rumex acetosella? Oikos 70: 80-90. Julkunen-Tiitto R. 1986. A chemotaxonomic survey of phenolics in leaves of northern Salicaceae species. Phytochemistry 25: 663-667. Killingbeck K.T. 1984. Nitrogen and phosphorus resorption dynarnics al five tree species in a Kansas gallery forest. American Midland Naturalist 111: 155-164. Killingbeck K.T. 1985. Autumnal resorption and accretion of trace metals in gallery forest trees. Ecology 66: 283-286. Killingbeck K.T. & S.A. Costigan. 1988. Element resorption in a guild 01 understory shrub species: niche differentiation and resorption thresholds. Oikos 53: 366-374. Korpelainen H. 1992. Patterns of resource allocation in male and female plants of Rumex acetosa and R. acetosella. Oecologia (Berlin) 89: 133139. Kozlowski T.T. & T. Keller. 1966. Botanical Review 32: 293-382. Food relations of woody plants, Kozlowski T., P.J. Kramer & S.G. PalIardy. 1991. The physiologica ecology of woody plants. Acadernic Press, Toronto, Canada. 657 p. Lavoie, G. & P. Morisset. 1987. Salicaceae. Pages 299-345 dans P, Morisset and S. Payette. Flore du Québec nordique et des territoires adjacents. Centre d'études nordiques et Herbier Louis-Marie, Universit€ Laval, Québec. Inter-relations of vegetative and reproductivc Leonard E.R. 1962. growth, with special reference to indeterminate plants. Botanica Review 28: 353-410. Lloyd D.G. 1973. Sex ratios in sexually dimorphic Umbelliferae Heredity 31: 239-249. Lloyd D G . & C.J. Webb. 1977. Secondary sex characters in seed plants Botanical Review 43: 177-216. Lovett Doust J. & P.B. Cavers 1982. Sex and gender dynamics in jack-in. the-pulpit, Arisaema triphyllum (Araceae). Ecology 63: 797-807. Lovett Doust L. & J. Lovett Doust. 1987. Leaf demography and clonal growth in female and male Rumex acetosella. Ecology 68: 2056-2058. Lovett Doust J. 1989. Plant reproductive strategies and resource allocation. Trends in Ecology and Evolution 4: 230-234. Luken J.O. 1987. Interactions between seed production and vegetative growth in staghorn sumac, Rhus typhina. Bulletin of the Torrey Botanical Club 114: 247-251. Luxrnoore R.J., T. Grizzard & R.H. Strand. 1981. Nutrient translocation in the outer canopy and understory of an eastern deciduous forest. Forest Science 27: 505-518. May J.D. & T. Killingbeck. 1992. Effects of preventing nutrient resorption on plant fitness and foliar nutrient dynamics. Ecology 73: 1868-1 878. McKey D., P. G. Waterman, C.N. Mbi, J.S. Gartlan & T.T. Struhsaker. 1978. Phenolic content of vegetation in two African rain forests: ecological implications. Science (Wash., D.C.) 202: 61-64. Meagher T.R. & J. Antonovics. 1982. The population biology of Chamaelirium luteum, a dioecious mernber of the lily farnily: life history studies. Ecology 63: 1690-1 700. Mitton J.B. & M.C. Grant. 1980. Observations on the ecology and evolution of quaking aspen, Populus tremuloides, in the Colorado Front Range. American Journal of Botany 67: 202-209. Neales T.F. & L.D. Incoll. 1968. The control of leaf photosynthesis rate by the level of assimilate concentration in the leaf: a review of the hypothesis. Botanical Review 34: 107-125. Niesenbaum R.A. 1992. Sex-ratio, components of reproduction, and pollen deposition in Lindera benzoin (Lauraceae). American Journal of Botany 79: 495-500. Ogden J. 1968. Studies on reproductive strategy with particular reference to selected composites. Ph.0. thesis, University of Wales, Cardiff. Opler P.A. & K.S. Bawa 1978. Sex ratios in some tropical forest trees. Evoiution 32: 812-821. Oyama K. & R. Dirzo. 1988. Biomass allocation in the dioecious tropical palm Chamaedora tepejilote. Plant Species Biology 3: 27-33. Palo R.T. 1984. Distribution of birch (Betula spp.), willow (Salix spp.), and poplar (Populus spp.) secondary metabolites and their potential role as chernical defense against herbivores. Journal of Chernical Ecology 10: 499-520. Parkinson J.A. & S.E. Allen. 1975. A wet oxidation procedure suitable for the determination of nitrogen and mineral nutrients in biological material. Communications in soi1 science and plant. analysis 6: 1-11. Peoples M.5. & M.J. Dalling. 1988. The interplay between proteolysis and amino acid metabolism during senescence and nitrogen reallocation. Pages 181-217 in L.D. Nooden and A.C. Leopold, editors. Senescence and aging in plants. Academic Press, San Diego, California USA. Popp J.W. & J.R. Reinartz. 1988. Sexual dimorphism in biomass allocation and clonal growth of Xanthoxylum americanum. American Journal of Botany 75: 1732-1741. Primack R.B. & P. Hall. 1990. Costs of reproduction in the pink lady's slipper orchid; a four-year experimental study. American Naturalist 136: 638-656. Primack R.B., S.L. Miao & K.R. Becker. 1994. Costs of reproduction in the pink lady's slipper orchid (Cypripedium acaule): Defoliation, increasec fruit production. and fire. American Journal of Botany 81: 1083-1090. Putwain P.D. & J.L. Harper. 1972. Studies in the dynamics of plani populations. V. Mechanisms governing the sex ratio in Rumex acetosa anc R. acefoseila. Journal of Ecology 60: 113-129. Quinn J.A. 1991. Evohtion of dioecy in Buchioe dactyloïdes (gramineae) tests for sex-specific vegetative characters, ecological differences and sexual niche-partitioning. American Journal of Botany 78: 481-488. Reekie E.G. & F.A. Bazzaz. 1987a. Reproductive effort in plants. 1. Carbor allocation to reproduction. American Naturalist 129: 876-896. Reekie E.G. & F.A. Bazzaz. 1987b. Reproductive effort in plants. 2. Doer carbon reflect the allocation of other resources? American Naturalis, 129: 897-906. Reekie E.G. & F.A. Bazzaz. 1987c. Reproductive effort in plants. 3. Effec of reproduction on vegetative activity. American Naturalist 129: 9074 91 9. Reznick D. N. 1985. Costs of reproduction: an evaluation of the empirica evidence. Oikos 44: 257-267. Reznick D. N. 1992. Measuring the costs of reproduction. Ecology and Evotution 7: 42-45. Trends ir Ryan D.F. & F.H. Bormann. 1982. Nutrient resorption in northern hardwooc forests. BioScience 32: 29-32. Sachs R.M. 1977. Nutrient diversion: an hypothesis to explain the chernical control of flowering. Horticultural Science 12: 220-222. Sakai A.K. & T.A. Burris. 1985. Growth in barren and seed-bearing aspen clones: a twenty-five-year longitudinal study. Ecology 66: 1921-1927. Sakai A.K. & T.L. Sharik. 1988. Clonal growth of male and female bigtooth aspen (Populus grandidentafa). Ecology 69: 2031-2033. SAS lnstitute Inc. 1989. SASISTAT@ user's guide. edition. Vol. 2. SAS Institute, Cary, N.C. Version 6.03,fourth Schecter I., J.T.A. Proctor & D.C. Elfving. 1994. Carbon exchange rate and accumulation in limbs of fruiting and nonfruiting apple trees. Journal of American Society for Horticultural Science 119: 150-156. Small E. 1972. Photosynthetic rates in relation to nitrogen recycling as an adaptation to nutrient deficiency in peat bog plants. Canadian Journal of Botany 50: 2227-2233. Stearns S.C. 1989. E C O I O ~3:Y 259-268. Trade-offs in life-history evolution. Functional Phenolic Tahvanainen J., R. Julkunen-Tiitto & J. Kettunen. 1985. glycosides govern the food selection pattern of wiilow feeding leaf beetles. Oecologia (Berlin) 67: 52-56. Tang W. 1990. Reproduction in the cycad Zamia pumila in a fire-climax habitat: an eight-year study. Bulletin of the Torrey Botanical Club 117: 368-374. Thornpson K. & J.A. Stewart. 1981. The measurement and meaning 01 reproductive effort in plants. American Naturalist 177: 205-211. Tukey H.B. 1978. Dwarfed fruit trees for orchard, garden, and home: with special reference to the control of tree size and fruiting in commercial fruit production. Cornell University Press. 562p. Tuomi J., P. Niemela & R. Mannila. 1982. Resource allocation on dwarf shoots of birch (Betula pendula): Reproduction and leaf growth. New Phytologist 91 : 483-487. Turner N.C. & M.M. Jones. 1980. Turgor maintenance by osmotic adjustment: a review and evaluation. Pages 87-103 in N.C. Turner and P.J. Krarner, editors. Adaptation of Plants to Water and High Temperature Stress. John Wiley and Sons, New York. Van Andel J. & F. Vera. 1977. Reproductive allocation in S e n e c i o sylvaticus and Chamaenerion angustifolium in relation to mineral nutrition. Journal of Ecology 65: 747-758. Wade K.M., R.A. Armstrong & S.R. J. Woodell. 1981. Experimental studies on the distribution of the sexes of Mercurialis perennis L. 1. Field observations and canopy removal experiments. New Phytologist 87: 431 -438. Wallace C.L. & P.W. Rundel. 1979. Sexual dirnorphism and resource allocation in male and female shrubs of Simmondsia chinensis. Oecologia (Berlin) 44: 34-39. Wardlaw I.F. 1968. The control and pattern of carbohydrates in plants. Botanical Review 34: 79-105. movement of Wardlaw I.F. 1990. The control of carbon partitioning in plants. New Phytologist 116: 341-381. Waring R.H. & W.H. Schlesinger. 1985. Forest ecosystems: concepts and management. Acadernic Press, Orlando, Florida, USA. 340 p. Weaver R.J. & J.O. Johnson 1985. Relationship of hormones to nutrient mobiliration and the interna1 environment of the plant: the supply of mineral nutrients and photosynthate. Pages 3-36 in R.P. Pharis and D.M. Reid editors. Hormonal Regulation of Development. III. Role of Environmental Factors. Encyclopedia of Plant Physiology New Series. Vol. II. Springer-Verlag, Berlin, Heidelberg, New York. Williams R.F. 1955. Redistribution of mineral elements during development. Annual Review of Plant Physiology 6: 25-42. Williams G.C. 1966. Natural selection, the costs of reproduction, and a refinement of Lack's principle. American Naturalist 100: 687-690. Willson M.F. 1986. On the costs of reproduction in plants: Acer negundo. American Midland Naturalist 1 15: 204-207. Woolhouse H.W. 1973. Senescence processes in the life cycle of flowering plants. BioScience 28: 25-31. IMAGE NALUATION TEST TARGET (QA-3) APPLIED A I W G E .lnc 1653 East Main Street Rochester. NY 14609 USA Phone: 7161482-0300 F x i l 61288-5989 =-, = = --- O 1993. Appoied Imaga. lx.Al Rqh& Reserved