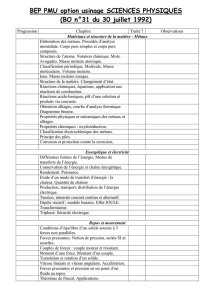
Chapitre 5 Relations entre structure électronique et propriétés des éléments

Chapitre 5
Relations entre structure électronique et propriétés des
éléments
I – Introduction
Rappel: Dans la nature on cherchera toujours à aller vers « l'état le plus stable »
Il s'agit d'un état qui possède la de plus grande stabilité électronique ( soit les gaz
rare, c'est à dire le groupe 18 qui possèdent des couches de valence de la forme:
ns²p6)
[He], [Ne], [Ar], [Kr], [Rd] ...
Ils sont stables à l'état monoatomique (on trouve le Néon seul par exemple)
Par contre ils sont quand même réactif (chimiquement parlant) au Fluor et à
l'Oxygène qui sont tout deux des éléments très électronégatifs.
→ Pour information, il existe des composé tel que le KrF2
. L'[He] est un gaz inflammable (utilisé dans les dirigeables)
Pour l'[He] liquide on arrive jusqu'à 4 Kelvin (réfrigérant)
Également utilisable comme laser
. [Ne] laser de type → Ne – He ou pour les néons
. [Ar] sert à éviter l'oxydation de l'air (réaliser des expériences sensibles sous
atmosphère [Ar] plutôt que le milieu naturel)
Les autres sont séparés entre métaux et non métaux
Il s'agit de « l'escalier » du tableau périodique (à droite propriété non métallique, à
gauche propriété métallique)
Puis il y a ceux qui ont le cul entre deux chaises, les « métalloïdes » ou « les semi-
conducteurs ».

Métaux Non-métaux
Quelques caractéristiques:
- Éclat
- Bien conducteur
- Résistance électrique proportionnel à
l'élévation de la température
- Ils sont malléables (déformation)
- Ils sont ductilités* (on peut les étirer)
- Ils ont une EI qui est faible (réducteur,
ils donnent facilement des cations) (dans
l'eau ils donnent des oxydes basiques)
Quelques caractéristiques:
- Isolant
- Résistance électrique indépendante de la
température
- EI forte (oxydant) (ils donnent
facilement des anions) (dans l'eau des
oxydes acides)
Définition:
→ En résistance des matériaux, la ductilité désigne la capacité d'un matériau à se
déformer plastiquement sans se rompre. La rupture se fait lorsqu'un défaut (fissure ou
cavité), induit par la déformation plastique, devient critique et se propage. La ductilité
est donc l'aptitude d'un matériau à résister à cette propagation. S'il y résiste bien, il est
dit ductile, sinon il est dit fragile
Comportements à la rupture en essai de traction: (a) fragile, (b) ductile et (c) complètement ductile.

1) Métaux, non-métaux, semi-conducteurs
Les conductivités électriques des métaux est mesurable
Les métaux sont les éléments les plus nombreux de la classification
Tout les métaux sont des solides sauf le Mercure (dans les conditions standards)
Ils donnent tous des cations (caractère réducteur)
–En terme de configuration électronique ; un métal (sauf [He] / [Ge] et [As]), le
nombre d'électron de valence appartenant aux orbitales sp est inférieur ou égal
au nombre quantique n maximum, ce sera un métal
Exemple : [C] n'est pas un métal; Sur la couche de valence avec 6 é- c'est supérieur
au n max qui vaut 2
Ne marche que pour les éléments qui sont dans les bloc s et les bloc p !!!
–Métaux de transition : c'est un élément qui a sa sous-couche d en cours de
remplissage ou un élément pouvant donner un ion ayant sans sous-couche d
incomplète
Exemple : [Cu] est un métal de transition, le [Zn] ne l'est pas
–Ce sont des oxydants qui vont capter des électrons pour se rapprocher de l'état
de stabilité le plus proche, on va les trouver sous les 3 états physiques
possibles.
Info culture
La conduction: Plus la bande de conduction est proche de la couche de valence plus
ça va être simple pour l'électron de passer dans tout les sens
Cette bande de conduction se déplace et plus elle monte et plus l'é- doit sauter
une grande marche
Un semi-conducteur c'est un truc qui va aller se foutre au milieu pour que la
marche soit moins grande pour l'électron / On améliore sa conductivité car on joue
simplement sur cette bande grâce au semi-conducteur.
Les supra-conducteurs => Les conducteurs ont toujours une résistance
quelconques qui forcément va venir gêner l’efficacité du bordel. La supra-
conductivité c'est de trouver des conducteur qui arrive à ignorer cette résistance à
température ambiante ( habituellement pour avoir de tel performance on baisse la
température )
–L’élément qui possède le caractère métallique le plus prononcé c'est le
Francium qui est le moins électronégatif

2) Formation des ions
X + né- => Xn- Anion
X => Xn+ +e- Cation
Les métaux vont toujours donner le cation isoélectronique au gaz rare qui précède.
Les non-métaux vont toujours donner des anions isoélectronique au gaz rare qui suis.
Exemple :
[Mg] => [Ne] 3s² => Mg 2+ [Ne]
[S] => [Ar] 3s²3p4 => S 2- [AR]
Les métaux de transition vont donner des cations (c'est une chimie très vaste).
Métaux de transition => [18] (n-1) d9 ns² 0 ≤ y ≤ 9 écrire inférieur
ou égale.
On enlève les électrons de la sous-couche s avant ceux de la sous-couche d
Pour chaque élément de transition il existe plusieurs cation et il n'y a pas de
préférence de cation.
II- Réactivité des métaux
1) Groupe 1: Les alcalins
C'est le groupe 1 de type ns1 avec n > 1
Donc [H] n'est pas un alcalin!!
Un grand rayon atomique.
Une Énergie de ionisation (normalement de première ionisation) qui est faible (car il
donne facilement un cation monovalent isoélectronique au gaz rare).
Ce sont des espèces très réactive, qui n'existe pas à l'état atomique, juste à l'état d'ion.
Exemple : Le sodium seul n'existe pas, ce n'est que du NaCl
(Aussi appelé Chlorure de sodium ou sel de table)

Exemple : Les hydroxydes des alcalins (NOH) ce sont des bases fortes (NaOH =
soude c'est une base forte) (KOH c'est la potasse / corrosif)
Les s'agit d'une classe de composés chimiques composés d'un cation de
métal alcalin et d'un anion hydroxyde (OH-), soit :
•l'hydroxyde de lithium (LiOH) ;
•l'hydroxyde de sodium (NaOH) ;
•l'hydroxyde de potassium (KOH) ;
•l'hydroxyde de rubidium (RbOH) ;
•et l'hydroxyde de césium (CsOH).
L'hydroxyde alcalin le plus commun est l'hydroxyde de sodium, appelé «
soude » en solution aqueuse, et disponible dans un grand nombre de
produits de droguerie comme des déboucheurs chimiques. Un autre
représentant commun est l'hydroxyde de potassium (appelé « potasse »
en solution aqueuse), notamment présent dans les solutions de nettoyage
des surfaces boisées.
→ Na2 CO3 f carbonate de sodium
→ NaHCO3 bicarbonate ou hydrogénocarbonate de sodium (Na) (sert à calmer les
acides) (levure)
→ KNO3 Nitrate de potassium (ça fait aussi des explosifs) (des engrais)
2) Les alcalino-terreux
Groupe [2] et couche de valence : ns²
Donnent des cations divalents isoélectronique aux gaz rares qui précède
ce sont des éléments qui sont moins réactif que les Alcalins
Avec l'oxygène ils vont donner des oxydes MO ou des peroxyde MO2
Ils réagissent moins violemment avec l'eau pour donner les hydroxydes
correspondants il va falloir chauffer (activer la réaction) (différence avec les Alcalins,
qui ont une réaction quasi-immédiate lorsqu'ils sont plongé dans l'eau)
Exemple :
[Be] utilisation dans les alliances, résistances à la corrosion, la traction des alliages
léger (améliore la ductilité des éléments)
[Mg] Alliage / pyrotechnie => Ce sont les mèches lentes / protection contre la
corrosion
[Sr] (NO3)2 valise de détresse couleur rouge
[Ba] (NO3)2 valise de détresse de couleur verte
 6
6
 7
7
1
/
7
100%