Hydrogénoı̈des et méthode de Slater Un hydrogénoïde

Hydrogénoı̈desetméthodedeSlater
Unhydrogénoïdeouatomehydrogénoïdeestunionmonoatomiquenepossédantqu'unseul
électroncommel’hydrogène.Iladoncunestructureélectroniquesemblableàcelledel'atome
d'hydrogène:1s1.C'estdoncunatomeauquelonaarrachéles(Z‐1)électrons.Ils’agitd’uncation.
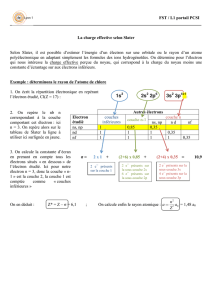
Formulegénéraledeshydrogénoïdes:ZX(Z‐1)+
Parcontre,contrairementàl’hydrogène,lachargedesonnoyauest+Ze(oùZestlenuméro
atomiquedel'élémentchimiqueetelachargeélémentaire).
L’énergiedel’électrond‘und’hydrogénoïdeestdonnéeparl’expression:
13,6
oùnestlenombrequantiqueprincipal(entierpositifnonnul)quidésignelenumérodelacouche
électroniquedanslaquellesesituel'électronet1eV=1,602.10‐19J.
Énergied’ionisation
Laréactiondepremièreionisationd’unhydrogénoïdes'écrit:X(Z‐1)+
(g)XZ+
(g)+e‐
Pourl’hydrogène:∆→ | ||0 |13,6
-13,6*Z2
-3
,
4*Z2
-1,51*Z2
-0,85*Z2

LaméthodedeSlaterpermetde«transformer»unatomepolyélectroniqueenun
hydrogénoïde.Poursimulerunédificeélectroniqueàunélectron,oncalculeunechargenucléaire
effectiveperçueparchaqueélectron:Z*=Z‐ oùZestlachargenucléaireréelleetreprésente
l'effetd'écranproduitparlesélectronsplusprochesouaussiprochesdunoyau.L'effetd'écranjsur
estlasommedeseffetsd'écranj‐>iexercéssurl'électronjparl'électronj,entoutautreélectroni
tenantcomptedelasituationdel'électronj.
Ilfautsuivreladémarchesuivante:
‐ Ecrirelaconfigurationélectroniquedel’élémentetl’ordonnerselon:(1s)(2s,2p)(3s,3p)
(3d)(4s,4p)(4d)(4f)(5s,5p)...
‐ Choisirl’électronpourlequeloncherchelachargeeffective.Touslesautresélectrons
apporterontunecontributionpartiellesiàlaconstanted’écrantotale.Cettecontribution
dépend:
o dutyped’orbitale(s,p),(d)ou(f)del’électron,
o delacoucheélectroniquendel’électron.
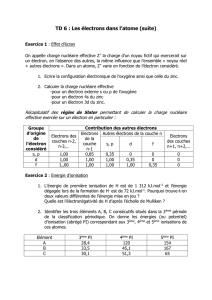
‐ Lavaleurdeiestrésuméedansletableausuivant.
Constantesd’écran
Electron
d’origine
Contributiondesautresélectrons
n‐2,n‐3... n‐1nn+1,n+2...
s,pdf
s,p10,85 0,35 000
d1110,35 00
f11110,35 0
Exemple:chargeeffectived’unélectronexternedel’azote
L’azote7Napourconfigurationélectronique:1s22s22p3.Onpeutl’écriresouslaforme:
(1s)2(2s,2p)5.
Unélectrondelacoucheexterne(2s,2p)adonccommeélectronsd’écran:
4électrons(s,p)delacouchen:i=0,35,
2électronssdelacouchen‐1:i=0,85.
Onendéduit:=(2x0,85)+(4x0,35)=3,10
Donclachargeeffective:Z*=Z‐s=7‐3,1=3,9
.
Ze
j
.
Z*e
1
/
2
100%