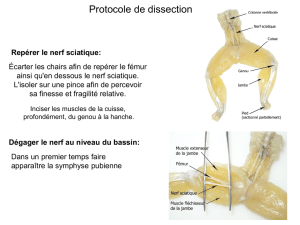
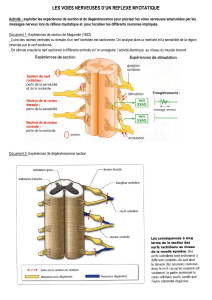
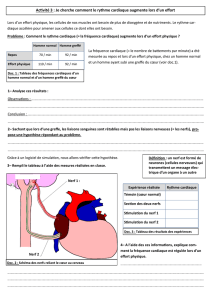
Syndromes canalaires entre « hanches » et « pieds » Entrapment

Syndromes canalaires entre « hanches » et « pieds »
Entrapment neuropathies between hips and feet
David Uzenot
a,*
, Stéphanie Cantiniaux
b
, Jean Pouget
a
a
Service de neurologie et des maladies neuromusculaires, CHU La Timone, 264, rue Saint-Pierre, 13385 Marseille cedex 05, France
b
Service de neurologie et de pathologie du mouvement, CHU La Timone, 264, rue Saint-Pierre, 13385 Marseille cedex 05, France
Reçu le 9 janvier 2007 ; accepté le 6 février 2007
Disponible sur internet le 22 février 2007
Mots clés : Syndrome du canal tarsien ; Neuropathie péronière ; Névrome de Morton ; Neuropathie tibiale ; syndrome canalaire
Keywords: Tarsal tunnel syndrome; Peroneal neuropathy; Morton’s neuroma; Tibial neuropathy; Entrapment neuropathy
1. Introduction
Le syndrome canalaire le plus fréquent aux membres infé-
rieurs est la compression du nerf péronier (fibulaire commun)
au col de la fibula. Elle s’exprime préférentiellement sur le
versant moteur et pose surtout un problème de pronostic fonc-
tionnel. Les autres syndromes, plus rares, s’expriment par une
symptomatologie douloureuse du genou ou du pied. La recon-
naissance de ces syndromes rares peut autoriser un traitement
chirurgical efficace. Cependant, ces diagnostics ne doivent pas
être surestimés, notamment en ce qui concerne les syndromes
douloureux du pied, afin d’éviter des interventions chirurgica-
les inutiles.
2. Compression du nerf péronier (nerf sciatique poplité
externe)
2.1. Anatomie (Figs. 1a,1b)
Le nerf péronier commun ou fibulaire (nerf sciatique poplité
externe) provient de la division du nerf sciatique, en arrière du
fémur, en nerf péronier commun et nerf tibial (nerf sciatique
poplité interne). Le chef court du muscle biceps fémoral (m.
biceps crural) est le seul muscle ischiojambier innervé par le
nerf péronier commun (nerf tibial pour les autres). Le nerf
péronier commun se termine par une bifurcation sous le col
de la fibula entre les insertions du muscle péronier, en nerf
péronier superficiel (ou nerf musculocutané) et en nerf péronier
profond (nerf tibial antérieur).
Le nerf péronier profond traverse le septum intermusculaire
antérieur pour rejoindre la loge antérieure de jambe, où il va
donner des collatérales pour les muscles de la loge antérieure
de jambe, muscle tibial antérieur (muscle jambier antérieur),
muscle long extenseur des orteils (muscle extenseur commun
des orteils), muscle long extenseur de l’hallux (muscle exten-
seur propre du gros orteil). Il se termine en deux branches ter-
minales médiales (motrice) et latérale (sensitive).
Le nerf péronier superficiel chemine entre les muscles péro-
niers et le septum intermusculaire antérieur au travers du tunnel
fibulaire, pour ensuite devenir sous-cutané au tiers inférieur de
la jambe. Il se termine en deux branches médiale et latérale
(innervation sensitive de la face dorsale du pied). Il émet sur
son trajet trois collatérales motrices pour le muscle long péro-
nier (long péronier latéral), le muscle court péronier (court
péronier latéral) et le muscle troisième péronier (péronier anté-
rieur).
2.2. Physiopathogénie
2.2.1. Compression du nerf péronier commun au col
de la fibula (col du péroné)
Il s’agit du syndrome canalaire le plus fréquent aux mem-
bres inférieurs. Le nerf péronier est à ce niveau très superficiel
et en contact étroit avec la tête de la fibula. Dans la majorité
http://france.elsevier.com/direct/REVRHU/
Revue du Rhumatisme 74 (2007) 401–408
*
Auteur correspondant.
Adresse e-mail : [email protected] (D. Uzenot).
1169-8330/$ - see front matter © 2007 Elsevier Masson SAS. Tous droits réservés.
doi:10.1016/j.rhum.2007.02.004

des cas, l’atteinte du nerf péronier survient en l’absence de
compression anatomique. Cependant, il est fréquemment
retrouvé à l’interrogatoire des circonstances favorisantes
(84 % des cas pour Aprile et al.) [1,2]. En premier lieu, il est
rapporté des situations dans lesquelles le nerf a pu être com-
primé de manière aiguë ou chronique contre la fibula, notam-
ment lors d’une station à genoux prolongée ou lors d’une sta-
tion assise les jambes croisées (23 % des cas), ou dans les
suites d’un geste chirurgical (20 % des cas) [3,4].L’atteinte
postchirurgicale survient le plus souvent après une chirurgie
du genou, mais est également possible après une chirurgie
abdominale ou thoracique [1]. Le mécanisme est dans ces cas
le souvent lié soit à la position opératoire, en particulier lorsque
des étriers sont utilisés, soit au geste chirurgical lui-même
(mise en place d’une prothèse de genou, ostéotomie). Lorsque
le mécanisme de la compression n’est pas évident, la durée de
l’intervention et l’existence de facteurs prédisposants (diabète
ou neuropathie) semblent expliquer en partie la survenue de ce
type d’atteinte. La notion d’une perte de poids récente est éga-
lement un facteur favorisant retrouvé dans 14 % des cas, ce qui
s’explique par la diminution en cas de perte de poids du cous-
sinet adipeux protégeant habituellement le nerf péronier au
niveau du col de la fibula [1]. Dans certains cas, cette compres-
sion peut être favorisée par une compression extrinsèque ou
intrinsèque du nerf péronier. Il peut ainsi être retrouvé un
kyste synovial [5,6] ou un kyste mucoïde endoneural [5,7].
La fréquence de cette anomalie a été estimée à 18 % de patients
présentant une atteinte du nerf péronier en échographie [8].
Spinner et al. proposent que ces kystes endoneuraux soient en
fait d’origine intra-articulaire : le kyste proviendrait d’un flux
de liquide synovial issu d’une branche articulaire du nerf péro-
nier [5,7].
2.2.2. Compression isolée du nerf péronier profond
Il existe, rarement, une atteinte sélective du nerf péronier
profond. Ce type de lésion isolée est habituellement associé,
soit à l’existence d’un processus compressif local (processus
occupant ou conséquence d’une chirurgie arthroscopique du
genou), soit lié à une traction brutale du nerf par un trauma-
tisme du pied en inversion [9].
2.2.3. Compression isolée du nerf péronier superficiel
De manière encore plus rare, il existe un syndrome canalaire
du nerf péronier superficiel (1/69 patients pour Aprile et al.)
[2]. Celui-ci est lié à une compression du nerf péronier super-
ficiel dans le tunnel fibulaire [10–12].
2.3. Clinique
2.3.1. Atteinte du nerf péronier commun au col de la fibula
Il existe une nette prédominance masculine de cette atteinte
(sex-ratio 3/1). Le déficit moteur est au premier plan par rap-
port aux troubles sensitifs. La paralysie s’installe le plus sou-
vent de manière aiguë, juste après le facteur causal, mais peut
également s’installer sur un mode subaigu. Le début est plus
volontiers aigu lorsqu’il existe un facteur compressif extrin-
sèque ou après une chirurgie, alors qu’il est subaigu lorsque
l’atteinte est liée à une perte de poids ou à des microtraumatis-
mes répétés (position assise à genoux, croisement de jambes).
Il existe rarement une douleur associée du genou ou de la
jambe, qui est alors plutôt décrite comme une douleur sourde.
Àl’examen clinique, il existe une atteinte de la flexion dorsale
des orteils et du pied, avec un respect de la flexion plantaire et
de l’inversion du pied. L’atteinte motrice prédomine souvent
sur les muscles innervés par le nerf péronier profond, alors
qu’il existe une atteinte moins importante des muscles innervés
par le nerf péronier superficiel (muscles péroniers). L’examen
Fig. 1a. Trajet du nerf péronier et de ces branches au niveau de la jambe
(D’après Leguerrier et al., les nouveaux dossiers d’anatomie PCEM : membre
inférieur, éditions Heures de France, Thoiry, 1992).
Fig. 1b. Territoire sensitif du nerf péronier.
D. Uzenot et al. / Revue du Rhumatisme 74 (2007) 401–408402

de la sensibilité retrouve fréquemment une hypoesthésie de la
face dorsale du pied.
2.3.2. Atteinte isolée du nerf péronier profond
Ce tableau rare se distingue de l’atteinte du nerf péronier
commun par l’absence de déficit des muscles péroniers.
2.3.3. Atteinte isolée du nerf péronier superficiel
Cette atteinte est rare, et le plus souvent liée à une compres-
sion du nerf péronier superficiel dans le tunnel fibulaire. Elle
s’exprime par un syndrome douloureux dans le territoire sensi-
tif du nerf péronier superficiel avec un signe de Tinel positif
(en dessous du col de la fibula et à la face antéroexterne de la
jambe). La douleur peut être également déclenchée par la dor-
siflexion passive répétée du pied ou par une pression sur le
septum intermusculaire antérieur [10,11]. Il existe très rarement
un déficit moteur associé des muscles péroniers, mais il peut
exister une hypoesthésie dans le territoire sensitif du nerf péro-
nier superficiel au niveau de la face antéroexterne de jambe.
2.4. Explorations paracliniques
2.4.1. Électrophysiologie
L’examen électrophysiologique est un temps important dans
le diagnostic d’une atteinte du nerf péronier. Cet examen doit
comprendre, comme cela a été recommandé par l’AANEM
(American association of neuromuscular and electrodiagnostic
medicine), l’étude des vitesses de conduction nerveuses (VCN)
du péronier avec un recueil sur le muscle pédieux et/ou sur le
jambier antérieur, une étude sensitive du nerf sural et du nerf
péronier superficiel, ainsi que l’étude d’un nerf sensitif dans au
moins un autre territoire moteur et sensitif [13].L’étude des
VCN motrices du péronier va permettre de déterminer s’il
existe une atteinte axonale ou démyélinisante. Dans la majorité
des cas (50 %), il existe une atteinte axonale avec une diminu-
tion des amplitudes motrices. Dans 30 % des cas, un bloc de
conduction est mis en évidence au niveau du col de la fibula, et
dans les 20 % de cas restants, il existe une atteinte mixte axo-
nale et démyélinisante [3,4]. Le pronostic fonctionnel sera
d’autant meilleur qu’il existe un bloc de conduction sans dimi-
nution des amplitudes distales car celle-ci témoigne d’un pro-
cessus de dégénérescence axonale qui va nécessiter une
repousse axonale qui peut être lente et/ou incomplète. Les
patients ayant une atteinte mixte caractérisée à la fois par une
perte axonale et l’existence d’un bloc de conduction auront
souvent une récupération biphasique (récupération rapide ini-
tiale puis récupération plus lente liée à un processus secondaire
de réinnervation) [2].L’étude des VCN sensitives du péronier
va permettre de différencier une atteinte du nerf péronier com-
mun d’une atteinte du nerf péronier profond (potentiel préservé
dans ce cas). L’examen de détection permettra lui de préciser le
caractère isolé de l’atteinte du nerf péronier. L’étude d’autres
territoires nerveux peut montrer une atteinte plus diffuse témoi-
gnant d’une neuropathie surajoutée.
2.4.2. Échographie nerveuse
L’échographie nerveuse apparaît actuellement utile dans
l’exploration du nerf péronier, du fait de son trajet relativement
superficiel et permet en particulier de mettre en évidence un
kyste mucoïde endoneural [8].
2.4.3. Imagerie par résonance magnétique (IRM)
L’IRM permet notamment de mettre en évidence un kyste
mucoïde intraneural ou un kyste articulaire [5–7,14,15]. Cet
examen reste cependant coûteux et l’interprétation dépendante
de l’opérateur.
2.5. Diagnostic différentiel
En cas d’atteinte aiguë, l’existence de douleurs importantes
devra faire évoquer le diagnostic de vascularite nerveuse que
celle-ci soit isolée ou associée à une vascularite systémique
(Périartérite-noueuse [PAN] ou micropolyangiopathie de type
Churg et Strauss, la vascularite nerveuse dans la polyarthrite
rhumatoïde [PR] étant quant à elle exceptionnelle), et ce,
d’autant plus qu’il existe une atteinte débordant le territoire
strict du nerf péronier. Lorsque l’atteinte est d’apparition sub-
aiguë, il faudra, si l’atteinte est motrice pure, éliminer les diag-
nostics de sclérose latérale amyotrophique débutante ou de
neuropathie motrice multifocale avec blocs de conduction. De
manière rare, et d’autant plus que le patient a des antécédents
de syndromes canalaires multiples, il pourra être évoqué le
diagnostic de neuropathie héréditaire sensible à la pression
(HNPP) et en cas de doute et/ou d’éléments évocateurs à
l’examen électrophysiologique, il sera demandé une recherche
en biologie moléculaire de délétion dans le gène de la PMP22.
Une telle neuropathie a en effet été retrouvée chez trois de 30
patients ayant une atteinte du péronier apparue dans un
contexte de perte de poids [16,17]. La distinction avec une
radiculopathie paralysante L5 peut quelquefois se poser et
l’examen du muscle jambier postérieur peut être utile (innerva-
tion radiculaire L5 et tronculaire par le nerf tibial), de même
l’atteinte du muscle moyen fessier est informative (Atteinte lors
d’une radiculopathie L5, mais épargnée dans une atteinte du
nerf péronier).
2.6. Traitement
Dans la majorité des cas, le traitement consiste en une évic-
tion des facteurs favorisants, une rééducation fonctionnelle et
l’utilisation d’une orthèse en cas de steppage important. Il peut
également être mis en place une protection par un coussin au
niveau du col de la fibula. La chirurgie est discutée s’il n’existe
pas de signes de réinnervation après six mois [18,19]. Cette
intervention peut être efficace, même réalisée un an après le
début des troubles. L’imagerie par échographie ou IRM est
très utile en préopératoire, pour rechercher une étiologie com-
pressive ou un kyste intranerveux. La chirurgie consiste en une
neurolyse du nerf péronier, au besoin associée à une exérèse de
la cause de la compression. En cas de kyste articulaire, le kyste
est drainé, et lorsqu’il existe un kyste intranerveux, la branche
D. Uzenot et al. / Revue du Rhumatisme 74 (2007) 401–408 403

articulaire du nerf péronier est ligaturée [20]. En cas de syn-
drome du tunnel fibulaire du nerf péronier superficiel, il peut
être proposé une libération du tunnel fibulaire associée à une
fasciectomie partielle [10,11].
3. Compression du nerf tibial
3.1. Anatomie (Figs. 2a,2b)
Le nerf tibial (sciatique poplité interne) est issu de la divi-
sion du nerf sciatique (nerf grand sciatique) au niveau du creux
poplité en deux branches : le nerf tibial et le nerf péronier com-
mun. Le nerf tibial a un trajet superficiel au niveau du creux
poplité où il donne des branches pour les muscles gastrocné-
miens interne et externe (jumeaux interne et externe) et pour
les muscles soléaires, poplité et plantaire (m. plantaire grêle). À
la jambe, le nerf passe sous l’arcade du muscle soléaire, et
parcourt la jambe dans la profondeur de la loge postérieure, il
est alors appelé nerf tibial postérieur. À la cheville, le nerf
passe en arrière de la malléole interne pour pénétrer dans le
tunnel tarsien où il se divise en deux branches terminales, les
nerfs plantaires médial et latéral, après avoir émis le nerf cal-
canéen médial.
3.2. Étiologie
L’atteinte du nerf tibial est beaucoup moins fréquente que
celle du nerf péronier. Il existe une zone de fragilité du nerf
lors de la traversée du creux poplité, liée à son trajet superficiel
et à la proximité de structures vasculaires ; de plus il existe une
zone potentielle de compression du nerf lors de son passage
sous l’arcade du soléaire [21,22]. Ce syndrome canalaire est
très rare, et, dans la majorité des cas, l’atteinte du nerf tibial
est d’une autre nature (traumatique, ischémique, infiltration
néoplasique, kyste extra- ou intraneural, postchirurgie arthros-
copique du genou) [23].
3.3. Clinique
Nous ne parlerons que de la symptomatologie associée à
une compression du nerf tibial dans l’arcade du muscle
soléaire. Contrairement aux autres causes d’atteintes du nerf
tibial, il existe un syndrome douloureux prédominant et le défi-
cit sensitif et moteur est au second plan [21,22]. La douleur
prédomine au niveau du creux poplité et il est retrouvé à ce
niveau un signe de Tinel avec une douleur exquise à la palpa-
tion et à la percussion du nerf tibial. Le patient rapporte à
l’interrogatoire une aggravation de la douleur à la station
debout et lors de l’examen clinique, la douleur peut être exa-
cerbée par la dorsiflexion passive du pied. Il existe fréquem-
ment un déficit sensitif dans le territoire du nerf tibial, alors
qu’il n’est retrouvé un déficit moteur que chez 50 % des
patients.
3.4. Diagnostic différentiel
Lorsqu’il existe une douleur du creux poplité, le diagnostic
différentiel se fera essentiellement avec les autres causes de
syndrome douloureux du genou. Lorsque la douleur prédomine
au pied, il faudra la différencier de celle d’un syndrome du
canal tarsien.
3.6. Examens paracliniques
3.6.1. Électromyographie
L’électromyographie a peu d’intérêt dans le diagnostic posi-
tif d’une compression du nerf tibial à l’arcade du muscle
soléaire et est surtout informative en cas d’atteinte traumatique
ou compressive du nerf [24]. Mastaglia n’observait une dimi-
nution de l’amplitude du potentiel moteur de l’extenseur de
l’hallux après stimulation du nerf tibial ou du potentiel sensitif
du nerf plantaire latéral que pour 2/9 patients dans sa série.
Pour ces deux patients, il était associé à l’examen de détection
des signes discrets de dénervation dans les muscles court
abducteur de l’hallux et gastrocnémien interne [22].
Fig. 2a. Trajet du nerf tibial à la jambe (D’après Leguerrier et al., les nouveaux
dossiers d’anatomie PCEM : membre inférieur, éditions Heures de France,
Thoiry, 1992).
Fig. 2b. Territoire sensitif du nerf tibial.
D. Uzenot et al. / Revue du Rhumatisme 74 (2007) 401–408404

3.6.2. Imagerie
L’IRM permet de bien visualiser le nerf tibial au niveau du
creux poplité en séquence pondérée T1 et T2 [15]. Elle peut
permettre également de mettre en évidence des kystes endoneu-
raux [23].Iln’a pas été encore évalué dans la détection d’une
compression du nerf tibial dans l’arcade du soléaire.
3.7. Traitement
Le traitement chirurgical peut être indiqué en cas de com-
pression du tibial dans l’arcade du soléaire, il consiste en une
ouverture chirurgicale de l’arcade du soléaire. La chirurgie est
généralement très efficace, soit en postopératoire, immédiat,
soit de manière retardée [22]. Un traitement conservateur peut
être proposé, en particulier un repos strict lors de la phase dou-
loureuse peut être efficace sur la symptomatologie.
4. Syndrome du tunnel ou canal tarsien
Le syndrome du canal tarsien est un syndrome canalaire
fréquemment évoqué aux membres inférieurs, mais est en fait
relativement rare [9]. Sa définition doit être avant tout clinique,
tant les moyens d’investigations paracliniques comme l’élec-
trophysiologie ou l’imagerie en IRM peuvent avoir des faux
positifs.
4.1. Anatomie (Figs. 3a et 3b)
Le canal tarsien est un espace situé à la face postéro-interne
de la malléole interne. Il est recouvert par le rétinaculum des
fléchisseurs et son plancher osseux est constitué par le talus
(astragale), le naviculaire (scaphoïde), le calcanéus (calca-
néum) et la face interne du sustentaculum tali. Le canal tarsien
permet le passage du paquet vasculonerveux tibial postérieur
(artères et veines tibiales et nerf tibial postérieur), accompagné
des muscles tibiaux postérieurs et long fléchisseur des orteils.
Le nerf tibial postérieur se divise à son niveau, après avoir
émis sa dernière collatérale, le nerf calcanéen médial, en nerf
plantaire médial et latéral (séparés dans cet espace par un sep-
tum interfasciculaire). Le nerf calcanéen médial à un territoire
sensitif comprenant la partie médiale du pied et une partie du
talon. Les nerfs plantaires médial et latéral innervent respecti-
vement les deux tiers médiaux et le tiers latéral de la plante des
pieds.
4.2. Physiopathogénie
Le syndrome du canal tarsien peut être idiopathique par
compression des branches terminales du nerf tibial au travers
du canal tarsien. Cependant, il existe de nombreux facteurs
extrinsèques favorisant cette compression : déformation
osseuse (faisant suite à un traumatisme aigu (fractures dépla-
cées de l’extrémité distale du tibia, de l’os tarsal ou du calca-
néum) ou à des microtraumatismes répétés (coureur), processus
occupant au sein de cet espace (kyste mucoïde, kyste articu-
laire, ténosynovite, varicosités veineuses, épaississement du
septum fibreux) [25], ou compression des branches de termi-
naison dans l’aponévrose du muscle abducteur de l’hallux [26].
En cas de syndrome du canal tarsien « idiopathique », le dia-
bète et la polyarthrite rhumatoïde apparaissent comme des fac-
teurs favorisants.
4.3. Clinique
Le syndrome du canal tarsien est plus fréquent à l’âge
adulte chez le sujet féminin [9].L’atteinte clinique est caracté-
risée par l’apparition insidieuse d’un syndrome douloureux du
pied, le plus souvent de manière unilatérale. La douleur est
souvent décrite comme une sensation de « pied brûlant ».
Elle va prédominer aux deux tiers médiaux du pied en cas de
compression du nerf plantaire médial et au tiers latéral du pied
lors d’une compression du nerf plantaire latéral, avec une
épargne de la zone talonnière (absence d’atteinte du nerf cal-
Fig. 3a. Branches de division du nerf tibial et rapports anatomiques dans le
canal tarsien (D’après Katirji et Wilbourn, Mononeuropathies of the Lower
limb in Peripheral neuropathy, P.J. Dyck, 2005).
Fig. 3b. Territoire d’innervation sensitive de la plante du pied et des branches
du nerf tibial. NPL : nerf plantaire latéral, NPM : nerf plantaire latéral, NS : nerf
sural, NCM : nerf calcanéen médial.
D. Uzenot et al. / Revue du Rhumatisme 74 (2007) 401–408 405
 6
6
 7
7
 8
8
1
/
8
100%