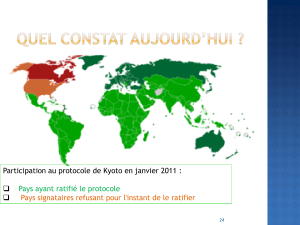
Lire l'article complet

Empreinte génomique
Genomic imprinting
A. Pàldi*
L’
empreinte génomique ou
parentale est un processus de
marquage épigénétique qui
permet aux cellules de l’organisme
de reconnaître l’origine paternelle
ou maternelle des allèles de certains
gènes possédant pourtant une
séquence nucléotidique identique.
Ce phénomène a été découvert au
début des années 1980 grâce à trois
types d’observation.
Les expériences de transfert de pro-
noyaux haploïdes entre les zygotes
fécondés ont révélé que les
embryons monoparentaux, possé-
dant donc deux génomes d’origine
maternelle (gynogénotes ou parthé-
notes) ou paternelle (androgénotes),
n’étaient pas viables. La présence
simultanée du génome paternel et
du génome maternel dans le même
zygote est nécessaire pour le déve-
loppement normal (1, 2). D’autre
part, les études de souris porteuses
de translocations chromosomiques
ont également permis de conclure
que les copies paternelle et mater-
nelle de certains chromosomes (mais
pas de tous) sont nécessaires au
développement (3). Enfin, un certain
nombre de pathologies humaines et
de malformations chez les souris
sont de préférence transmises par le
père ou par la mère (4). Afin d’ex-
pliquer ces observations inatten-
dues, une hypothèse a été avancée :
les allèles paternel et maternel de
certains gènes du génome ne s’ex-
priment pas de façon identique au
cours du développement. Cette dif-
férence serait la conséquence d’un
marquage épigénétique différent sur
les allèles transmis par le père et par
la mère. On appelle les gènes
concernés “soumis à l’empreinte”.
Depuis la découverte du premier
gène soumis à l’empreinte chez la
souris, l’Igf2r, l’expression mono-
allélique en fonction de l’origine
parentale est devenue le critère
absolu d’identification des gènes
soumis à l’empreinte. Un gène est
considéré comme soumis à l’em-
preinte si un seul allèle est exprimé,
l’autre restant silencieux. La nature
active ou passive de l’allèle dépend
de son origine parentale. Cette défi-
nition est généralement acceptée et
utilisée. Néanmoins, nous savons
maintenant que la situation réelle
est plus complexe. L’analyse d’un
grand nombre de gènes soumis à
l’empreinte a révélé que la plupart
d’entre eux s’expriment de façon
bi-allélique au moins dans un tissu
et/ou à un stade du développement.
Il y a même des gènes qui ne s’ex-
priment de façon mono-allélique
que dans un seul tissu, l’expression
étant bi-allélique dans tous les autres.
Nous sommes donc confrontés à
une situation paradoxale où il est
très difficile de prouver qu’un gène
n’est pas soumis à l’empreinte. En
effet, il serait nécessaire d’analyser
l’expression allélique d’un gène
dans tous les tissus et à tous les
stades du développement, car c’est
seulement si l’expression bi-allé-
lique est détectée partout qu’il est
possible de conclure que le gène
concerné n’est pas soumis à l’em-
preinte. Pour des raisons évidentes,
cette approche est impossible à réa-
liser. C’est probablement l’ambi-
guïté de la définition qui rend l’es-
timation du nombre de gènes
soumis à l’empreinte si difficile.
Sur la base de la rareté relative
des mutations dont le phénotype est
différent selon leur origine pater-
nelle ou maternelle, le nombre de
gènes soumis à l’empreinte a été
estimé autour de 300. Mais des
études systématiques de l’expres-
sion allélique de 20 000 gènes chez
la souris ont suggéré que, pour plus
de 10 % d’entre eux, l’expression
d’un allèle parental est au moins
dix fois plus forte que celle de
l’autre (5).
Afin de mieux apréhender le phéno-
mène de l’empreinte parentale, les
recherches se sont centrées sur les
questions suivantes :
●Comment l’empreinte est-elle
posée sur les allèles de gènes sans
en changer la séquence nucléoti-
dique ? En effet, le marquage doit
être suffisamment stable pour être
transmis au cours des divisions
mitotiques, mais il doit être réver-
sible au cours de la méiose. Les
mécanismes moléculaires épigéné-
tiques, comme la méthylation de
l’ADN ou les modifications des his-
tones, sont des candidats naturels
pour jouer ce rôle.
* École pratique des hautes études, Généthon,
Évry.
6
Métabolismes Hormones Diabètes et Nutrition (X), n° 1, janvier/février 2006
et maladie endocrinienne
Empreinte génomique parentale
Mots-clés : Empreinte génomique parentale - Expression mono-
allélique - Différence de méthylation - Réplication asynchrone.
Keywords: Genomic imprinting - Mono-allelic expression - Difference of
methylation - Asynchronous replication.

Métabolismes Hormones Diabètes et Nutrition (X), n° 1, janvier/février 2006
●À quel moment les gènes concernés
acquièrent-ils leur empreinte ?
●Quel est le rôle biologique du
phénomène de l’empreinte ?
Les premiers gènes soumis à l’em-
preinte ont été découverts en 1991 :
il s’agissait du gène qui code pour
un facteur de croissance, l’Igf2 et,
curieusement, du gène codant pour
son récepteur, l’Igf2r (6, 7). Depuis,
une centaine de gènes ont été décrits
comme étant soumis à l’empreinte
(voir la liste des gènes et des réfé-
rences bibliographiques : www.mgu.
har.mrc.ac.uk/research/imprinting/
imprinting2.html).
Il y a une bonne conservation de
l’empreinte parmi les mammifères.
Si un gène est soumis à l’empreinte
chez la souris, il y a de bonnes
chances pour que son homologue
chez l’homme ou chez un autre
mammifère le soit également. La
conservation au cours de l’évolution
suggère qu’il s’agit d’une caracté-
ristique sélectionnée.
Il est intéressant de souligner que
les protéines codées par les gènes
soumis à l’empreinte ne possèdent
pas de fonction biochimique com-
mune (8). Elles incluent facteurs de
transcription, enzymes métabo-
liques, récepteurs membranaires,
hormones, protéines de l’épissage
des ARN, etc. Il y a même des
gènes qui codent pour des ARN non
codants. La fonction biologique de
l’empreinte ne peut donc pas être
attribuée à un certain type d’activité
biologique.
Malgré l’identification d’un nombre
croissant de gènes soumis à l’em-
preinte, seuls quelques-uns ont été
analysés en détail. En sus de l’ex-
pression mono-allélique, ces gènes
partagent un certain nombre de
caractéristiques. On trouve souvent
à leur proximité des séquences
régulatrices qui portent une méthy-
lation de cytosines différentes sur
les allèles paternel et maternel. La
méthylation allèle-spécifique a
même été utilisée comme critère
d’identification de nouveaux gènes
soumis à l’empreinte. Les régions
possédant une méthylation différen-
tielle sur les deux allèles portent le
nom de “régions méthylées diffé-
remment” (DMR). Les DMR les
mieux caractérisées sont celles des
gènes H19,Igf2,Igf2r,Snrpn,Gnas
et Gtl2. L’importance fonctionnelle
de ces régions pour l’expression
mono-allélique a été démontrée par
de nombreuses études de mutage-
nèse dirigée. Néanmoins, tous les
gènes soumis à l’empreinte ne se
caractérisent pas par des régions
régulatrices différemment méthy-
lées sur les deux allèles. D’autre
part, la même région régulatrice,
différemment méthylée sur les deux
chromosomes, peut réguler l’ex-
pression de plusieurs gènes. En fait,
les gènes soumis à l’empreinte ne
sont pas distribués de façon aléa-
toire dans le génome. Ils sont le plus
souvent groupés dans des régions
génomiques bien distinctes, dont la
taille varie de quelques centaines de
kilobases à 2 ou 3 mégabases. Ces
régions contiennent à la fois des
gènes d’expression paternelle et
maternelle, mais également des
gènes d’expression bi-allélique.
Toutefois, ainsi qu’il l’a été men-
tionné précédemment, l’expression
mono-allélique peut être limitée
dans le temps et/ou l’espace. Il est
donc impossible d’être certain que
ces gènes d’expression bi-allélique
le sont en permanence !
La caractéristique la plus impor-
tante des régions génomiques qui
contiennent des gènes soumis à
l’empreinte est leur réplication
asynchrone dans toutes les cellules
somatiques de l’organisme (9, 10).
Les deux copies de la plupart des
régions du génome se répliquent à
peu près en même temps pendant la
phase S du cycle cellulaire. Ce
n’est pas vrai pour les régions
génomiques qui contiennent les
gènes soumis à l’empreinte, car la
région chromosomique d’origine
paternelle se réplique avant son
homologue maternel. Cette caracté-
ristique est observée dans tous les
types cellulaires et indépendam-
ment de l’expression des gènes de
la région. Elle concerne toutes les
séquences de la région, y compris
les séquences intergéniques et non
codantes, ou même les gènes dont
l’expression est habituellement bi-
allélique. De plus, la réplication
asynchrone est la seule caractéris-
tique des régions soumises à l’em-
preinte qui apparaît très vite après
la fécondation et disparaît dans la
lignée germinale juste avant l’en-
trée des cellules en méiose. En
effet, ni la méthylation des dinu-
cléotides CpG, ni l’expression
mono-allélique ne sont une caracté-
ristique permanente des gènes ou
des régions génomiques soumis à
l’empreinte parentale. Il n’y a que
la réplication asynchrone qui soit
observée en permanence dans les
cellules somatiques. Néanmoins,
l’importance de cette caractéris-
tique est largement sous-estimée
dans la littérature, probablement
parce qu’il s’agit d’une différence
fonctionnelle entre deux régions
homologues. Comme pour l’ex-
pression mono-allélique, il semble
plausible qu’il s’agisse d’une
conséquence de l’empreinte plutôt
que d’une cause.
L’interprétation des autres caracté-
ristiques des gènes soumis à l’em-
preinte, comme la méthylation, se
heurte à la même difficulté. S’agit-
il d’une cause ou d’une consé-
quence ? C’est dans cette optique
qu’il convient d’examiner les
mécanismes moléculaires du pro-
cessus de l’empreinte. En plus de
l’existence de la méthylation diffé-
rentielle des DMR, l’examen des
régions soumises à l’empreinte a
révélé des différences pour
d’autres types de modifications
épigénétiques, comme celles des
histones. Ces différences peuvent
conduire à un recrutement diffé-
rentiel des protéines régulatrices
(comme la protéine CTCF) et,
ainsi, à l’établissement d’une struc-
ture chromatinienne particulière
des domaines chromosomiques
paternels et maternels et à un envi-
ronnement nucléaire spécifique
à chacun d’eux (11). Toute diffé-
rence structurale entre les copies
7
Empreinte génomique parentale
et maladie endocrinienne

Métabolismes Hormones Diabètes et Nutrition (X), n° 1, janvier/février 2006
maternelles et paternelles des
régions soumises à l’empreinte
peut être considérée comme un
“mécanisme”, c’est-à-dire un
enchaînement d’événements molé-
culaires conduisant au fonctionne-
ment différent des gènes parentaux
de la région concernée. Il est néan-
moins tout à fait possible que les
différences de structure soient la
conséquence d’un fonctionnement
différent.
C’est pour surmonter cette difficulté
que beaucoup d’efforts se sont
concentrés sur l’étude de la chrono-
logie de l’établissement de l’em-
preinte au cours du développement
et, plus particulièrement, dans la
lignée germinale mâle et femelle.
En effet, c’est seulement dans les
cellules germinales que les allèles
des deux parents sont présents sépa-
rément. Il est donc logique de pen-
ser que la lignée germinale est le
site “idéal” pour l’établissement de
toute différence épigénétique entre
les chromosomes parentaux et qu’il
devrait y être possible d’identifier
les premières marques de l’em-
preinte. Malheureusement, la grande
variabilité du processus entre les
différents gènes et régions n’a pas
permis de révéler l’étape critique de
l’établissement de l’empreinte. Au
contraire, il semble qu’il s’agisse
d’un processus continu tout au long
du développement et qu’il soit
impossible de déterminer quel type
de différence entre les homologues
parentaux est apparu avant les
autres (12).
L’autre grande question, encore
ouverte, est celle de la fonction bio-
logique de l’empreinte parentale. La
plupart des scientifiques de ce
domaine s’accordent pour penser
que l’empreinte est propre aux
mammifères. Cet avis est basé sur le
fait qu’on peut observer la réplica-
tion parthénogénétique dans tous les
autres groupes taxonomiques, et
que la nécessité de disposer d’un
génome paternel et maternel n’est
observée que chez les mammifères.
Néanmoins, il n’y a pas de preuve
formelle que l’empreinte soit
absente chez les autres vertébrés ou
invertébrés. Au contraire, des obser-
vations suggèrent qu’un fonctionne-
ment différentiel des deux allèles
parentaux serait présent chez la dro-
sophile. Récemment, une étude a
démontré que, chez les oiseaux, les
régions homologues à celles sou-
mises à l’empreinte chez les mam-
mifères ont aussi une réplication
asynchrone.
Ainsi que mentionné précédem-
ment, la conservation de l’em-
preinte au fil de l’évolution suggère
qu’il s’agit d’un phénomène sélec-
tionné au cours de ce processus.
Mais quelle est la fonction qui pro-
cure un avantage sélectif ? En
adoptant une expression mono-allé-
lique qui n’est rien d’autre qu’une
haploïdie fonctionnelle, les mam-
mifères semblent renoncer à l’avan-
tage de posséder deux copies du
même gène. N’importe quelle
mutation de l’allèle exprimé peut
être immédiatement sanctionnée
par la sélection, suggérant qu’il
pourrait exister un mécanisme com-
pensateur de cet inconvénient ! Une
bonne douzaine d’hypothèses ont
été émises. La plupart d’entre elles
cherchent à expliquer le rôle de
l’empreinte par l’expression mono-
allélique des gènes concernés (13-
15). Le modèle théorique le plus
connu est basé sur le “conflit évo-
lutionniste entre le père et la mère”
(16). Les deux parents n’ont pas le
même investissement dans la pro-
duction de la descendance, car
seule la mère porte ses descendants
in utero. L’investissement des
femelles apparaît donc plus grand.
Selon ce modèle, cette répartition
des rôles conduit à une asymétrie
de la régulation du niveau d’ex-
pression de certains gènes à l’aide
d’un marquage épigénétique. Ce
modèle attribue comme les autres
un rôle primordial, d’une part, aux
transcrits dans le fonctionnement
des gènes et, d’autre part, aux gènes
soumis à l’empreinte dans le déve-
loppement du fœtus. Ces deux
hypothèses restent à confirmer (17).
La difficulté majeure est donc de
faire le lien entre l’expression
mono-allélique et l’avantage sélec-
tif, ce qui représente un exercice
très difficile. D’autres hypothèses
proposent que la différence de
structure des deux homologues
pourrait jouer un rôle avantageux
indépendamment de l’expression
des gènes de la région (14, 15).
L’expression mono-allélique serait,
dans ce cas, un épiphénomène. Une
différence structurale des deux
régions chromosomiques homo-
logues pourrait s’avérer nécessaire
pour l’interaction entre les paires
chromosomiques et faciliter le
processus de ségrégation correct
des chromosomes au cours des
divisions mitotiques. En revanche,
l’effacement de l’empreinte facilite
la recombinaison entre les homo-
logues au cours de la méiose. Il est
intéressant de noter que les régions
soumises à l’empreinte sont carac-
térisées par une différence de fré-
quence des recombinaisons au
cours de la méiose mâle et femelle.
De plus, la réplication asynchrone
de ces régions dans les cellules
mitotiques est la seule caracté-
ristique vraiment conservée entre
les espèces de mammifères, mais
aussi entre les mammifères et les
oiseaux (18).
Quelle que soit la véritable fonction
de l’empreinte, il est évident que
tout dysfonctionnement de ce pro-
cessus a une influence sur l’expres-
sion des gènes concernés et repré-
sente une source de pathologie
héréditaire chez l’homme. En effet,
les défauts d’établissement de l’em-
preinte dans la lignée germinale, ou
le défaut de compensation d’une
mutation de l’allèle actif par l’allèle
inactif, conduit parfois à des mala-
dies extrêmement graves, comme
les syndromes de Prader-Willi,
d’Angelman, de Beckwith-Wiede-
mann, etc. Au-delà de son intérêt
purement scientifique, la compré-
hension du processus de l’empreinte
parentale représente un enjeu
majeur pour l’élaboration de straté-
gies thérapeutiques face à ces
pathologies. ■
8
et maladie endocrinienne
Empreinte génomique parentale

Métabolismes Hormones Diabètes et Nutrition (X), n° 1, janvier/février 2006
9
Empreinte génomique parentale
et maladie endocrinienne
Références
1.
McGrath J, Solter D. Completion of mouse
embryogenesis requires both the maternal and
paternal genomes. Cell 1984;37:179-83.
2.
Surani M, Barton S et al. Development of
reconstituted mouse eggs suggests imprinting of
the genome during gametogenesis. Nature 1984;
308:548-50.
3.
Cattanach BM, Kirk M. Differential activity of
maternally and paternally derived chromosome
regions in mice. Nature 1985;315:496-8.
4.
Johnson DR. Hairpin-tail: a case of post-
reductional gene action in the mouse egg. Gene-
tics 1974;76:795-805.
5.
Nikaido I, Saito C et al. Discovery of imprinted
transcripts in the mouse transcriptome using
large-scale expression profiling. Genome Res
2003;13:1402-9.
6.
Barlow D, Stöger R et al. The mouse insulin-
like growth factor type-2 receptor is imprinted and
closely linked to the Tme locus. Nature 1991;
349:84-7.
7.
DeChiara T, Robertson E et al. Parental
imprinting of the mouse insulin-like growth factor
II gene. Cell 1991;64:849-59.
8.
Paldi A. Genomic imprinting: could the chro-
matin structure be the driving force? Curr Top
Develop Biol 2003;53:115-38.
9.
Kitsberg D, Selig S et al. Allele-specific repli-
cation timing of imprinted gene regions. Nature
1993;364:459-63.
10.
Knoll J, Cheng S et al. Allele specificity
of DNA replication timing in the Angelman/
Prader-Willi syndrome imprinted chromosomal
region. Nat Genet 1994;6:41-6.
11.
Kanduri C, Pant V et al. Functional inter-
action of CTCF with the insulator upstream
of the H19 gene is parent of origin-specific and
methylation-sensitive. Curr Biol 2000;10:
853-6.
12.
El-Maarri O, Buiting K et al. Maternal
methylation imprints on human chromosome 15
are established during or after fertilization. Nat
Genet 2001;27:341-4.
13.
Moore T, Haig D. Genomic imprinting in
mammalian development: a parental tug-of-war.
Trends Genet 1991;7:45-9.
14.
Paldi A, Jouvenot Y. Allelic trans-sensing and
imprinting. Results Probl Cell Differ
1999;25:271-82.
15.
Pardo-Manuel DVF, Casa-Esperon EDL et al.
Natural selection and the function of genome
imprinting: beyond the silenced minority. Trends
Genet 2000;16:573-9.
16.
Haig D, Graham C. Genomic imprinting and
the strange case of the insulin-like growth factor
II receptor. Cell 1991;64:1045-6.
17.
Hurst L, McVean G. Growth effects of unipa-
rental disomies and the conflict theory of genomic
imprinting. Trends Genet 1997;13:436-42.
18.
Dünzinger U, Nada I et al. Chicken ortho-
logues of mammalian imprinted genes are cluste-
red on macrochromosomes and replicate asyn-
chronously. Trends Genet 2005;21:488-92.
Le syndrome de Prader-Willi
The Prader-Willi syndrome
M.Tauber*, G. Diene*, M. Glattard*, E. Bieth**
▲
▲Le syndrome de Prader-Willi (SPW) est une maladie génétique rare (incidence de 1/26 000 naissances).
▲
▲C’est la principale cause d’obésité syndromique.
▲
▲Le diagnostic est clinique et confirmé par la génétique.
▲
▲Le diagnostic peut et doit être fait en période néonatale devant toute hypotonie inexpliquée.
▲
▲À un âge plus tardif, les enfants présentent un retard statural associé à une obésité, liés à une atteinte hypo-
thalamique.
▲
▲La prise en charge multidisciplinaire associée au traitement par hormone de croissance permet un dévelop-
pement staturopondéral optimal.
▲
▲Des efforts doivent être faits pour améliorer la prise en charge psychiatrique et les troubles de l’apprentissage.
▲
▲C’est le modèle de la maladie liée à l’empreinte génomique parentale.
▲
▲Les patients adultes sont souvent perdus de vue et très mal pris en charge.
▲
▲Il existe un centre de référence SPW labellisé en 2004.
Mots-clés : Maladie rare - Syndrome de Prader-Willi - Empreinte génomique - Obésité.
Keywords: Rare disease - Prader-Willi syndrome - Genomic imprinting - Obesity.
points FORTS
Centre de référence du syndrome de Prader-Willi, * Hôpital des enfants et** Service de génétique, CHU de Toulouse.
1
/
4
100%