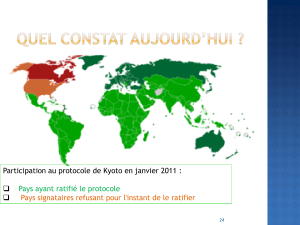
4. Il y a environ 180 millions d`années, l`empreinte génomique

© POUR LA SCIENCE -N° 362 DÉCEMBRE 2007
64
Une modification de l’environnement lors des premiers
stades du développement de l’organisme peut aussi per-
turber le contrôle de l’empreinte, ce qui engendre des mala-
dies chroniques à l’âge adulte. Par exemple, le syndrome
de Wiedemann-Beckwith, qui se caractérise par une crois-
sance excessive des organes (voir l’encadré page 63), peut
être dû à des mutations dans n’importe lequel des gènes
soumis à l’empreinte du bras court du chromosome 11.
Mais le même syndrome peut aussi résulter de change-
ments épigénétiques, telle une méthylation aberrante d’une
région de contrôle de l’empreinte, bien que la séquence
d’
ADN
elle-même soit inchangée.
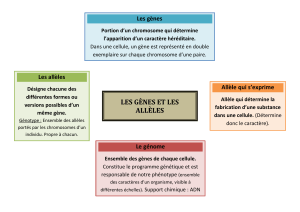
Les maladies de l’empreinte
Dans un autre exemple de maladie liée à des gènes sou-
mis à l’empreinte, la même mutation peut engendrer soit
le syndrome de Prader-Willi, soit le syndrome d’Angel-
man, deux maladies graves, mais très différentes, selon
que le gène modifié provient du père ou de la mère. Une
mutation paternelle dans un gène spécifique d’une région
soumise à l’empreinte du chromosome 15 conduit au
syndrome de Prader-Willi. Les mutations du même gène
maternel lèvent l’empreinte d’un gène voisin et causent
alors le syndrome d’Angelman. Malheureusement, il appa-
raît que l’incidence des troubles du développement liés à
des gènes soumis à l’empreinte est plus élevée chez les
enfants conçus par fécondation in vitro, ce qui laisse pen-
ser qu’il est très délicat de maintenir les empreintes géno-
miques pendant la fusion des cellules reproductrices et
les toutes premières divisions cellulaires.
Des gènes soumis à l’empreinte interviennent aussi dans
la genèse du cancer (voir la figure 1). Le généticien Alfred
Knudson a émis l’hypothèse que, dans la mesure où la plu-
part des gènes régulant le cancer sont toujours efficaces même
quand l’une des copies est inactivée, le passage d’un phé-
notype normal à un phénotype cancéreux nécessite deux
mutations ou atteintes – une sur chaque allèle – d’un gène
contrôlant le cancer. Une mutation sur l’un des allèles inac-
tiverait cet allèle, une empreinte inactiverait l’autre.
De fait, une activité aberrante de gènes soumis à l’em-
preinte est liée à toute une série de cancers. Qui plus est,
pour de nombreux patients atteints du syndrome de Wie-
demann-Beckwith, une méthylation anormale de certains
gènes du chromosome 11 engendre des cancers chez l’en-
fant. Par ailleurs, plusieurs cancers de l’adulte, notam-
ment le carcinome colorectal, le cancer de la vessie, les
cancers de l’ovaire et du sein, sont liés à une surproduc-
tion d’
IGF
2 en raison de la perte de l’empreinte parentale.
Des traits comportementaux complexes seraient aussi dus
au phénomène de l’empreinte. Prenons l’exemple des filles
qui présentent un syndrome de Turner, à savoir qu’elles n’ont
qu’un seul chromosome
X
provenant soit de leur mère, soit
de leur père. Selon l’origine de leur chromosome
X
, elles ont
des comportements différents. Ainsi, il existerait sur le chro-
mosome
X
un ou plusieurs gènes activés par un élément pater-
nel, ces gènes régulant des traits de la personnalité.
Des effets causés par l’un ou l’autre des parents s’obser-
vent aussi dans d’autres pathologies, notamment l’autisme,
la maladie d’Alzheimer, le trouble bipolaire et la schizophrénie.
Ces troubles résulteraient en partie d’erreurs d’empreinte lors
du développement précoce du cerveau. Mais on ignore encore
quels gènes soumis à l’empreinte seraient impliqués.
Les gènes soumis à l’empreinte sont-ils ou non béné-
fiques pour l’évolution des espèces ? La question reste
ouverte et le restera tant que l’on n’aura pas identifié ce
sous-ensemble de gènes chez l’homme. Pour ce faire, nous
appliquons désormais au génome humain les mêmes algo-
rithmes que ceux que nous avons développés pour trou-
ver des gènes soumis à l’empreinte chez la souris. Nous
espérons ainsi préciser les composantes génétiques et épi-
génétiques d’autres maladies.
Nous remercions la revue American Scientist de nous avoir autorisés
à publier cet article.
Randy JIRTLE est professeur d’oncologie et directeur de labora-
toire au Département d’oncologie de l’Université Duke, en Caroline
du Nord. Jennifer WEIDMAN est chercheur-clinicien dans le com-
plexe Research Triangle Park, en Caroline du Nord.
J. W
EIDMAN
et al., Cancer susceptibility : epigenetic manifestation of
environmental exposures, in Cancer Journal, vol. 13, pp. 9-16, 2007.
C. B
ADCOCK
et B. C
RESPI
, Imbalanced genomic imprinting in brain
development : an evolutionary basis for the ætiology of autism, in
Journal of Evolutionary Biology, vol. 19, pp. 1007-1032, 2006.
C. G
ICQUEL
et al., Epimutation of the telomeric imprinting center
region on chromosome 11p15 in Silver-Russell syndrome, in Nature
Genetics, vol. 37, pp. 1003-1007, 2005.
Génome humain et médecine, Dossier Pour la Science, n° 46, jan-
vier/mars 2005.
Auteurs &Bibliographie
Empreinte
Pas d’empreinte
Oiseaux Monotrèmes Marsupiaux Rongeurs Primates
180 millions d’années
opossum Souris
Poulet Cheval
Oiseaux Mammifères
Naît vivant
Développement dans l’œuf
Métathériens Euthérien
Prothériens
Aviens
Ornithorynque
Opossum Homme
Ongulés
4. Il y a environ 180 millions d’années, l’empreinte génomique
et la viviparité ont coévolué chez les mammifères primitifs. Les monotrèmes
ovipares, tel l’ornithorynque, forment le plus ancien groupe de mammifères :
ils n’ont pas de gènes soumis à l’empreinte. Les premiers exemples d’em-
preinte sont apparus chez un ancêtre commun, aujourd’hui éteint, des
marsupiaux et des mammifères placentaires (ou euthériens).
© Shutterstock/American Scientist
weidman.xp_bsl_08_11 9/11/07 17:20 Page 64
1
/
1
100%