S t r a t é g i e ...

Stratégie thérapeutique
Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume III, n° 1, mars 1999
apparition du CSPI dans le diagnos-
tic diffŽrentiel des hypercortiso-
lismes ACTH-dŽpendants date de la fin des
annŽes 80 (rŽfŽrences fran•aises), (1, 2).
Son principe est de pratiquer des prŽl•ve-
ments sanguins tr•s proches du drainage
veineux hypophysaire, ˆ lÕŽtat basal et sous
CRH, pour comparer les concentrations
dÕACTH ˆ celles obtenues sur des prŽl•ve-
ments veineux pŽriphŽriques simultanŽs.
LÕexis-tence dÕun gradient dÕACTH > 2
(basal) ou > 3 (sous CRH) entre les sinus
pŽtreux et la pŽriphŽrie signe lÕorigine
hypophy-saire de la sŽcrŽtion dÕACTH.
LÕabsence de gradient observŽe lors des
sŽcrŽtions ectopiques dÕACTH traduit le
freinage des cellules corticotropes nor-
males par lÕhypercortisolisme. En 1991, le
NIH (3) rapportait une Žtude de 220
patients ŽtudiŽs par CSPI avec injection de
CRH : en utilisant les valeurs seuils citŽes
plus haut, lÕexamen distinguait 203 mala-
Indications du cathétérisme bilatéral
des sinus pétreux inférieurs (CSPI)
dans l’exploration des syndromes de Cushing
ACTH-dépendants
O. Chabre*, V. Lefournier**, M. Martinie*, P. Bessou**, A. Vasdev**, F. Labat-Moleur***, J.-G. Passagia****, I. Bachelot*
39
* Service d’endocrinologie, ** de neuroradiologie, ***de pathologie cellulaire,
*** de neurochirurgie, CHU, Grenoble.
✎
La mise en évidence par le CSPI
d’un gradient d’ACTH hypophyse/
périphérie > 2 (basal), ou > 3 (sous
CRH), affirme l’origine hypophy-
saire d’un syndrome de Cushing
ACTH-dépendant avec une spécifi-
cité et une sensibilité qui approchent
100 %. Les performances du CSPI
restent supérieures à celles des tests
dynamiques ou de l’IRM hypophy-
saire, pratiqués seuls ou associés.
Il est impératif d’avoir démontré
au préalable la réalité de l’hyper-
cortisolisme, et de vérifier sa perma-
nence juste avant la procédure.
✎
Par contre, le gradient inter-
sinus offre une prédiction insuffi-
sante de la localisation du micro-
adénome corticotrope. Si un micro-
adénome corticotrope n’est pas
retrouvé à l’exploration chirurgi-
cale, l’hypophysectomie partielle
guidée par ce gradient latéral reste
hasardeuse.
✎
Le CSPI est difficile et coûteux.
Les complications sont exception-
nelles mais parfois graves : acci-
dents vasculaires du tronc cérébral
(0,2 %), embolie pulmonaire (un
seul cas rapporté).
✎
Les indications du CSPI sont :
– une IRM normale ou douteuse,
quels que soient les résultats des
tests dynamiques (TD) ;
– une IRM hypophysaire en faveur
d’un adénome malgré des TD non
typiques d’une maladie de Cushing.
Dans ces deux indications il est
logique de pratiquer une tomodensi-
tométrie (TDM) thoraco-abdominale
avant le CSPI, car celui-ci ne sera pas
réalisé si la TDM met en évidence une
tumeur extrahypophysaire acces-
sible à la ponction, ou justifiant une
exérèse chirurgicale.
✎
Le CSPI s’inscrit dans une
logique de traitement hypophysaire
de la maladie de Cushing. Sa réa-
lisation suppose que le patient soit
ensuite confié à une équipe neuro-
chirurgicale prête à rechercher des
microadénomes corticotropes de
très petite taille, de localisation
incertaine, mais dont l’existence ne
fait pas de doute.
L’

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume III, n° 1, mars 1999
dies de Cushing et 17 syndromes paranŽo-
plasiques avec une sensibilitŽ et une spŽci-
ficitŽ ŽvaluŽe ˆ 100 %. Les complications
majeures Žtaient inexistantes. On aurait
donc pu imaginer que le CSPI devienne de
pratique ÒcouranteÓ. Or, en 1998, en
France, son utilisation rŽguli•re reste limi-
tŽe ˆ certains centres. Il est donc justifiŽ de
discuter quelles sont actuellement les indi-
cations du CSPI.
Rappels
Environ 80 % des syndromes de Cushing
ACTH-dŽpendants ont une origine hypo-
physaire : adŽnome corticotrope (maladie
de Cushing). Les 20 % restant sont dus ˆ
des sŽcrŽtions ectopiques, paranŽopla-
siques, dÕACTH par des tumeurs neuro-
endocrines qui se rŽpartissent dans les
localisations suivantes : bronches (50 %),
thymus, pancrŽas, thyro•de (carcinome
mŽdullaire), mŽdullo-surrŽnale (phŽochro-
mocytome), ou autre. Exceptionnellement,
des tumeurs peuvent sŽcrŽter de lÕACTH et
du CRH, voire du CRH seul. Les cancers
anaplasiques ˆ petites cellules du poumon
sont une cause frŽquente dÕhypercortiso-
lisme ACTH-dŽpendant ectopique, mais ce
cancer, rapidement Žvolutif, ne pose pas de
probl•me de diagnostic diffŽrentiel (4).
LÕexploration des syndromes de Cushing
ACTH-dŽpendants suit quatre grandes
Žtapes :
Ð affirmation de lÕhypercortisolisme ;
Ð dŽmonstration de son caract•re ACTH-
dŽpendant ;
Ð dŽtermination de lÕorigine hypophysaire
ou extrahypophysaire de lÕACTH ;
Ð localisation prŽcise de lÕadŽnome hypo-
physaire corticotrope ou de la tumeur
extrahypophysaire (figure 1).
LÕhypercortisolisme est suspectŽ sur des
signes cliniques, son affirmation repose
sur lÕŽlŽvation du cortisol libre urinaire,
la perte du cycle nycthŽmŽral du cortisol,
le freinage insuffisant de la sŽcrŽtion de
cortisol sous 2 mg de dexamŽthasone (5).
Dans les hypercortisolismes modŽrŽs, le
diagnostic diffŽrentiel avec les Òpseudo-
hypercortisolismesÓ liŽs ˆ la dŽpression
peut •tre difficile : les tests utiles sont le
cortisol plasmatique ˆ minuit et le test au
CRH pratiquŽ en fin de freinage avec 2 mg
de dexamŽthasone (6).
Pour affirmer le caract•re ACTH-dŽpen-
dant dÕun hypercortisolisme dŽmontrŽ, il
suffit que lÕACTH, dosŽe par mŽthode
immuno-radiomŽtrique, soit retrouvŽe Žle-
vŽe ou Ò normale Ò (cÕest-ˆ-dire ˆ un taux
inappropriŽ ˆ lÕhypercortisolisme), sur
deux prŽl•vements indŽpendants. Les diffi-
cultŽs rencontrŽes dans le diagnostic topo-
graphique prŽcis (Žtapes 3 et 4) peuvent
•tre sŽrieuses. Cela tient ˆ plusieurs rai-
sons : les microadŽnomes corticotropes et
les tumeurs extrahypophysaires sŽcrŽtant
de lÕACTH peuvent avoir des rŽponses voi-
sines aux tests dynamiques, une maturation
identique de la POMC (7), et une taille suf-
fisamment petite pour mettre en dŽfaut la
sensibilitŽ et surtout la spŽcificitŽ des ima-
geries les plus modernes (8). Le CSPI a sa
place dans lÕŽtape 3, o• il peut •tre irrem-
pla•able, et ˆ un moindre degrŽ dans lÕŽta-
pe 4. Il nÕa aucune place dans lÕaffirmation
de lÕhypercortisolisme (9). Il est par
ailleurs impŽratif de vŽrifier la permanence
de cet hypercortisolisme juste avant la rŽa-
lisation de lÕexamen (figure 1).
Réalisation du CSPI
La permanence de lÕhypercortisolisme est
vŽrifiŽe sur un cortisol urinaire vespŽral
(20 h-24 h) aussi proche que possible de
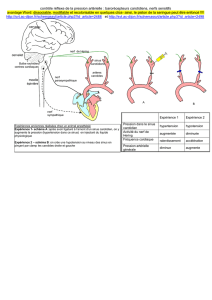
lÕexamen. Le cathŽtŽrisme utilise un abord
veineux fŽmoral bilatŽral : mise en place
dÕun introducteur ˆ valve, puis dÕune sonde
porteuse 6 F placŽe sous le golfe de la
jugulaire interne. Un
microcathŽter (dia-
m•tre externe terminal
3,6 F = 1,2 mm) est
introduit dans la sonde
porteuse pour •tre
remontŽ jusquÕau
sinus pŽtreux. La
bonne position de ce
microcathŽter est
dŽmontrŽe par injec-
tion ˆ basse pression
de produit de contraste
qui doit opacifier les
sinus pŽtreux et caver-
neux homolatŽraux,
les anastomoses inter-
sinusiennes et les sinus
caverneux et pŽtreux
controlatŽraux. Lors-
que les deux micro-
cathŽters sont en
place, des prŽl•ve-
ments sanguins pour
dosage de lÕACTH
sont effectuŽs de fa•on
simultanŽe en trois
sites : sinus pŽtreux G,
Stratégie thérapeutique
40
1
2
3
4
hypercortisolisme
signes cliniques
extrahypophysairehypophysaire
ACTH-indépendantACTH-dépendant
adénome
corticotrope tumeur
neuro-endocrine
CSPI
Figure 1. Apports du CSPI dans les diffŽrentes Žtapes diagnostiques des hyper-
cortisolismes ACTH-dŽpendants.
Le CSPI est l’examen de référence pour la détermination de l’origine
hypophysaire ou extrahypophysaire d’un hypercortisolisme ACTH-
dépendant (étape 3) : sensibilité et spécificité proches de 100 %.
L’affirmation de l’hypercortisolisme (étape 1) est un pré-requis indis-
pensable, et la permanence de cet hypercortisolisme doit être vérifiée,
faute de quoi les données du CSPI sont ininterprétables. Le CSPI est
peu performant pour le diagnostic de latéralisation de l’adénome cor-
ticotrope (étape 4) : résultat exact dans 70 % des cas, contre 50 %
pour le hasard.

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume III, n° 1, mars 1999
sinus pŽtreux D et veine fŽmorale : 5 x 3
Òtaux de baseÓ toutes les 5 min, puis
4 x 3 prŽl•vements 1, 3, 5, et 10 min apr•s
injection i.v. (voie pŽriphŽrique) de 100 µg
de CRH ovin. Si le cathŽtŽrisme a ŽtŽ diffi-
cile, une hŽparinothŽrapie est initiŽe au
cours de lÕexamen et poursuivie pendant 12
ˆ 24 h. LÕexamen dure 2 ˆ 3 h et nŽcessite
une Žquipe parfaitement coordonnŽe de 5 ˆ
8 personnes, dont deux neuroradiologues
entra”nŽs. LÕirradiation
est importante. Le cožt
en consommables
(cathŽters, kit de dosa-
ge) est dÕenviron
13 000 F. Le patient
est gŽnŽralement hos-
pitalisŽ 24 heures.
Complications
Mineures
On peut constater des
hŽmatomes au point de
ponction, rares (3-5 %),
et bien contr™lŽs par
compression (10).
Majeures
Quatre accidents vas-
culaires du tronc cŽrŽ-
bral ont ŽtŽ rapportŽs,
dont deux avec
sŽquelles dŽfinitives :
1 sur 508 examens
(0,2 %) pratiquŽs au
NIH, 3 autres cas dans
dÕautres institutions
(11-13). Nous avons
la chance de ne pas en
avoir rencontrŽ apr•s
76 examens. Au
moins 3 des accidents
rapportŽs sont surve-
nus avec des cathŽters
dÕun diam•tre 5 F,
plus larges que ceux utilisŽs actuellement.
Le mŽ-canisme serait une hyperpression
ou une thrombose, survenant dans une
veine issue du tronc cŽrŽbral et se drainant
anormalement dans le SPI. Ces accidents
exceptionnels se sont accompagnŽs de
signes prŽ-monitoires survenus au cours
de la procŽdure (trouble du langage, dys-
esthŽsie, et tout signe inhabituel men-
tionnŽ par le patient), qui doivent faire
retirer en urgence les cathŽters (11). Un
cas dÕembolie pulmonaire, sans mise en
Žvidence de thrombose veineuse des
membres infŽrieurs, a Žgalement ŽtŽ rap-
portŽ (14).
Sensibilité et spécificité
pour la détermination
de l’origine hypophysaire
ou extrahypophysaire
de l’hypercortisolisme
ACTH-dépendant
Depuis lÕarticle du NIH rapportant une sen-
sibilitŽ et une spŽcificitŽ de 100% (3), de
rares cas de faux positifs et de faux nŽgatifs
ont ŽtŽ rapportŽs.
Faux positifs
Un gradient hypophyse/pŽriphŽrie existe
alors quÕil nÕy a pas dÕadŽnome cortico-
trope. Deux situations particuli•res per-
mettent ˆ des cellules hypophysaires cor-
ticotropes normales de sŽcrŽter de
lÕACTH alors quÕil existe une tumeur
ectopique. La premi•re est lÕexploration
en phase dÕeucortisolisme dÕune sŽcrŽtion
ectopique intermittente dÕACTH (15). Il
ne sÕagit pas ˆ proprement parler dÕun
faux positif mais plut™t dÕun examen rŽa-
lisŽ en dŽpit des r•gles (cf. plus haut et 3,
10). La seconde est reprŽsentŽe par les
exceptionnelles tumeurs extrahypophy-
saires sŽcrŽtant de lÕACTH et du CRH
(16, 17). Ces tumeurs sont une des justifi-
cations de la stratŽgie qui consiste ˆ prati-
quer une TDM thoraco-abdominale avant
le CSPI (figure 2).
Faux négatifs
Il nÕy a pas de gradient alors quÕil y a un
adŽnome corticotrope.
Au moins deux cas ont ŽtŽ rapportŽs (18,
19). Le premier est peu convaincant : il nÕy
41
IRM Hψ
cathé SPI
poursuite imagerie
thoraco-abdominale
traitement surrénalien
TDM thoracique
et abdominale
ponction ou
biopsie /exérèse
exérèse
tumorale
chirurgicale
8 mg DEX
Test CRH
neurochirurgie
image
d'adénome
typiques
M.C.
IRM normale
ou image douteuse
non typiques
M.C.
pas de tumeur
thoracique ou abdominale
gradient C/P
nonoui
ouinon
tumeur
tumeur
ACTH+ et/ou CRH+
Hypercortisolisme ACTH-dépendant
Figure 2. Indications du CSPI dans lÕexploration des hypercortisolismes
ACTH-dŽpendants.
Le CSPI n’apparaît pas nécessaire si l’IRM hypophysaire montre une
image franche (> 5 mm) de microadénome et que les tests dyna-
miques sont typiques d’une maladie de Cushing. Nous le croyons
indispensable lorsque l’IRM est normale ou douteuse, quels que soient
les résultats des tests dynamiques. Il nous semble également justifié
lorsque qu’il y a une image franche à l’IRM mais que les test dyna-
miques ne sont pas typiques d’une maladie de Cushing. Si l’on retient
une indication de CSPI, il est logique de faire auparavant une TDM
thoraco-abdominale pour détecter une éventuelle tumeur accessible à
la ponction, ou justifiant à elle seule une exérèse chirurgicale. Cette
attitude permet également de dépister une partie des exceptionnelles
tumeurs à CRH et ACTH, qui restent des pièges pour le CSPI.

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume III, n° 1, mars 1999
a pas eu dÕhypocortisolisme apr•s exŽr•se
de lÕadŽnome hypophysaire, dont lÕanalyse
immunohistochimique nÕest pas mention-
nŽe. Le second est plus troublant. Ë noter
cependant que la stimulation a ŽtŽ faite par
AVP au lieu de CRH.
Diagnostic de latéralisation
de l’adénome corticotrope
De grands espoirs avaient ŽtŽ mis dans la
valeur du gradient latŽral pour prŽdire le c™tŽ
de lÕadŽnome. Cela aurait utilement complŽtŽ
un examen qui permet de porter des indica-
tions chirurgicales sur des lŽsions de tr•s
petite taille, qui Žchappent souvent ˆ lÕIRM
(de 30 ˆ 50 % des cas) (8), mais parfois Žga-
lement ˆ lÕÏil du chirurgien (environ 20 %
des cas) (20). Les rŽsultats restent dŽcevants,
puisque la prŽdiction nÕest exacte que dans
60 ˆ 70 % des cas (1-3, 21, 22), alors que le
hasard seul donnerait une rŽponse exacte
dans 50 % des cas. Des chiffres plus ŽlevŽs
ont ŽtŽ rapportŽs dans des petits sous-
groupes : 89 % sur 9 patients ˆ IRM norma-
le (22), mais il ne faut pas oublier que lÕin-
tervalle de confiance est large (50-99 %). Il a
ŽtŽ proposŽ que les donnŽes de lÕangiogra-
phie pratiquŽe avant prŽl•vement pŽtreux
permettent dÕamŽliorer la prŽdiction : sur
23 patients, 14 avaient un drainage symŽ-
trique (61 %)et la prŽdiction Žtait alors
exacte dans 12 cas (85 %), ce qui nÕest en
fait pas significativement diffŽrent de 4 cas
exacts sur les 9 patients (42 %) au drainage
asymŽtrique (21).
En conclusion, lÕutilisation des donnŽes du
gradient latŽral pour guider une hypophysec-
tomie partielle lorsque lÕadŽnome nÕest pas
vu devrait conduire ˆ un Žchec dans 3 cas sur
10. Pour cette raison, nous avons adoptŽ la
technique lourde mais prometteuse proposŽe
par Ludecke (23) : dosage peropŽratoire de
lÕACTH sur des prŽl•vements effectuŽs par
le chirurgien dans les sinus caverneux (24)
(J.G. Passagia, manuscrit en prŽparation sur
41 observations).
Comparaison
avec les autres explorations
Du fait de la frŽquence de la maladie de
Cushing, lÕattitude qui consisterait ˆ appe-
ler les yeux fermŽs Òmaladie de CushingÓ
tout hypercortisolisme ACTH-dŽpendant
aurait une sensibilitŽ de 100 % et une spŽ-
cificitŽ de 80 % pour ce diagnostic.
Tests dynamiques
Les plus utilisŽs sont le freinage 8 mg dexa-
mŽthasone, et les tests de stimulation ˆ la
mŽtopyrone ou au CRH. Contrairement aux
tumeurs responsables de sŽcrŽtions ecto-
piques, les adŽnomes corticotropes freinent
bien sous le premier test et sont bien stimulŽs
par les autres. Avec des seuils de 90 % de
freinage du CLU et 64 % de freinage des 17-
OH stŽro•des, le freinage 8 mg est crŽditŽ
dÕune sensibilitŽ de 72 % et dÕune spŽcificitŽ
de 100 % (25), pourtant remise en cause dans
une Žtude rŽcente portant sur 112 patients :
sensibilitŽ de 81 %, spŽcificitŽ de 67 % (26).
LÕutilisation combinŽe des deux premiers
tests offre une sensibilitŽ de 88 % et une spŽ-
cificitŽ de 100 % (25). Le test au CRH (seuils
de 50 % stimulation en ACTH et 20 % en
cortisol) est crŽditŽ dÕune sensibilitŽ de 91 %
et dÕune spŽcificitŽ de 95 % (27).
IRM avec injection
de gadolinium
Elle a apportŽ des progr•s dŽcisifs dans lÕima-
gerie hypophysaire. Cependant, la
petite taille des lŽsions fait que diffŽrentes
Žtudes rŽcentes retrouvent une sensibilitŽ qui
nÕest que de 50 ˆ 76 % (28-30). La qualitŽ
des appareils progressant toujours, on peut
espŽrer un gain de sensibilitŽ. Celle-ci se fera
cependant probablement aux dŽpens dÕune
perte de spŽcificitŽ, qui est dŽjˆ imparfaite
puisque, avec les appareils de 1994, 10 % de
sujets normaux ont des images compatibles
avec des microadŽnomes, mesurant jusquÕˆ
6 mm (31). Il faut se souvenir que les sŽries
autopsiques retrouvent jusquÕˆ 27 % dÕadŽ-
nomes non fonctionnels (8).
Au total, la combinaison des tests dyna-
miques offre une sŽcuritŽ diagnostique tr•s
bonne mais infŽrieure au CSPI. LÕIRM est
moins performante, mais la combinaison
des tests dynamiques et de lÕIRM est cer-
tainement supŽrieure aux deux pris isolŽ-
ment, car les deux ŽvŽnements rares Òavoir
une tumeur carcino•de qui rŽpond comme
un adŽnome corticotropeÓ et Òavoir une
lŽsion non spŽcifique ˆ lÕIRMÓ sont tr•s
probablement indŽpendants : la probabilitŽ
de leur association chez le m•me individu
doit donc •tre tr•s faible.
Imageries des tumeurs extra-
hypophysaires responsables de
sécrétion ectopique d’ACTH
Pour le diagnostic de ces tumeurs, la sensi-
bilitŽ des imageries est la suivante : radio-
graphie pulmonaire, 30 % ; TDM thoraco-
abdominale ÒclassiqueÓ, environ 80 % (32,
33), chiffre probablement amŽliorŽ par la
technique dÕacquisition spiralŽe en coupes
fines. LÕIRM thoracique a retrouvŽ des
tumeurs qui avaient ŽchappŽ aux TDM
classiques (33). La scintigraphie ˆ lÕoc-
trŽoscan a ŽtŽ crŽditŽe dÕexcellents rŽsul-
tats par certains (4). Cependant, un travail
rŽcent dŽmontre quÕelle est infŽrieure ˆ la
TDM et ˆ lÕIRM pour la dŽtection des car-
cino•des pulmonaires occultes et, si elle est
nŽgative, il est inutile de la rŽpŽter (34).
Au total, on doit faire systŽmatiquement
une radiographie pulmonaire, et on peut
•tre tentŽ de rechercher directement la prŽ-
sence dÕune tumeur thoracique ou abdomi-
nale par TDM, sans avoir au prŽalable dŽfi-
ni formellement lÕorigine hypophysaire ou
extrahypophysaire dÕune hypersŽcrŽtion
dÕACTH. Cette attitude est payante si on
met en Žvidence une tumeur de taille suffi-
samment importante pour quÕelle dicte une
conduite diagnostique (ponction-biopsie
ou exŽr•se) par elle-m•me. Par contre, si
lÕon dŽcouvre uniquement une image de
petite taille, ou pas dÕimage, il faudra se
souvenir que la spŽcificitŽ est probable-
ment mŽdiocre, et que la sensibilitŽ nÕest
pas de 100 %.
Stratégie thérapeutique
42

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume III, n° 1, mars 1999
Conclusions: indications
Les avantages du CSPI sont sa spŽcificitŽ et
sa sensibilitŽ optimales ; ses inconvŽnients
sont des complications exceptionnelles
mais graves, et un cožt ŽlevŽ. La rŽalisa-
tion est difficile et impose une Žquipe par-
faitement entra”nŽe. Cet examen est prŽ-
cieux dans les cas difficiles, qui restent frŽ-
quents : IRM normale ou douteuse quels
que soient les rŽsultats des tests dyna-
miques, et tests non typiques dÕune mala-
die de Cushing malgrŽ une image convain-
cante ˆ lÕIRM. Les Žquipes qui ne prati-
quent pas le CSPI nÕont pas de certitude
diagnostique lorsquÕils confient au neuro-
chirurgien des patients avec IRM normale.
La figure 2 rŽsume les indications que
nous retenons actuellement pour lÕexplora-
tion de rŽfŽrence que reprŽsente le CSPI. ■
Références
1. Bessac L., Bachelot I., Vasdev A., Martinie
M., Bonnier L., Chabre O., Passagia J., De
Rougemont J. Le cathŽtŽrisme des sinus pŽtreux
infŽrieurs. Sa place dans le diagnostic du syn-
drome de Cushing. ExpŽrience de 23 explora-
tions. Ann Endocrinol (Paris) 1992 ; 53 : 16-27.
2. Tabarin A., Greselle J., San-Galli F., Leprat
F., Caille J., Latapie J., Guerin J., Roger P.
Usefulness of the corticotropin-releasing hormo-
ne test during bilateral inferior petrosal sinus
sampling for the diagnosis of CushingÕs disease.
J Clin Endocrinol Metab 1991 ; 73 : 53-9.
3. Oldfield E., Doppman J., Nieman L.,
Chrousos G., Miller D., Katz D., Cutler G.J.,
Loriaux D. Petrosal sinus sampling with and
without corticotropin-relasing hormone for the
differential diagnosis of CushingÕs syndrome.
N Engl J Med 1991 ; 325 : 897-905.
4. Orth D. CushingÕs syndrome. N Engl J Med
1995 ; 332 (12) : 791-803.
5. Bremont C., Mosnier-Pudar H., Luton J.
Maladie de Cushing. Rev Prat 1996 ; 46 : 1490-7.
6. Yanovski J., Cutler G.J., Chrousos G.,
Nieman L. Corticotropin-releasing hormone sti-
mulation following low-dose dexamethasone
administration. JAMA 1993 ; 269 : 2232-8.
7. Kuhn J., Proeschel M., Seurin D., Bertagna X.,
Luton J., Girard F. Comparative assessment of
ACTH and lipotropin plasma levels in the dia-
gnosis and follow-up of patients with CushingÕs
syndrome : a study of 210 cases. Am J Med
1989 ; 86 : 678-84.
8. Lacroix A. La maladie de Cushing : un dŽfi
de taille. Presse Med 1997 ; 26 : 4-6.
9. Yanovski J., Cutler G.J., Doppman J., Miller D.,
Chrousos G., Oldfield E., Nieman L. The limited
ability of inferior petrosal sinus sampling with
corticotropin-releasing hormone to distinguish
CushingÕs disease from pseudo-Cushing states
or normal physiology. J Clin Endocrinol Metab
1993 ; 77 : 503-9.
10. Miller D., Doppman J. Petrosal sinus sam-
pling : technique and rationale. Radiology
1991 ; 178 : 37-47.
11. Miller D., Doppman J., Peterman S.,
Nieman L., Oldfield E., Chang R. Neurologic
complications of petrosal sinus sampling.
Radiology 1992 ; 185 : 143-7.
12. Seyer H., Honegger J., Schott W., Kuchle
M., Huk W., Fahlbusch R., Frisch H. RaymondÕs
syndrome following petrosal sinus sampling.
Acta Neurochir (Wien) 1994 ; 131 : 157-9.
13. Sturrock N., Jeffcoate W. A neurological
complication of inferior petrosal sinus sampling
during investigation for CushingÕs disease : a
case report. J Neurol Neurosurg Psychiatry
1997 ; 62 : 527-8.
14. Diez J., Iglesias P. Pulmonary thromboem-
bolism after inferior petrosal sinus sampling in
CushingÕs syndrome. Clin Endocrinol 1997 ;
46 : 777.
15. Yamamoto Y., Davis D., Nippoldt T., Young
W.J., Huston J. 3rd, Parisi J. False-positive
inferior petrosal sinus sampling in the diagnosis
of CushingÕs disease. Report of two cases.
J Neurosurg 1995 ; 83 : 1087-91.
16. Young J., Deneux C., Grino M., Oliver C.,
Chanson P., Schaison G. Pitfall of petrosal
sinus sampling in a CushingÕs syndrome secon-
dary to ectopic adrenocorticotropin-corticotro-
pin releasing hormone (ACTH-CRH) secretion.
J Clin Endocrinol Metab 1998 ; 83 : 305-8.
17. Chabre O., Mounier C., Martinie M., Bessou
P., Vasdev A., Grino M., Oliver C., Bachelot I.
Syndrome de Cushing par tumeur sŽcrŽtant du
CRH et de lÕACTH : un pi•ge rare pour le cathŽ-
tŽrisme des sinus pŽtreux. (abstract de communi-
cation orale). Ann Endocrinol 1998 ; 59 (3) : 172.
18. Lopez J., Barcelo B., Lucas T., Salame F.,
Alameda C., Boronat M., Salto L., Estrada J.
Petrosal sinus sampling for diagnosis of CushingÕs
disease : evidence of false negative results. Clin
Endocrinol (Oxford) 1996 ; 45 : 147-56.
19. Heppner C., Becker K., Saeger W., Gunther
R., Allolio B., Krone W., Winkelmann W. Occult
eutopic CushingÕs syndrome-failure of simulta-
neous bilateral petrosal sinus sampling to dia-
gnose pituitary-dependent CushingÕs syndrome.
Eur J Endocrinol 1997 ; 137 : 74-8.
20. Bachelot I., Passagia J., Labat-Moleur F.,
Chabre O., De Rougemont J. La chirugie trans-
sphŽno•dale de la maladie de Cushing : vingt ans
apr•s. Rev Fr Endocrinol Clin 1994 ; 35 : 479-90.
21. Mamelak A., Dowd C., Tyrrell J., McDonald
J., Wilson C. Venous angiography is needed to
interpret inferior petrosal sinus and cavernous
sinus sampling data for lateralizing adreno-
corticotropin-secreting adenomas. J Clin
Endocrinol Metab 1996 ; 81 : 475-81.
22. Booth G., Redelmeier D., Grosman H.,
Kovacs K., Smyth H., Ezzat S. Improved dia-
gnostic accuracy of inferior petrosal sinus sam-
pling over imaging for localizing pituitary
pathology in patients with CushingÕs disease.
Clin Endocrinol Metab 1998 ; 83 : 2291-5.
23. Ludecke D. Intraoperative measurement of
adrenocorticotropic hormone in peripituitary
blood in CushingÕs disease. Neurosurgery
1989 ; 24 : 201-5.
24. Bachelot I., Passagia J., Martinie M.,
Bessou P., Chabre O., Labat-Moleur F. Le dosa-
ge peropŽratoire de lÕACTH des sinus caver-
neux dans la maladie de Cushing (abstract
communication orale). Ann Endocrinol (Paris)
1994 ; 55 : 15.
25. Avgerinos P., Yanovski J., Oldfield E.,
Nieman L. Cutler G.J. The metyrapone and
dexamethasone suppression tests for the diffe-
rential diagnosis of the adrenocorticotropin-
dependent CushingÕs syndrome : a comparison.
Ann Intern Med 1994 ; 121 : 318-27.
26. Aron D., Raff H., Findling J. Effectiveness
versus efficacy : the limited value in clinical
practice of high dose dexamethasone suppres-
sion testing in the differential diagnosis ofadre-
nocorticotropin-dependent CushingÕs syndrome.
J Clin Endocrinol Metab 1997 ; 82 : 1780-5.
27. Kaye T., Crapo L. The Cushing syndrome :
an update on diagnostic tests. Ann Intern Med
1990 ; 112 : 434-44.
43
 6
6
1
/
6
100%