DAVID - KERNER new logo 2012

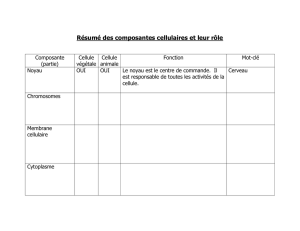
Une tumeur est constituée de nombreuses
populations cellulaires. Parmi celles-ci, une fraction
minoritaire possède la dangereuse capacité de
proliférer et de reconstituer l’ensemble de la tumeur:
ces cellules sont appelées « cellules souches
cancéreuse » ou « cellules initiatrices de tumeur»
(CITs). Résistantes aux traitements de
chimiothérapies, les CITs sont directement
impliquées dans l’émergence de récidives
tumorales et la formation de foyers métastatiques.
Par ailleurs elles sont retrouvées dans de
nombreux cancers (colon, sein…) et leur présence
est souvent associée à un mauvais pronostic
médical. Leur caractérisation est donc devenue
indispensable afin de mettre en place des
stratégies thérapeutiques favorisant leur
éradication.
Différenciation et plasticité cellulaires : comment
démasquer une cellule caméléon ?
A l’instar des cellules souches classiques, les CITs
sont multipotentes, ce qui implique qu’elles peuvent
produire l’ensemble des types cellulaires propres au
tissu originel. Ce processus se réalise en plusieurs
étapes, au cours desquelles la cellule acquiert des
compétences qui lui permettront de remplir des
fonctions précises au sein du tissu. Parallèlement,
cette spécialisation cellulaire s’accompagne de la
perte des capacités inhérentes aux cellules souches
(prolifération, multipotence). On parle de
« différenciation » car chaque population cellulaire
produite est distincte des autres et facilement
identifiable par ses caractéristiques moléculaires et
morphologiques, autrement dit son phénotype.
Cependant, dans un contexte tumoral, un mécanisme
antagoniste déstabilise ce système de classification:
« la plasticité ». Celle-ci permet aux cellules
différenciées de régresser vers un stade plus primitif,
et de recouvrer les capacités de prolifération et
d’initiation tumorale. Cette dynamique
bidirectionnelle confère un phénotype variable aux
CITs. En conséquence, l’identification des cellules
tumorales sur la base de leur aspect physique n’est
plus applicable. Bien au contraire, elle peut même
prêter à confusion. La mise en place de nouvelles
approches, plus dynamiques, est, à l’heure actuelle,
devenue indispensable.
La synthèse protéique au cœur de l’identité
cellulaire.
Notre équipe s’intéresse à l’identification des CITs
dans les cancers colorectaux. Confrontés aux limites
imposées par la variabilité phénotypiques des CITs
nous avons décidé de nous intéresser aux acteurs
façonnant le phénotype des cellules : les ribosomes.
Ceux-ci produisent les protéines, matière première de
l’architecture cellulaire, en « traduisant » les
instructions encodées dans le support de
l’information génétique cellulaire, l’ADN. Toute
transformation cellulaire requiert une augmentation
sensible de l’activité ribosomale, nécessaire a la
production de protéines permettant l’acquisition de
nouvelles fonctions cellulaires. Or, cette hausse
d’activité traductionnelle est détectable alors même
que la cellule initie son changement d’état, précédant
ainsi toute modification morphologique ou
moléculaire observable. De ce fait, l’activité
ribosomale représente un indicateur précoce de
transition cellulaire, pouvant discriminer, parmi des
cellules présentant un phénotype similaire, celles en
cours de transformation.
L’activité traductionnelle, un marqueur
diagnostique prometteur.
Les CITs, comme toute cellule souche, ont une faible
activité traductionnelle. Or, celle-ci s’accroit
considérablement lorsque les CITs entrent en phase
de différenciation. Les ribosomes doivent alors
produire les protéines nécessaires à leurs
transformations physiques et fonctionnelles. En
collaboration avec le National Institutes of Health
(U.S.A.), nous travaillons sur une technique
permettant d’identifier les cellules sur la base de
leur activité traductionnelle dans les tissus
vivants. Nous souhaitons utiliser cette méthode
afin d’identifier les CITs au sein de
l’environnement tumoral. Ce type d’approche est
totalement novateur dans le domaine du cancer. A
long terme, l’activité traductionnelle pourrait
devenir un marqueur diagnostique permettant
d’adapter les thérapies et le suivi post-
thérapeutique en fonction du contenu de la tumeur en
CITs.
ʻʻ Produco Ergo Sum ʼʼ
(1)
Une nouvelle approche pour isoler les cellules initiatrices de tumeur
De par sa capacité à recréer une tumeur identique à l’originelle, la « cellule initiatrice de tumeur » (CIT) est
rapidement devenue la Némésis des thérapies anti-cancéreuses. Cependant, ce véritable caméléon cellulaire
échappe aux méthodes classiques de caractérisation des cellules. L’équipe de J. Pannequin propose de
contourner ce problème en étudiant directement la machinerie forgeant l’identité cellulaire : les ribosomes.
Résistantes aux chimiothérapies, les CITs
pourraient bien être une cause majeure de
récidive tumorale.
Les cellules souches saines engendrent l’ensemble des
cellules spécialisées propres à chaque tissu en se
différenciant. Chaque étape de ce processus produit des
intermédiaires cellulaires facilement identifiables par
leur phénotype.
La dédifférenciation par « plasticité » produit des
intermédiaires cellulaires au phénotype dynamique et
instable.
L’information génétique contenue
dans l’ADN est transcrite sous forme
d’ARN messager (ARNm), puis
transportée vers les ribosomes qui la
traduisent en protéines. En contrôlant
la quantité et la nature des protéines
produites, les ribosomes façonnent le
phénotype cellulaire en temps réel.
Cancer du côlon: Cellules Initiatrices de Tumeurs et
machinerie traductionnelle
Multipotence : capacité d’une
cellule à se différencier en tous
les types cellulaires appartenant
au même tissu.
Génotype : ensemble de
l’information génétique portée
par un individu ou une cellule.
Phénotype : ensemble des caractères observables
chez un individu ou une cellule.
(1) « Je produis donc je suis »
I
nstitut de
G
énomique
F
onctionnelle
Alexandre DAVID
1
/
1
100%