Alpharadin® : une nouvelle radiothérapie métabolique des métastases osseuses du cancer

dossier thématique
La prostate métastatique :
de la biologie à la clinique
Correspondances en Onco-Urologie - Vol. II - no 4 - octobre-novembre-décembre 2011
159159
Alpharadin® : une nouvelle
radiothérapie métabolique
des métastases osseuses du cancer
de la prostate résistant à la castration ;
intérêt des émetteurs de particules α
Alpharadin®: a new metabolic radiotherapy of bone metastases arising
from castration-resistant prostate cancer; interest in α emitters
A.L. Giraudet*, L. Champion*, O. Madar*, V. Edeline*, A. Belly-Poinsignon*, A. Pecking*, P. Beuzeboc**,
J.L. Alberini*
* Médecine nucléaire,
hôpital René-Huguenin
etInstitut Curie, Paris.
** Département
d’oncologie médicale,
Institut Curie, Paris.
L
a radiothérapie métabolique est utilisée depuis
un peu plus d’une vingtaine d’années dans le
traitement antalgique des métastases osseuses
(MO) des cancers de la prostate et du sein. Elle pré-
sente l’avantage d’assurer l’irradiation de l’ensemble
des lésions osseuses avec une simple administration
intraveineuse (i.v.) de radiopharmaceutiques à tro-
pisme osseux. Ceux-ci comportent des radio-isotopes
émetteurs de particules qui interagissent avec l’ADN
des cellules environnantes et entraînent ainsi une
mort cellulaire. Le samarium-153 (153Sm) éthylène
diamine-tétraéthylène phosphonate (EDTMP) et le
strontium-89 (89Sr) sont les 2 radiopharmaceutiques
ayant une autorisation de mise sur le marché (AMM)
dans ce contexte de prise en charge palliative antal-
gique. Ils sont émetteurs de particules β– hautement
énergétiques (tableau) parcourant des trajets moyens
dans la matière de quelques millimètres. Malgré une
effi cacité antalgique démontrée, ces trajets relative-
ment longs sont responsables d’une irradiation des
cellules saines médullaires et donc d’une toxicité
médullaire limitant leur dose (1). L’utilisation d’iso-
topes émetteurs de particules α, plus lourdes et ayant
un dépôt d’énergie plus important sur une distance
Points forts
highlights
»
La radiothérapie métabolique permet l’irradiation de l’ensemble
des métastases osseuses avec l’administration intraveineuse de
radiopharmaceutiques à tropisme osseux tels que le radium-223
(223Ra), appelé Alpharadin®.
»
Le 223Ra irradie les lésions osseuses en émettant des particules α
à haut pouvoir ionisant.
»
Les études cliniques ont montré de faibles toxicités médullaire
et digestive du 223Ra.
»
Une étude de phase III évaluant l’Alpharadin® vient de montrer
un avantage signifi catif en survie globale dans le cancer de la
prostate avec métastases osseuses symptomatiques, résistant
à la castration.
Mots-clés : Cancer de la prostate résistant à la castration – Métastases
osseuses – Radium-223 – Alpharadin® – Médecine nucléaire.
Metabolic radiotherapy allows the irradiation of all bone
metastases with intravenous administration of bone-
seeking radiopharmaceuticals such as radium-223 (223Ra).
223
Ra irradiates bone metastases by emitting highly-
ionizing α particles.
Clinical studies have shown low bone marrow and
digestive toxicity of 223Ra.
Phase III study evaluating Alpharadin® has demonstrated
a signifi cant advantage in overall survival in prostate
cancer patients with symptomatic castration-resistant
bone metastases.
Keywords: Castration-resistant prostate cancer – Bone
metastases – Radium-223 – Alpharadin® – Nuclear
medicine.
COU-12 + pubs.indd 159COU-12 + pubs.indd 159 13/12/11 15:5813/12/11 15:58

dossier thématique
La prostate métastatique :
de la biologie à la clinique
Correspondances en Onco-Urologie - Vol. II - no 4 - octobre-novembre-décembre 2011
160160
plus courte, pourrait accroître l’arsenal thérapeutique
en augmentant l’efficacité thérapeutique tout en
limitant la toxicité médullaire. Voici les fondements
de la recherche et du développement de radiopharma-
ceutiques tels que l’Alpharadin®.
Études avec le 89Sr et le 153Sm
Strontium-89 (89Sr, Métastron®, Amersham
Health, Royaume-Uni)
Le
89
Sr est un calcimimétique qui s'incorpore direc-
tement dans la partie inorganique de l’os, avec une
intensité rapportée comme étant 10 fois plus impor-
tante dans les MO que dans l’os sain. Son élimination
plasmatique est principalement rénale. Le 89Sr est un
émetteur β– pur. L’absence d’émission de photons γ
ne permet pas la réalisation d’une imagerie scinti-
graphique, mais simplifie les mesures de radio-
protection. Le 89Sr a reçu l’AMM en 1993 uniquement
dans le cadre des MO douloureuses du cancer de la
prostate à la dose thérapeutique standard de 148 MBq,
l’étude de la courbe eff et-dose n’ayant pas montré de
bénéfi ce clinique à l’augmentation des doses. I.G. Finlay
et al. ont rapporté en 2005 l’eff et antalgique, observé
en moyenne chez 76 % des patients (1). Il apparaît à
compter du quatrième jour et jusqu’au vingt-huitième
jour, et peut durer jusqu’à 15 mois. Les eff ets indési-
rables observés sont une accentuation transitoire des
douleurs survenant entre le premier et le cinquième
jour, une baisse transitoire des globules blancs chez
12 à 80 % des patients et sur les plaquettes chez 29 à
80 %, sans conséquence préjudiciable, avec un nadir
à 3 ou 4 semaines. L’administration peut être répétée
en cas d’effi cacité thérapeutique et après un délai de
récupération médullaire d’au moins 2 mois.
Deux études randomisées, en double aveugle, ont
montré un bénéfi ce thérapeutique de 3 injections de
75 MBq de 89Sr comparativement au placebo avec un
gain de survie à 2 ans signifi catif sur une cohorte de
49 patients (46 % de patients survivants versus 4 % à 2 ans
[p < 0,05]) pour la première (2), et un gain antalgique
par rapport au strontium froid pour la deuxième (3).
Samarium-153 (153Sm-EDTMP, Quadramet®,
CIS Bio International, IBA, Gif-sur-Yvette,
France)
Le 153Sm est obtenu par la chélation du chlorure de
samarium-153 sur un sel de calcium (EDTMP) lui confé-
rant un tropisme osseux. Les MO fi xent environ 5 fois
plus ce radiopharmaceutique que l’os sain. Son élimi-
nation urinaire est complète en 6 heures. Le 153Sm est
un émetteur β– mais aussi γ, imposant des mesures
de radioprotection (recueil des urines des 6 premières
heures dans le service de médecine nucléaire). Le
rayonnement γ permet, en revanche, la réalisation
d’une scintigraphie facilitant un contrôle de la bonne
fi xation du 153Sm sur les MO. Les études cliniques
ont montré une toxicité similaire à celle du 89Sr. Les
administrations peuvent être renouvelées avec un
bénéfi ce antalgique (4). Le
153
Sm a reçu l’AMM en 1998
pour le traitement des MO ostéoblastiques doulou-
reuses fi xant les bisphosphonates radio marqués à
la scintigraphie osseuse. La dose thérapeutique est
de 37 MBq/kg.
Chlorure de radium-223
(Alpharadin®, Algeta ASA, Oslo, Norvège)
Le radium est aussi un calcimimétique. Le radium-223
(223Ra) est facile de production. Il émet à 93,5 % des
particules α qui ont la particularité de déposer une très
grande quantité de leur énergie sur un faible parcours,
engendrant notamment au niveau de l’ADN des lésions
de type double-brin, létales pour la cellule. Les parti-
cules β– du
153
Sm et du
89
Sr sont plutôt responsables
de lésions de type simple-brin, faciles à réparer par la
cellule. Les lésions double-brin peuvent avoir lieu dans
des cellules en phase G0, telles les cellules dormantes
métastatiques, et indépendamment du taux d’oxygène
et donc de la présence des radicaux libres, comme dans
les cellules hypoxiques. Les lésions engendrées par les
particules α ont lieu sur un parcours plus court, épar-
gnant ainsi une plus grande quantité de tissus sains.
Les mesures de radioprotection en sont par conséquent
simplifi ées.
Tableau. Propriétés physiques du strontium-89 (89Sr), du samarium-153 (153Sm) et du radium-223 (223Ra).
Radionucléide
Demi-vie physique radio-active (jours)
Énergie max. des β– (MeV)
Énergie γ (keV)
Parcours max. dans l’eau (mm)
89Sr
50,5
1,46
Non applicable
7,0
153Sm
1,9
0,81
103
2,5
223Ra
11,43
Non applicable
154 et 269
< 0,1
COU-12 + pubs.indd 160COU-12 + pubs.indd 160 13/12/11 15:5813/12/11 15:58

Correspondances en Onco-Urologie - Vol. II - no 4 - octobre-novembre-décembre 2011
161161
Alpharadin® : une nouvelle radiothérapie métabolique des métastases osseuses
du cancer de la prostate résistant à la castration ; intérêt des émetteurs de particules α
Études précliniques
Les études pharmacocinétiques menées chez la souris et
le chien ont montré une élimination rapide − sanguine
et des tissus mous − avec élimination urinaire et fécale
du produit en 1 heure (5). La concentration du 223Ra
dans l’os est 2 fois plus importante que celle du 153Sm
et du 89Sr.
Des souris porteuses de tumeurs mammaires n’expri-
mant pas de récepteurs hormonaux et ayant des MO
ont été traitées par 6 ou 11 kBq de
223
Ra ou par placebo.
Ces souris, qui habituellement souff raient de para lysies
en rapport avec des compressions médullaires induites
par les MO, ont présenté une survie sans paralysie
augmentée de façon significative (p < 0,05) contre
placebo et contre pamidronate, ainsi qu’une survie
globale (SG) augmentée. L’eff et sur les compressions
médullaires était lié à la dose mais avec un plateau qui
pourrait s’expliquer par un accès limité des particules α
aux cellules tumorales du fait de leur faible parcours.
Les administrations à doses croissantes – répétées
4 ou 12 fois et espacées de 4 semaines sur des rats et
répétées 6 fois sur des chiens avec le même délai entre
les doses – ont montré une toxicité médullaire majorée
beaucoup plus lentement résolutive ainsi qu'une
baisse signifi cative des phosphatases alcalines (PAL).
Vingt-deux cas d’ostéosarcome ont été observés
chez 16 rats sur les 24 traités par de fortes doses
(325 ou 1 300 kBq/kg, ou 4 × 325 kBq/kg).
Études cliniques
Étude de phase I
La première étude de phase I conduite par une équipe
norvégienne et publiée en 2005 a inclus 25 patients
souff rant de MO liées à des cancers prostatiques ou
du sein (6). Ces patients ont été répartis en 5 groupes
de 5 paliers de dose allant de 46 kBq/kg à 250 kBq/kg
en 1 seule injection. Les études pharmacocinétiques
ont confi rmé la clairance sanguine rapide de l’Alpha-
radin® avec environ 4 % de l’activité totale résiduelle
dans le sang à 4 heures de l’injection. L’élimination est
principalement fécale. Les doses délivrées aux organes
sains objectivées par les études de dosimétrie sont
notables pour la moelle osseuse, puis dans une moindre
mesure pour les intestins et enfi n les voies urinaires.
La toxicité médullaire limitant la dose n’a jamais été
observée, puisque seules des neutropénies de grade 3
spontanément résolutives en 2 mois ont été observées.
Aucun patient n’a présenté de thrombopénie sévère
contrairement à ce qui peut être rencontré avec le
89
Sr
ou le 153Sm. Grâce à une faible émission de rayons γ, des
images scintigraphiques ont montré une concordance
des foyers de fi xation du 223Ra et des foyers observés
en scintigraphie osseuse. Les eff ets indésirables étaient
principalement d’ordre digestif, avec des diarrhées,
des nausées et des vomissements transitoires, et une
fatigue. Bien qu’une recrudescence transitoire des
douleurs osseuses ait été notée chez 7 patients la
première semaine, plus de la moitié des sujets ressen-
taient une amélioration de leurs douleurs à 1 semaine
de l’injection, qui se poursuivait à la huitième semaine.
La dose la plus basse (50 MBq/kg) a été retenue pour
les études ultérieures.
Étude de phase II
La même équipe a ensuite conduit une étude de phase II
dans laquelle 4 injections de 50 MBq/ kg d’Alpharadin®
étaient administrées toutes les 4 semaines à 33 patients
alors que 31 sujets recevaient un placebo (7). Ces patients
présentaient une évolution métastatique osseuse
isolée d’un cancer de la prostate et non contrôlée par
l’hormonothérapie avec ascension prouvée du taux
de PSA. Ils pouvaient avoir été auparavant traités par
chimiothérapie ou radiothérapie externe, mais pas par
radio thérapie métabolique. Les 2 groupes étaient homo-
gènes. Avec une toxicité médullaire peu diff érente entre
les 2 groupes, la survie sans événement osseux, notam-
ment sans changement dans le traitement antalgique,
la réponse du PSA (critères de Bubley) et des PAL, ainsi
que la SG (65,3 versus 46,4 semaines [p = 0,066]) étaient
signifi cativement en faveur de l’effi cacité du traitement.
La toxicité était identique à celle observée lors de la
phase I avec une toxicité médullaire très modérée, des
signes digestifs – dont autant de signes de diarrhée que
de signes de constipation (12 patients traités contre
2 recevant le placebo) – et une recrudescence transitoire
des douleurs osseuses.
Étude de phase III
Les résultats de l’étude ALSYMPCA (ALpharadin®
SYMptomatic Prostate CAncer study) de phase III,
multicentrique et internationale ont fait l’objet d’une
communication à l’ECCO/ESMO 2011 (8). L’inclusion
de 922 patients s’est terminée en janvier 2011. En juin,
l’arrêt de l’étude a été préconisé en raison de la démons-
tration d’un bénéfi ce signifi catif du traitement après
analyse intermédiaire planifi ée de 314 événements
observés chez les 809 patients analysés. Les patients
inclus devaient présenter un cancer de la prostate
métastatique à l’os, résistant à la castration, avec au
moins 2 foyers d’hyperfi xation à la scintigraphie et sans
lésion secondaire viscérale. Ils pouvaient soit avoir reçu
du docétaxel, soit présenter une contre-indication à son
utilisation, soit l’avoir refusé. Les patients étaient classés
en fonction de l’utilisation du docétaxel, du taux de PAL
COU-12 + pubs.indd 161COU-12 + pubs.indd 161 13/12/11 15:5813/12/11 15:58

dossier thématique
La prostate métastatique :
de la biologie à la clinique
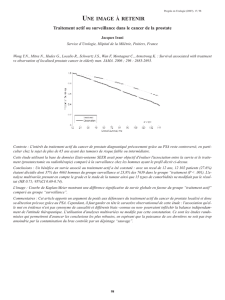
Figure. Courbes de SG des patients inclus dans l’essai de phase III ALSYMPCA (Alpharadin® contre placebo).
100
80
60
40
20
0
036
Placebo, n = 268
SG médiane : 11,2 mois
223Ra, n = 541
SG médiane : 14 mois
HR = 0,695 ; IC95 : 0,552-0,875
p = 0,00185
912
Mois
Survie globale (%)
15 18 21 24 27
Correspondances en Onco-Urologie - Vol. II - no 4 - octobre-novembre-décembre 2011
162162
et de l’utilisation de bisphosphonates. Ils ont été rando-
misés entre
223
Ra (6 injections toutes les 4 semaines de
50 kBq/kg i.v.) et un placebo. Le critère de jugement
principal était la SG. Les bras (bras 223Ra : n = 541 ; bras
placebo : n = 268) étaient équilibrés, et notamment
concernant l’étendue des métastases (40 % des sujets
dans les 2 bras avaient un nombre de foyers osseux supé-
rieur à 20). La médiane de SG est de 14,0 mois dans le
bras 223Ra versus 11,2 mois dans le bras placebo (fi gure).
Ce bénéfi ce est statistiquement signifi catif (HR = 0,695 ;
IC95 : 0,552-0,875 [p = 0,00185]) et retrouvé pour tous
les sous-groupes analysés. Le 223Ra prolonge également
signifi cativement le temps jusqu’au premier événement
osseux (HR = 0,0610 ; IC
95
: 0,461-0,807 [p = 0,00046]).
Tous les autres critères de jugement secondaires ont été
également améliorés : le temps jusqu’à progression des
PAL totales (p < 0,00001), le temps jusqu’à progression
du PSA (p = 0,00015), le taux de réponse complète des
PAL totales (p < 0,001). Alors que l’on aurait pu craindre
des toxicités hématologique et digestive, la tolérance est
excellente, sans diff érence notable avec le bras placebo.
Conclusion
L’Alpharadin® semble apporter une réelle augmentation
de l’index thérapeutique ainsi qu’un gain sur la SG et
pourrait devenir le radiopharmaceutique standard pour
la radiothérapie métabolique des MO de cancers de la
prostate réfractaires à l’hormonothérapie. Les prochaines
études devront aider à établir sa place dans la chrono-
logie de la prise en charge de ces patients, l’intérêt de
l’associer aux nouvelles thérapeutiques en cours de
développement dans le cancer de la prostate, ainsi que
son utilité pour le traitement des MO ayant pour origine
d’autres cancers tels que le cancer du sein. ■
1.
Finlay IG, Mason MD, Shelley M. Radioisotopes for the palliation of metastatic bone cancer:
a systematic review. Lancet Oncol 2005;6:392-400.
2. Buchali K, Correns HJ, Schuerer M et al. Results of a double blind study of 89-stron-
tium therapy of skeletal metastases of prostatic carcinoma. Eur J Nucl Med 1988;6(6):
392-400.
3. Lewington VJ, McEwan AJ, Ackery DM et al. A prospective, randomised double-blind
crossover study to examine the effi cacy of strontium-89 in pain palliation in patients with
advanced prostate cancer metastatic to bone. Eur J Cancer 1991;27(8):954-8.
4.
Resche I, Chatal JF, Pecking A et al. A dose-controlled study of
153
Sm-ethylenediaminetetra-
methylenephosphonate (EDTMP) in the treatment of patients with painful bone metastases.
Eur J Cancer 1997;33(10):1583-91.
5. Henriksen G, Breistøl K, Bruland ØS et al. Signifi cant antitumor eff ect from bone-seeking,
alpha-particle-emitting (223)Ra demonstrated in an experimental skeletal metastases model.
Cancer Res 2002;62(11):3120-5.
6.
Nilsson S, Larsen RH, Fossa SD et al. First clinical experience with alpha-emitting radium-
223 in the treatment of skeletal metastases. Clin Cancer Res 2005;11(12):4451-9.
7. Nilsson S, Franzén L, Parker C et al. Bone-targeted radium-223 in symptomatic, hormone-
refractory prostate cancer: a randomised, multicentre, placebo-controlled phase II study.
Lancet Oncol 2007;8(7):587-94.
8. Parker C, Heinrich D, Sullivan JM et al. Overall survival benefit of Radium-223 chloride
(Alpharadin®) in the treatment of patients with symptomatic bones metastases in castration-
resistant prostate cancer (CRPC): a phase III randomized trial (ALSYMPCA). ECCO/ESMO 2011, 1 LBA.
Références
COU-12 + pubs.indd 162COU-12 + pubs.indd 162 13/12/11 15:5813/12/11 15:58
1
/
4
100%