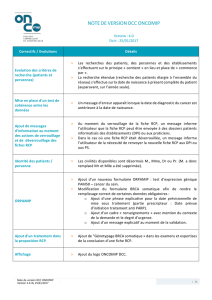
Evaluation de la qualité de la... Concertation Pluridisciplinaire du Centre François

Mémoire de DES
Evaluation de la qualité de la Réunion de
Concertation Pluridisciplinaire du Centre François
Baclesse.
Christophe Valmar
Tutrice : Pr Florence Joly
Date de soutenance : 5 et 6 juin 2015

Table des matières
1 Introduction ............................................................................................................................. 4
2 Contexte .................................................................................................................................. 5
2.1 Les Réunions de Concertation pluridisciplinaires ................................................................ 5
2.2 Les cancers gynécologiques ................................................................................................. 7
2.2.1 Les cancers de l’endomètre. .............................................................................................. 7
2.2.2 Les cancers de l’ovaire. ................................................................................................... 10
2.2.3 Les cancers du col de l’utérus. ........................................................................................ 11
3 Matériels et méthodes ............................................................................................................ 12
3.1 Objectifs de l’étude ............................................................................................................ 12
Les objectifs secondaires étaient : ........................................................................................... 12
3.2 Critères d’évaluation .......................................................................................................... 13
3.3 Design de l’étude ................................................................................................................ 15
3.3.1 Période d’inclusion .......................................................................................................... 15
3.3.2 La réunion de concertation pluridisciplinaire gynécologique et les référentiels utilisés 15
3.4 Recueil de données ............................................................................................................. 15
3.5 Analyse statistique .............................................................................................................. 16
4 Résultats ................................................................................................................................ 16
4.1 Données générales des fiches RCP .................................................................................... 16
4.2 Caractéristiques de la population générale ......................................................................... 18
4.2.3 Caractéristiques de la population tirée au sort ................................................................ 21
4.3 Evaluation de la qualité ...................................................................................................... 22
4.3.1 critères de qualité définis par les autorités de santé ........................................................ 22
4.3.1.1 Quorum ......................................................................................................................... 22
4.3.1.2 Critère de lieu et de fréquence des RCP ....................................................................... 22
4.3.1.4 Traçabilité ..................................................................................................................... 23
4.3.1.4 Stade Figo et histologie ................................................................................................ 23
4.3.1.5 Statut OMS ................................................................................................................... 23
4.3.2 Propositions de décision émises par la RCP : recours aux référentiels régionaux et aux
attitudes consensuelles. ............................................................................................................ 24
4.4 Délais de prise en charge .................................................................................................... 27
4.5 Prise en charge chirurgicale des cancers de l’ovaire .......................................................... 29
4.6 Prise en charge chirurgicale des cancers de l’endomètre de stade I ................................... 34
5 Discussion ............................................................................................................................. 37
5.3 Devenir des propositions de décisions émises par la RCP ................................................. 39
5.5 Prise en charge des cancers de l’ovaire .............................................................................. 41
5.6 Prise en charge chirurgicale des cancers de l’endomètre de stade I. .................................. 43
6 Conclusion ............................................................................................................................. 44

1 Introduction
L'incidence des cancers a fortement augmenté en France entre 1980 et 2012, avec une
augmentation de plus de 100 % à la fois chez l'homme et chez la femme(1)
Cette augmentation s'explique par différents facteurs, notamment l'augmentation durant cette
période de la population française, passant de 55 millions en 1982 à 65 millions d'habitants en
2012, mais aussi le vieillissement de la population, et l'amélioration des méthodes de
diagnostic.
Parallèlement le Cancer est devenu en France la première cause de décès, avec une estimation
en 2009 à 30 % des causes de décès, dépassant ainsi les décès par maladies cardio-vasculaires
(27 %)(2). Ces constatations ont amené les autorités en charge de la Santé à considérer le
Cancer comme un problème de santé publique.
Pour répondre à ce problème, a été lancé en 2003 le Plan Cancer 1, qui avait pour objectif de
donner de meilleurs moyens de lutte aux acteurs de la prise en charge du cancer.
Ainsi il a été pris en compte le fait que la prise en charge du cancer était multidisciplinaire,
faisant intervenir des oncologues médicaux, des radiothérapeutes, des chirurgiens, mais aussi
des anatomopathologistes, des radiologues, des médecins nucléaires et potentiellement
d’autres spécialités.
Afin de permettre à chaque patient d’avoir les meilleures chances, et les mêmes chances sur le
plan thérapeutique la mesure 31 du plan cancer 2003-2007 préconise « de faire bénéficier
100 % des nouveaux patients atteints de cancer d'une concertation pluridisciplinaire autour de
leur dossier. Synthétiser le parcours thérapeutique prévisionnel issu de cette concertation sous
la forme d'un « programme personnalisé de soins » remis au patients».(3)
Dans un objectif d’homogénéisation des prises en charge des patients, les autorités de santé
ont défini un certain nombre de critères à respecter concernant l'organisation de ces réunions
de concertation pluridisciplinaire. (4)(5)
L'objectif de ce travail est, dans une première partie, d’évaluer la qualité de la réunion de
concertation pluridisciplinaire gynécologique du centre François Baclesse, d'une part selon les
critères définis par la Haute Autorité de Santé (HAS), et d'autre part selon d'autres critères
considérés comme importants, permettant ainsi de répondre aux recommandations des
instances de Santé, Nous avons étudié dans un second temps plus spécifiquement sur un
échantillon de dossiers tirés au sort la conformité de la prise en charge des cancers de l’ovaire
et de l’endomètre traités chirurgicalement pour lesquels les recommandations avaient

évoluées ces 5 dernières années (pour les cancers de l’ovaire si les patientes avaient eu une
cœlioscopie première et la qualité de la chirurgie à savoir si celle-ci était complète et pour les
cancers de l’endomètre de stade I la corrélation entre la stadification préopératoire basée sur
l’examen clinique et les constatations de l’IRM préopératoire et l’histologie définitive
postopératoire).
2 Contexte
2.1 Les Réunions de Concertation pluridisciplinaires
La mesure 31 du plan cancer établit les contours de la mise en place des réunions de
concertation pluridisciplinaire.(3)
Les principes généraux et la mise en application de cette dernière sont énoncés par la
circulaire DHOS du 22 février 2005, Annexe II : Principes généraux et modalités de
fonctionnement des réunions de concertation pluridisciplinaires (mesure 31 du plan
cancer).(6)
Ainsi, les réunions de concertation pluridisciplinaires (RCP) sont désormais considérées
comme le lieu de la discussion diagnostique et thérapeutique entre les professionnels.
Tous les dossiers des patients atteints de cancer doivent être enregistrés par le secrétariat de la
RCP.
Les dossiers qui doivent être obligatoirement discutés en RCP avant mise en route du
traitement sont ceux qui ne relèvent pas de référentiels validés et actualisés (standards) ou
dont le réexamen s’impose chaque fois qu’il y a changement significatif d’orientation
thérapeutique.
Lorsque le praticien propose au patient de ne pas appliquer l’avis de la RCP mais de recourir à
un autre traitement, il doit pouvoir le justifier et il est nécessaire de le mentionner dans le
dossier.
Des procédures de contrôle, interne et externe, sont obligatoirement mises en place dans le
cadre du 3C pour vérifier le respect de ce processus pour chaque patient ainsi que

l’adéquation des dossiers discutés en RCP. Ce taux d’adéquation et son évolution
constitueront un des indicateurs qualité du rapport d’activité demandé aux centres de
coordination en cancérologie.
Ainsi, afin d’assurer l’objectif premier de la pluridisciplinarité, nombre de médecins
minimum, appelé quorum est exigé lors de chaque RCP. La circulaire DHOS du 22 Février
2005 a fixé ce nombre à 3 médecins de 3 spécialités différentes. Elle précisait même que
parmi les médecins spécialistes présent devaient se trouver un oncologue, un chirurgien et un
radiologue.
Des normes de fréquence ont également été établies avec l’obligation que soit tenue au moins
deux réunions par mois. Tout médecin participant à la prise en charge peut participer aux
réunions et doit donc pouvoir se tenir informé des dates et lieux de ces dernières via les
réseaux de cancérologie.
Afin d’homogénéiser les pratiques dans une même structure, un support de présentation devait
être mis en place et être à disposition des médecins. Les principaux critères cliniques et un
résumé de la situation carcinologue doivent y figurer.
Ces mesures constituent une mise en place systématique des RCP selon un cadre légal et en
font une référence dans la prise en charge des patients, bien que nombre d’établissements
avaient déjà adopté ce schéma de fonctionnement notamment par la création de comités
d’organes au sein des Centres de Lutte contre le Cancer.
Les RCP doivent de plus faire l’objet de réévaluation afin de s’assurer de leur conformité.
Différentes méthodes sont utilisables. En premier lieu, la Haute Autorité de Santé a mis à
disposition des Centres et Réseaux de soins impliqués dans la prise en charge du cancer, un
indicateur « réunion de concertation pluridisciplinaire » sous la forme d’une grille, permettant
d’évaluer 25 critères.(5)
L’évaluation locale des pratiques est également une méthode d’évaluation utilisable(7)
Enfin, Harris et al. ont mis en place une méthode d’hétéro-évaluation des RCP.(8)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
1
/
51
100%