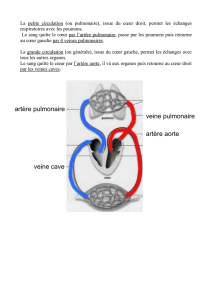
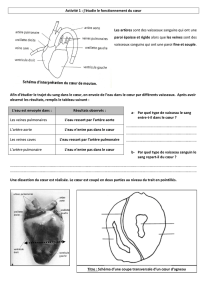
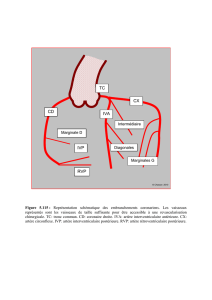
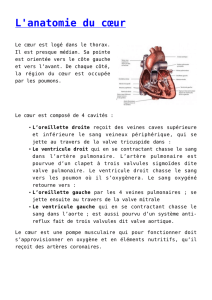
DISSECTION DE L`AORTE : Détection de l`artère d`Adamkiewicz

DISSECTION DE L'AORTE :
Détection de l'artère d'Adamkiewicz
intégrée au bilan aortique en ARM 3T.
S. Véron-Piot, F. Bonnet, S. Rubin, G. Mac,
S. Cardini, C. Marcus
REIMS
CHU REIMS
CHU REIMS

Population
Population
4.1
Protocole IRM
Protocole IRM –
–Dissection aortique
Dissection aortique
Comment identifier l'AKA ?
Comment identifier l'AKA ?
R
Ré
ésultats
sultats
Discussion
Discussion
5.
5.
4.3
4.2
4.4
IRM et Dissection aortique
IRM et Dissection aortique
IRM versus angioscanner et art
IRM versus angioscanner et arté
ériographie
riographie
R
Ré
éf
fé
érences
rences
6.
6.
Introduction
Introduction
1.
1.
Rappels anatomiques
Rappels anatomiques
2.
2.
Int
Inté
érêt de localiser l
rêt de localiser l’
’art
artè
ère d
re d’
’Adamkiewicz
Adamkiewicz
3.
3.
Mat
Maté
ériel et m
riel et mé
éthodes
thodes
4.
4.
Points importants
Points importants
5.1
5.3
5.2

Une parapl
Une paraplé
égie ou une parapar
gie ou une paraparé
ésie compliquent
sie compliquent
1
1 à
à5 % des chirurgies
5 % des chirurgies
de l
de l’
’aorte thoracique descendante.
aorte thoracique descendante. [1]
[1]
L
L’
’angio
angio-
-IRM (ARM) est une m
IRM (ARM) est une mé
éthode non invasive
thode non invasive
qui permet l
qui permet l’é
’étude globale de l
tude globale de l’
’aorte thoraco
aorte thoraco-
-abdominale et la
abdominale et la
recherche de l
recherche de l’
’art
artè
ère d
re d’
’Adamkiewicz.
Adamkiewicz.
Le rep
Le repé
érage pr
rage pré
éop
opé
ératoire de l
ratoire de l’
’art
artè
ère d
re d’
’Adamkiewicz permet
Adamkiewicz permet
de diminuer l
de diminuer l’
’incidence des complications neurologiques
incidence des complications neurologiques
post
post-
-op
opé
ératoires.
ratoires.
Introduction
Introduction
1.
1.

Introduction.
Introduction.
L'originalité de notre étude repose sur :
Une population atteinte électivement de dissection
aortique (et non d'anévrysme aortique).
L'utilisation d'un champ magnétique à 3 Teslas.
L'étude en un seul examen de l'ensemble de
l'aorte thoraco-abdominale et de l'AKA.

Les artères superficielles médullaires sont systématisées
en 3 syst
3 systè
èmes verticaux
mes verticaux, anastomosés entre eux par un
r
ré
éseau horizontal
seau horizontal péri médullaire :
Artère spinale antérieure : verticale, dans la fissure médiane ventrale
Artère spinale postérieure droite : longe le sillon collatéral postérieur droit
Artère spinale postérieure gauche.
Distribue les artérioles pénétrantes et assure la vascularisation des
cordons de la substance blanche. Le réseau horizontal est fourni par
les branches terminales des artères radiculo-médullaires.
Rappels anatomiques.
Rappels anatomiques.
2.
2.
Syst
Systè
èmes verticaux
mes verticaux
R
Ré
éseau horizontal
seau horizontal
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
1
/
60
100%