ONCOLOGIE TRANSLATIONNELLE // Coordonné par S. Faivre

mTORC2 PHLPP
PHLPP
Activité Akt élevée
Chimiothérapie
Survie cellulaire
Akt Akt
Voie PI3K
P P
P P
Voie PI3K
mTORC2
Activité Akt diminuée
Mort cellulaire
PHLPP
FKBPB51
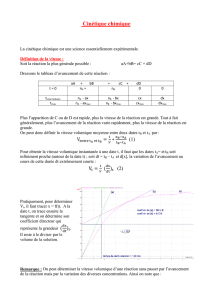
Schéma. En l’absence de FKBP51 (panel de gauche), la déphosphorylation du résidu Ser 473 d’Akt
par PHLPP est peu effi cace. Akt est donc activée et les cellules sont chimiorésistantes. À l’inverse, en
présence de FKBP51 (panel de droite) PHLPP est associée à Akt via FKBP51. Akt est alors effi cacement
déphosphoylée sur son résidu Ser 473 et devient donc inactive. Les cellules sont alors chimiosensibles.
Une nouvelle voie
de régulation d’Akt
indépendante de la voie PI3K
448 | La Lettre du Cancérologue • Vol. XVIII - n° 9 - novembre 2009
ONCOLOGIE
TRANSLATIONNELLE
Coordonné par S. Faivre
(hôpital Beaujon, Clichy)
C. Tournigand
(hôpital Saint-Antoine, Paris)
// Cancer Cell
// Nature Medicine
// Journal of Clinical Oncology
FKBP51 régule négativement
Akt et modifi e la réponse
des cellules cancéreuses
vis-à-vis des médicaments
chimiothérapeutiques
’ Pei H, Li L, Fridley BL, Jenkins GD, Kalari KR, Lingle W,
Petersen G, Lou Z, Wang L. FKBP51 affects cancer cell response
to chemotherapy by negatively regulating Akt. Cancer Cell
16(3);259:66.
A
kt est une sérine/thréonine kinase qui est
normalement activée en réponse aux facteurs
de croissance. Elle est souvent stimulée de manière
constitutive dans les cellules tumorales et joue un
rôle central dans leur survie. Lorsqu’elle est activée
– via la phosphorylation de ses résidus Thr308 et
Ser473, par PDK1 et mTORC2 respectivement –,
Akt promeut la survie cellulaire en phosphorylant
des protéines proapoptotiques (Bad,
FoxO, GSK) ou antiapoptotiques
(MDM2), inactivant les premières et
stimulant les secondes. Cela se traduit
par une prolifération cellulaire accrue
et par une résistance plus importante
aux traitements anticancéreux. Dans
un précédent travail privilégiant une approche
génomique, les auteurs ont montré qu’à la dimi-
nution d’expression du gène codant pour FKBP51
– une peptidyl-prolyl isomérase – était associée
une résistance des cellules tumorales vis-à-vis de
la gemcitabine et de l’Ara-C.
Pour confi rmer et généraliser leurs observations,
les auteurs ont ici diminué l’expression de FKBP51
dans les lignées de cellules de cancer pancréatique
SU86, de cancer du poumon A549 et de cancer du
sein MDA-MB-231, par ARN interférence. Ils les
ont ensuite exposées à diverses molécules chimio-
thérapeutiques : gemcitabine, SN-38, étoposide,
et paclitaxel.
Les résultats montrent que la perte d’expression
de FKBP51 induit un accroissement de la résistance
cellulaire vis-à-vis de l’ensemble des molécules
testées. À l’inverse, la surexpression de FKBP51
dans les cellules SU86 accroît la sensibilité des
cellules vis-à-vis de la gemcitabine.
Pour comprendre comment FKBP51 affecte la sensi-
bilité cellulaire, les auteurs ont observé le degré
de phosphorylation d’Akt. Il s’est avéré que la
perte d’expression de FKBP51 dans les cellules
SU86 s’accompagne d’une augmentation de la
phosphorylation d’Akt sur le résidu Ser473 ; la
phosphorylation du résidu Thr308, quant à elle,
n’est pas modifi ée. À l’inverse, la surexpression de

La Lettre du Cancérologue • Vol. XVIII - n° 9 - novembre 2009 | 449
FKBP51 entraîne la déphosphorylation spécifi que
du résidu Ser473 d’Akt, phénomène qui s’accom-
pagne d’une diminution de la phosphorylation de
GSK-3ß et FoxO1, 2 cibles d’Akt.
Pour déterminer si FKBP51 est directement impli-
quée dans la régulation de la phosphorylation du
résidu Ser473 d’Akt, les auteurs ont immunopréci-
pité FKBP51 et observé quelles étaient les protéines
capables de copurifi er. Ils ont ainsi montré que
Akt et PHLPP1 – la phosphatase responsable de la
déphosphorylation du résidu 473 d’Akt – formaient
un complexe avec FKBP51 au sein des cellules SU86.
À l’inverse, mTOR ne co-immunoprécipite pas
avec FKBP51. Lorsque FKBP51 est surexprimée, le
degré d’association d’Akt et de PHLPP1 augmente,
accroissant la déphosphorylation du résidu Ser473
(schéma). In vitro, les auteurs confirment que
FKBP51 amplifi e la capacité intrinsèque de PHLPP1
et d’Akt à former un complexe.
Pour déterminer si l’action de FKBP51 sur l’état
de phosphorylation d’Akt se fait exclusivement
via PHLPP1, les auteurs ont surexprimé FKBP51
et sous-exprimé PHLPP1 dans les mêmes cellules :
l’effet de FKBP51 est complètement annihilé et Akt
reste phosphorylée. Ce phénomène s’accompagne
d’une résistance à la gemcitabine, confi rmant que
l’effet de FKBP51 nécessite PHLPP1. Lorsque la forme
mutante FD67/68DV de FKBP51, dépourvue d’acti-
vité peptidyl-prolyl isomérase, est surexprimée dans
les cellules SU86, son effet sur l’état de phosphoryla-
tion du résidu Ser473 d’Akt est le même que lorsque
la forme sauvage de l’enzyme est exprimée. Cela
montre que l’activité enzymatique de FKBP51 ne
joue pas de rôle déterminant dans ce phénomène.
En délétant les domaines FKBP1 (résidus 1-138)
et FKBP2 (résidus 138-251) de FKBP51, les auteurs
montrent que ces 2 domaines sont importants pour
la formation du complexe entre FKBP51 et Akt. En
revanche, pour le complexe formé entre FKBP51
et PHLPP, ils montrent que c’est le domaine TPR
de la région C-terminale de FKBP51 qui est impor-
tant. Ces résultats suggèrent que l’interaction de
FKBP51 avec Akt et PHLPP se fait via des domaines
distincts, renforçant l’idée que FKBP51 joue un rôle
d’ancrage favorisant et renforçant l’association
entre Akt et PHLPP.
Afi n de confi rmer leurs observations in vivo, les
auteurs ont déterminé par microarray et western-
blot les niveaux d’expression, ARN ou protéiques,
de FKBP51 dans des tissus normaux ou tumoraux
provenant de patients atteints de cancer pancréa-
tique. Dans tous les cas où l’expression de FKBP51
était détectable dans les tissus normaux, l’expres-
sion de FKBP51 était perdue dans les tissus tumo-
raux correspondants et les pertes s’accompagnaient
d’un fort accroissement de la phosphorylation d’Akt
sur le résidu Ser473 au niveau des tissus tumoraux.
Akt est souvent retrouvée activée dans les cellules
tumorales au travers d’une dérégulation de la voie
PI3K.
Dans cet article, les auteurs identifi ent un nouveau
mécanisme, indépendant de la voie PI3K, qui agit
en aval de l’activation d’Akt et qui est capable de
réduire son état de phosphorylation. En compre-
nant les mécanismes qui contrôlent l’expression de
FKBP51, il est envisageable de moduler le niveau
d’activation d’Akt en bloquant sa perte d’expres-
sion, et ce quel que soit l’état de la voie PI3K.
A. Escargueil,
université Pierre-et-Marie-Curie, Paris
MACC1, un nouveau régulateur
clé de la voie de signalisation
HGF/Met, prédit la survenue de
métastases dans le cancer du
côlon
’ Stein U, Walther W, Arlt F, Schwabe H, Smith J, Fichtner I,
Birchmeier W, Schlag PM. Nat Med 2009;15(1):59-67.
D
es progrès considérables ont été accomplis dans
la prise en charge du cancer colorectal au cours
des 15 dernières années, qui ont permis de doubler
la survie des patients. Cependant, d’emblée ou de
façon métachrone, la moitié des patients déve-
loppe des métastases, cause la plus fréquente de
mortalité par cancer colorectal. À l’heure actuelle,
les critères clinico-pathologiques et moléculaires
sont insuffi sants pour permettre une identifi cation
précoce des patients à haut risque de développer
des métastases, et les mécanismes moléculaires
impliqués dans la métastagenèse sont mal connus.
La voie de signalisation HGF (hepatocyte growth
factor)/Met occupe une part importante dans les
processus de croissance cellulaire, de transition
épithélio-mésenchymateuse, d’angiogenèse, de
mobilité cellulaire, d’invasion et de diffusion méta-
statiques. Le récepteur à activité tyrosine kinase
Met, exprimé à la surface des cellules épithéliales,
est un récepteur du HGF décrit initialement comme
le facteur de croissance des hépatocytes mais
faisant également partie de la famille des scatter
factors (SF), qui jouent un rôle important dans
l’invasion cellulaire. Le récepteur Met transmet
des signaux intracellulaires antiapoptotiques, de
survie, de migration et d’invasion cellulaire, via les
voies de signalisation Ras/MAPK (mitogen activated
protein kinase) et PI3K/Akt. Ainsi une dérégula-
tion de HGF/Met est-elle associée aux processus
de carcinogenèse et de diffusion métastatique,
comme cela a été décrit dans plusieurs types de
cancers, dont le cancer colorectal, où une hyper-
expression de Met a été rapportée comme facteur
clé de l’invasion cellulaire précoce et du risque
métastatique (1, 2).
Les auteurs se sont intéressés au gène MACC1
(metastasis associated in colon cancer 1), localisé sur
le chromosome7, préalablement identifi é comme
un gène d’intérêt hyperexprimé dans les métastases
de cancer colique. Ils ont examiné l’expression de
l’ARNm de MACC1 dans de la muqueuse colique et
hépatique normale, dans des adénomes coliques
(n = 13) et des tumeurs primitives coliques, et dans
des métastases hépatiques de patients ayant un
cancer colique opéré et ayant ou non développé
des métastases métachrones ou d’emblée métasta-
tiques (17, 23, 22 et 28 cancers de stades I, II, III et IV
respectivement). MACC1 était signifi cativement
surexprimé dans les tissus tumoraux comparés à
la muqueuse normale et adénomateuse, de même
que dans les tumeurs coliques de patients avec
cancer de stade II-III ayant développé des métas-
tases métachrones comparés à ceux qui n’avaient
pas eu de métastases. L’expression de MACC1 était
similaire dans les tissus coliques et dans les méta-
stases correspondantes d’un même patient.
L’analyse multivariée a montré que MACC1 était un
facteur prédictif de métastases de cancer colique,
indépendamment de l’âge, du sexe, de l’invasion
pariétale tumorale, du statut ganglionnaire et
de l’invasion vasculaire. Le taux d’expression de
MACC1 était également corrélé à la survie sans
métastases, puisque les patients avec un fort taux
d’expression de l’ARNm de MACC1 au niveau
colique avaient une survie sans métastases signifi ca-
tivement diminuée comparés à ceux avec un faible
taux d’expression (survie à 5 ans : 80 % versus 15 %),
indépendamment du taux d’expression de Met.
Sur un plan plus fondamental, la transfection de
MACC1 au sein de la lignée cellulaire de cancer
colique SW480 – qui, normalement, n’exprime pas
ce gène – était associée à une augmentation impor-
tante de l’expression de l’ARNm de MACC1, mais
également de Met, ce qui a été confi mé au niveau
protéique. La transfection de siARN spécifi que de
MACC1, destinée à obtenir un gene-silencing du

450 | La Lettre du Cancérologue • Vol. XVIII - n° 9 - novembre 2009
ONCOLOGIE
TRANSLATIONNELLE
gène, était ensuite responsable d’une diminution
signifi cative du taux d’ARNm et protéique de Met,
alors que la transfection de siARN spécifi que de
Met induisait une simple diminution d’expression
de Met sans modification de l’expression de
MACC1. Ces résultats suggèrent donc une infl u-
ence de MACC1 sur l’activation de la voie HGF/Met
indépendante de l’expression de Met. Les mêmes
transfections ont donné des résultats similaires dans
la lignée SW620 exprimant constitutivement forte-
ment MACC1 (lignée provenant d’une métastase
issue de la ligne SW480, au niveau colique, d’un
même patient).
L’expression de MACC1 augmentait la migra-
tion, l’invasion et la prolifération cellulaire dans
ces 2 modèles de culture cellulaire et favorisait
le développement de métastases hépatiques et
pulmonaires dans des modèles de souris xénogref-
fées avec des cellules SW480 exprimant MACC1.
Les auteurs ont enfi n pu montrer que le gène Met
était une cible transcriptionnelle de MACC1.
Cette étude montre que MACC1 est un facteur clé
dans l’activation de la voie HGF/Met, qui joue un
rôle important dans le processus de diffusion méta-
statique des cancers colorectaux. Il pourrait donc
constituer un facteur pronostique majeur pour
identifi er les patients opérés à risque de développer
des métastases métachrones, et devenir une cible
thérapeutique chez les patients métastatiques.
A. Lièvre,
hôpital Ambroise-Paré,
Boulogne-Billancourt
Références bibliographiques
1. Di Renzo MF, Olivero M, Giacomini A et al.
Overexpression and amplifi cation of the Met/HGF
receptor gene during the progression of colorectal
cancer. Clin Cancer Res 1995;1:147-54.
2. Takeuchi H, Bilchik A, Saha S et al. c-Met
expression level in primary colon cancer: a predictor
of tumor invasion and lymph node metastases.
Clin Cancer Res 2003;9:1480-8.
Risque de cancer colorectal
associé à la mutation du gène
MUTYH : conséquences
pour la pratique clinique
> Lubbe SJ, Di Bernardo MC, Chandler IP, Houlston RS. Clinical
implications of the colorectal cancer risk associated with MUTYH.
J Clin Oncol 2009;27:3975-80.
C
inq pour cent des cancers colorectaux sont liés
à un syndrome de prédisposition génétique, les
plus fréquents étant le syndrome hereditary non
polyposis colorectal cancer (HNPCC) et la polypose
adénomateuse familiale (PAF). Ces 2 entités sont
dues à une mutation constitutionnelle respecti-
vement d’un des gènes du système de réparation
des mésappariements de l’ADN et du gène adeno-
matous polyposis coli (APC), et sont caractérisées
par une transmission autosomique dominante.
Plus récemment, il a été montré que la présence
d’une mutation biallélique du gène MUTYH, appar-
tenant au système de réparation par excision de
base (base excision repair [BER]), était associée à
un risque de cancer colorectal selon une transmis-
sion récessive par l’intermédiaire d’une prédispo-
sition à un phénotype de polypose adénomateuse
atténuée (1-3). Quarante pour cent des polyposes
adénomateuses sans mutation du gène APC s’expli-
queraient par cette mutation. Le risque de cancer
colorectal en présence d’une mutation monoallé-
lique de MUTYH reste, quant à lui, non démontré.
Les mutations Y179C et G396D, présentes chez
environ 1 % de la population, représentent 80 %
des mutations pathogéniques de MUTYH retrou-
vées chez les sujets européens.
Jusqu’à présent, ces mutations de MUTYH ont été
étudiées majoritairement dans des cohortes de sujets
ayant une polypose colorectale ou des antécédents
familiaux de cancer colorectal, ce qui peut constituer
un biais induisant une surestimation du risque de
cancer colorectal lié à ces mutations. Or, une esti-
mation précise du risque de cancer colorectal et du
phénotype associé à ces mutations de MUTYH est
capitale pour le conseil génétique, la surveillance et
la prise en charge individuelle des patients.
Les auteurs de cette étude ont analysé les muta-
tions constitutionnelles Y179C et G396D du gène
MUTYH dans une population britannique (ethnie
européenne uniquement) de 9 268 patients atteints
de cancer colorectal (non exclus pour prédisposi-
tion génétique) et chez 5 064 sujets contrôles. Le
phénotype MSI était également déterminé. Ils ont
ensuite étudié le phénotype de ces patients, évalué
les corrélations génotype-phénotype et calculé le
risque de cancer colorectal spécifi que de chaque
génotype.
Une mutation biallélique était retrouvée chez 27 des
9 268 patients, soit 0,3 % : 4 mutations homozygotes
Y179C, 10 homozygotes G396D et 13 hétérozygotes.
Les patients porteurs d’une mutation biallélique
de MUTYH étaient signifi cativement plus jeunes
(54 ans versus 59 ans) et avaient plus fréquem-
ment une tumeur proximale (toutes étaient MSI)
et une polypose synchrone. Ils avaient également

Vasculature tumorale :
qui s’y frotte s’y pique ?
La Lettre du Cancérologue • Vol. XVIII - n° 9 - novembre 2009 | 451
plus fréquemment un apparenté au premier degré
atteint d’un cancer colorectal, mais ce de façon non
signifi cative. Les mutations homozygotes Y179C
étaient associées à un âge médian au diagnostic
plus jeune (49,5 ans) que les mutations homozygotes
G396D (57,9 ans) et les mutations hétérozygotes
(52,4 ans). La polypose synchrone n’était cependant
pas systématique et plusieurs patients avec mutation
biallélique de MUTYH n’avaient en l’occurrence
aucun polype associé. Enfi n, le risque de cancer
colorectal pour les patients porteurs d’une muta-
tion biallélique était multiplié par 28, car un seul
sujet contrôle était porteur d’une telle mutation.
Les mutations homozygotes Y179C étaient associées
à un risque plus important (multiplié par 56) que les
mutations G396D (risque multiplié par 19), ce qui est
sous-tendu par un âge plus jeune au diagnostic. Le
risque de cancer colorectal était fortement dépen-
dant de l’âge (multiplié par 115, 30 et 15 pour les
tranches d’âge de 40-49 ans, 50-59 ans et 60-69 ans,
respectivement), mais la pénétrance était incomplète
à l’âge de 60 ans (42,9 %).
Les mutations monoalléliques de MUTYH n’étaient
pas, quant à elles, associées à un risque augmenté
de cancer colorectal (2,2 % des cancers colorectaux
et 2,0 % des sujets contrôles), ni à un âge plus jeune
au diagnostic. Ces résultats étaient confi rmés après
analyse poolée des résultats de cette étude avec ceux
de 11 études cas-témoins antérieures réalisées chez
des patients non sélectionnés.
Cette étude, qui est la plus vaste réalisée à ce jour
en base de population, confi rme donc l’augmen-
tation du risque de cancer colorectal associé aux
mutations bialléliques de MUTYH, les mutations
Y179C conférant un risque plus important que les
mutations G396D. Cependant, elle montre que la
présence d’une polypose manque de sensibilité
pour identifi er les patients porteurs d’une mutation
biallélique.
Les auteurs de cette étude suggèrent qu’une
recherche de ces mutations peut donc raisonnable-
ment être faite chez les patients ayant un phénotype
de polypose atténuée quand une mutation du gène
APC a pu être écartée et en cas de diagnostic de
cancer colique proximal de phénotype microsatellite
stable (MSS) avant 50 ans, d’autant plus qu’il existe
a fortiori lorsque le patient a un parent au premier
degré atteint de cancer colorectal. Compte tenu du
risque élevé de cancer chez les sujets porteurs d’une
mutation biallélique, une surveillance coloscopique
apparaît justifi ée, ce qui n’est pas le cas en présence
d’une mutation monoallélique.
Références bibliographiques
1. Al-Tassan N, Chmiel NH, Maynard J et al.
Inherited variants of MYH associated with somatic
G:C→T:A mutations in colorectal tumors. Nat Genet
2002;30:227-32.
2. Sampson JR, Dolwani S, Jones S et al. Autosomal
recessive colorectal adenomatous polyposis due to
inherited mutations of MYH. Lancet 2003;362:
39-41.
3. Sieber OM, Lipton L, Crabtree M et al. Multiple
colorectal adenomas, classic adenomatous
polyposis, and germ-line mutations in MYH.
N Engl J Med 2003;348:791-9.
A. Lièvre,
hôpital Ambroise-Paré,
Boulogne-Billancourt
Les traitements
antiangiogéniques rendraient
les cellules tumorales plus
agressives
A
lors que les traitements antiangiogéniques
sont approuvés dans de nombreuses indica-
tions tumorales, la revue Cancer Cell, publie, dans
un même numéro paru cette année, deux rapports
intrigants sur les conséquences inattendues de ces
traitements sur des modèles précliniques de cancer.
Il apparaît en effet que des tumeurs traitées par
antiangiogéniques développent un phénotype
plus agressif avec des potentiels invasif et métas-
tatique accrus.
Ces résultats
pourraient bien
expliquer le gain
constant en survie
sans progression
observé avec ces
traitements en pratique clinique, et le faible gain
en survie globale. Par ailleurs, ils soulèvent de façon
plus inquiétante la question de la pertinence de
l’utilisation de ces composés en situation curatrice.
La première étude, coordonnée par une équipe
espagnole, montre que le ciblage de la voie de
signalisation de VEGF sur deux modèles différents a
certes une activité antitumorale, mais conduit aussi
à une adaptation tumorale qui se traduit par un
phénotype plus agressif (1). Les auteurs ont tout
d’abord traité des souris avec un anticorps anti-
VEGFR2 pendant 1 semaine, chez lesquelles avait
été greffé le modèle RIP1-Tag2 de tumeur neuroen-
docrine pancréatique. Après quelques semaines, les
tumeurs étaient réséquées, et leur agressivité était
quantifi ée par la détermination des proportions de :
» carcinome encapsulé non invasif ;
» carcinome micro-invasif ;
» carcinome hautement invasif.
Alors que le groupe contrôle n’avait que 6 % de
carcinomes hautement invasifs, les groupes traités
pendant 1 et 4 semaines en présentaient 54 % et
62,5 %, respectivement. Cet effet se maintenait
jusqu’à 3 semaines après cessation du traitement
et était encore plus marqué si la durée du traite-
ment était de 4 semaines. De façon rassurante, la
survie des souris traitées était tout de même légè-
rement supérieure à celle des souris non traitées
(16 versus 15 semaines). Les auteurs ont retrouvé
les mêmes résultats avec des souris chez lesquelles
était implanté le même modèle tumoral généti-
quement modifi é avec délétion du gène VEGF-A,
ce qui confi rme le rôle spécifi que de la voie de
signalisation de VEGF dans le développement de ce
phénotype tumoral agressif. Enfi n, les auteurs ont
montré que, chez les souris traitées par antiangio-
géniques, le taux d’envahissement des ganglions
lymphatiques péripancréatiques était 4 fois supé-
rieur à celui observé chez les souris non traitées.
Le nombre de métastases hépatiques, quant à
lui, avait presque triplé. Des résultats similaires
ont été reproduits avec le sunitinib, qui cible
non seulement VEGFR, mais aussi PDGFR. Enfi n,
l’étude de modèles orthotopiques de glioblas-
tomes a conduit aux mêmes conclusions. L’un des
mécanismes évoqués par
les auteurs pour expliquer
le phénotype tumoral plus
agressif observé est la
nette augmentation des
régions hypoxiques dans
les tumeurs traitées.
Les résultats de l’étude conduite par l’équipe cana-
dienne sont aussi très éloquents : ils montrent que
l’administration d’un traitement antiangiogénique
accélère l’évolution métastatique et réduit la survie
globale dans 2 autres modèles précliniques (2). Dans
cette étude, le choix pour le sunitinib, administré
de façon discontinue avec périodes d’interruption
reposait sur des données récentes suggérant que la
période d’interruption du traitement favorisait une
repopulation tumorale. Les auteurs ont choisi un
modèle expérimental de métastases avec injection
intraveineuse des cellules cancéreuses mammaires
humaines 231/LM2-4 exprimant la luciférase. Il s’est
avéré qu’un traitement de 7 jours par sunitinib, soit

452 | La Lettre du Cancérologue • Vol. XVIII - n° 9 - novembre 2009
ONCOLOGIE
TRANSLATIONNELLE
avant, soit après injection des cellules cancéreuses,
accélérait l’évolution métastatique, déterminée
par bioluminescence, et réduisait la survie globale
chez les souris traitées. L’administration d’autres
composés de la même classe que le sunitinib, tels le
sorafénib et le SU10944, a eu les mêmes résultats.
Dans un second temps, les auteurs ont implanté
puis réséqué des tumeurs issues des mêmes lignées
cellulaires, et ont administré aux souris un bref
traitement adjuvant par sunitinib. De la même
manière, ils ont retrouvé chez les souris traitées
une évolution métastatique plus agressive ainsi
qu’une survie globale diminuée comparativement
aux souris non traitées. Ils ont ensuite administré
un traitement antiangiogénique aux souris chez
lesquelles des cellules 231/LM2-4 avaient été
implantées dans la graisse mammaire. De façon
rassurante une fois de plus, le traitement avait une
activité antitumorale. En outre, les souris traitées
par sunitinib de façon prolongée avaient une survie
globale améliorée par rapport à celle des souris non
traitées. En revanche, la repopulation tumorale
était plus rapide au moment de la progression,
et la survie globale plus courte, lorsque les souris
étaient traitées par antiangiogéniques sur une
courte durée. Ces résultats ont été reproduits avec
la lignée cellulaire de mélanome MeWo.
Ces conclusions soulèvent de nombreuses questions,
retranscrites par S. Loges dans un article de synthèse
très bien rédigé, publié dans le même numéro
de Cancer Cell (3). En effet, même si certains
traitements antiangiogéniques – tel l’anticorps
bévacizumab ciblant VEGF en association avec la
chimiothérapie, ou les inhibiteurs de tyrosine kinase
comme le sunitinib ou le sorafénib – ont démontré
leur effi cacité en pratique clinique, les gains en
survie qu’ils procurent ne sont généralement que
de quelques mois. Tous ces traitements ne sont pour
l’instant indiqués qu’en situation métastatique.
Si les résultats des études précliniques présentées
ci-dessus concordent avec les données cliniques, il
semble en revanche plus inquiétant de constater
que le traitement antiangiogénique chez les souris
avant injection intraveineuse des cellules tumorales
montre une évolution métastatique plus sévère
et une survie globale réduite. Si on extrapole ces
résultats à la pratique clinique, il est à craindre que
l’administration d’un traitement antiangiogénique
en situation curatrice – comme en situation adju-
vante, par exemple – rende les cellules cancéreuses
réfractaires au traitement adjuvant plus agressives
et que la rechute métastatique soit encore plus
virulente qu’en l’absence de traitement. Alors,
faut-il s’inquiéter ? Nous ne le pensons pas, et ce
pour plusieurs raisons ; à notre connaissance, un
seul essai clinique évaluant un traitement antian-
giogénique en situation adjuvante a été rapporté
à ce jour : il s’agit du NSABP C-08, présenté par
N. Wolmark à l’ASCO cette année. Même si
l’ajout de bévacizumab à FOLFOX-6 ne semblait
améliorer ni la survie sans progression ni la survie
globale de patients opérés d’un cancer du côlon de
stade II ou III, il ne semblait pas être délétère non
plus. Voilà qui est rassurant. Par ailleurs, toutes les
études précliniques ayant évalué les effets des trai-
tements antiangiogéniques sur l’évolution naturelle
des cancers ne sont pas arrivées à ces mêmes conclu-
sions. Enfi n, la translation des résultats précliniques
en clinique n’est pas toujours évidente : il existe en
effet de nombreuses variables qui distinguent les
modèles précliniques utilisés dans ces 2 études de la
pratique clinique, comme le choix de la dose du trai-
tement antiangiogénique, la durée du traitement,
l’absence d’association avec une chimiothérapie,
etc. Ces variables expliquent sûrement une partie
des contradictions observées entre les résultats
des différentes études précliniques et incitent à
interpréter ces données avec précaution.
En conclusion, ces 2 études représentent une contri-
bution importante pour notre compréhension des
mécanismes d’action des traitements antiangiogé-
niques. Bien que quelque peu provocants, leurs
résultats ne doivent pas être un frein au développe-
ment de ces traitements en situation curatrice. Ces
études soulignent toutefois la nécessité pressante
de mettre en évidence des marqueurs d’effi cacité
(ou d’ineffi cacité) afi n de pouvoir sélectionner à
l’avenir les patients les plus à même de bénéfi cier
de ce type de traitement.
C. Le Tourneau,
Princess Margaret Hospital,
Toronto, Canada
Références bibliographiques
1. Paez-Ribes M, Allen E, Hudock J, Takeda T,
Okuyama H, Viñals F, Inoue M, Bergers G, Hanahan
D, Casanovas O. Antiangiogenic therapy elicits
malignant progression of tumors to increased
local invasion and distant metastasis. Cancer Cell
2009;15:220-31.
2. Ebos JM, Lee CR, Cruz-Munoz W, Bjarnason GA,
Christensen JG, Kerbel RS. Accelerated metastasis
after short-term treatment with a potent inhibitor
of tumor angiogenesis. Cancer Cell 2009;15:232-9.
3. Loges S, Mazzaone M, Hohensinner P, Carmeliet
P. Silencing or fueling metastasis with VEGF
inhibitors: antiangiogenesis revisited. Cancer Cell
2009;15:167-70.
1
/
5
100%