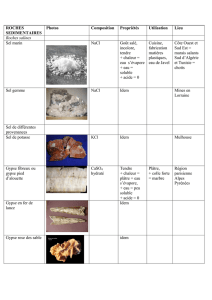
Materiaux-pigmentaires-a-base-de-4-VP-et-du-Mica.PDF

Laboratoire d’Application des Electrolytes et des Polyélectrolytes Organiques (LAEPO)
REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE
MINISTERE DE L’ENSEIGNEMENT SUPERIEUR
ET DE LA RECHERCHE SCIENTIFIQUE
UNIVERSITE ABOU-BAKR BELKAID- TLEMCEN
Faculté des sciences
Département de Chimie
Mémoire de Master en chimie
Option : Chimie Macromoléculaire
Présenté par :
BENSLIMANE Hanane
Matériaux pigmentaires à base de 4-VP et du Mica –
Etude de stabilité-
Soutenu à Tlemcen le 26 Juin 2016 devant le jury composé de :
Mme. BELKAID Soraya Maitre de Conférences B E.P.S.T Tlemcen Présidente
Mme. MEMOU Cherifa Hakima Maitre de Conférences B Université de Sidi Belabès Examinatrice
Mr. DERGAL Fayçal Maitre de Recherche B C.R.A.P.C Encadreur
Mr. MANSRI Ali Professeur Université de Tlemcen Co-Encadreur

Tous d’abord je remercie Dieu pour m’avoir donné la santé, le courage et la
volonté pour achever ce travail.
Ce travail de recherche a été réalisé au sein du laboratoire d’Application des
Electrolytes et des Polyélectrolytes Organiques (LAEPO) de l’Université Abou Bekr-Belkaid
de Tlemcen dirigé par Monsieur le professeur A.MANSRI.
Je tiens à remercier le Pr A. MANSRI Directeur du laboratoire d’Application des
Electrolytes et des Polyélectrolytes Organiques (LAEPO) de m'avoir accueilli au sein de son
laboratoire pour que je puisse améliorer mes connaissances et mon savoir faire.
J’adresse un grand remerciement à mon encadreur Dr F. DERGAL qui a proposé le
thème de ce mémoire et qui était tout le temps présent par ses conseils et ses explications.
Je tiens à remercier Mme S. BOUHADJAR Maitre de conférence « B » à l’école
préparatoire en sciences et techniques de Tlemcen, qui a bien voulu me faire l’honneur de
juger ce travail et de présider le jury de mon mémoire de Master. Je lui adresse mes
remerciements les plus respectueux.
Je tiens à remercier Mme C. MEMOU Maitre de conférence « B » à l’université
Djillali Liabès de Sidi Belabès d’avoir mobilisé de son temps pour examiner et juger ce
travail.
J'ai le plaisir de présenter mes sincères remerciements à toutes les personnes de loin
ou de près qui ont participé à me soutenir pendant toutes les étapes jusqu'à ce jour.
Finalement, j'aimerais bien remercier deux personnes qui sont la vraie lumière de ma
vie et qui ont partagé ce long chemin avec ses hauts et ses bas ; ces deux personnes se sont
mes parents.
Sans que j'oublie mes amis et mes proches.

A mes parents pour leur amour inestimable, leur confiance, leur soutien, leurs
sacrifices et toutes les valeurs qu’ils ont su m’inculquer.
A mes fréres et A mes sœurs ainsi qu’à mes beaux frères pour leur tendresse,
leur complicité et leur présence malgré la distance qui nous sépare
A mon oncle NOUALI Mostafa pour toute l’affection qu’il m’a donnée et pour
leurs précieux encouragements.
A tous ma famille ainsi qu’a mes amis

SOMMAIRE
INTRODUCTION GENERALE
……………………………………………………… 01
CHAPITRE I : Rappel bibliographique
I.1 Introduction…………………………………………………………………………..
04
I.2 Généralités sur le Mica……………………………………………………………… 05
I.2.1 Introduction au Mica……………………………………………………………….. 05
I.2.2 Types de Mica……………………………………………………………………… 06
I.2.3 Structure de Mica ……………………………………………………….................. 06
I.2.4 Caractérisations de Mica…………………………………………………………… 07
I.2.5 Applications du Mica………………………………………………………………. 10
I.3 Généralités sur le poly(4 -vinylpyridine)…………………………………………….. 10
I.3.1 Copolymérisation de poly(4-vinylpyridine)……………………………………….. 12
I.3.2 Quaternisation de poly(4-vinylpyridine)…………………………………………… 12
I.3.3 Polymerisation spontanée ………………………………………………………….. 13
I.3.4 Les applications de poly (4-vinylpyridine)(s)…………………………………….... 13
I.4 Généralités sur les colorants………………………………………………………….. 13
I.4.1 Histoirique des colorants……………………………………………………………. 13
I.4.2 Définition des colorants……………………………………………………………. 14
I.4.3 Nature des colorants………………………………………………………………… 14
I.4.4 Différence entre colorants et pigments……………………………………………… 16
I.4.5 Type des pigments…………………………………………………………………... 16
I.4.6 Applications des colorants…………………………………………………………… 17
I.5 Référence……………………………………………………………………………. 17
CHAPITRE II : Techniques expérimentales
II.1 Analyse thermogravimétrique ATG…………………………………………………... 20
II.2 La calorimétrie Différentielle à Balayage DSC ……………………………………….
21
II.3 La spectroscopie UV-visible………………………………………………………….. 23
II.4 La spectroscopie infrarouge à transformée de Fourier (IRTF)……………………….. 23
II.5 Potentiomètrie …………………………………………………………………………
24
II.6 Conductimétrie………………………………………………………………………... 25
II.7 Références……..……………………………………………………………………… 26
CHAPITRE III : Synthèses des matériaux composites par polymérisation in–situ de
la 4-vinylpyridine à la surface du Mica
III.1 Introduction…………………………………………………………………………... 27
III.2 Synthèses des matériaux composites………………………………………………….
28
III.3 Caractérisations des matériaux composites [P4VP@Mica] R=0.5 et R=1…………. 30
III.3.1 Caractérisations des matériaux composites par analyses Thermogravimétrique
ATG………………………………………………………………………………………..
31
III.3.2 Caractérisations des matériaux composites par Calorimétrie différentielle à
balayage DSC ……………………………………………………………………………... 33
III.3.3 Caractérisations des matériaux composites par Infrarouge à Transfer de Fourier
(IRTF)………………………………………………………………………………………
35
III.4 Etude de stabilité par conductivité et par potentiométrie…………………………….. 37
III.5 Conclusion…………………………………………………………………………….
43
III.6 Références……………………………………………………………………………
44

CHAPITRE VI : Fixation des colorants sur la surface des matériaux composites
IV.1 Introduction…………………………………………………………………………... 45
IV.2 Fixation des colorants sur la surface des matériaux composites……………………... 46
IV.3 Caractérisation des matériaux pigmentaires………………………………………… 51
IV.3.1 Caractérisations des matériaux pigmentaires par Analyses Thermogravimétrique
ATG………………………………………………………………………………………...
51
IV.3.2 Caractérisation des matériaux pigmentaires par Infrarouge à Transfer de fourrier
IRTF……………………………………………………………………………………….. 54
VI.4 Conclusion…………………………………………………………………………… 57
VI.5 Références………………………………………………………………………...... 58
CONCLUSION GENERALE
……………………………………………………………
59
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
1
/
71
100%