L Le cancer du canal anal ACTUALITÉ THÉRAPEUTIQUE EN ONCOLOGIE

ACTUALITÉ THÉRAPEUTIQUE
EN ONCOLOGIE
122 | La Lettre de l'Hépato-gastroentérologue • Vol. XX - n° 3 - mai-juin 2017
Coordonnée par le Pr T. Aparicio
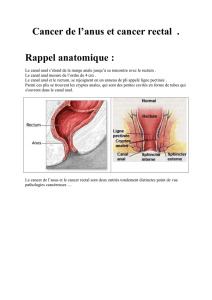
Le cancer du canal anal
Anal canal carcinoma
Anthony Lopez*
* Service d’hépato-gastro entérologie
et unité Inserm U954, CHRU de Nancy
et université de Lorraine, Vandœuvre-
lès-Nancy.
L
e cancer du canal anal (CCA) est une exception
dans le paysage de l’oncologie digestive à plus
d’un titre. Il ne représente que 2,2 % de l’en-
semble des tumeurs digestives (1), mais son incidence
est en constante augmentation depuis 30 ans (2). En
2012, on reportait 0,5 nouveau cas/100 000 hommes
et 1,3 nouveau cas/100 000 femmes (3). Contrai-
rement à la plupart des tumeurs digestives, les
carcinomes épidermoïdes sont majoritaires, repré-
sentant environ 80 % des cas (4). L’HPV (Human
Papillomavirus) joue un rôle central dans la carcino-
genèse, et il est retrouvé dans près de 85 % des cas
de CCA (5). Enfin, un traitement curatif est possible,
sans recourir à la chirurgie, puisque c’est dans cette
localisation qu’ont eu lieu les premiers essais rando-
misés validant la radiochimiothérapie (RCT), avant
même d’avoir testé la RCT sur l’adénocarcinome
rectal. Seuls 5 % des patients présentent des métas
-
tases au dia gnostic, et cette proportion oscille entre
10 et 20 % au cours de l’évolution de la maladie,
rendant la réalisation d’essais de phase III très diffi-
cile (6). Toutefois, l’optimisation du traitement du
CCA ne reste pas à la marge, avec des perspectives
notamment dans le champ de l’immunothérapie.
Dans cet article, nous exposons les données les plus
récentes concernant la prise en charge thérapeutique
du CCA, ainsi que les voies de recherche les plus
prometteuses.
Immunothérapie
Près de 90 % des CCA sont dus à une infection persis-
tante à HPV (5), notamment via ses oncoprotéines E6
et E7, qui jouent un rôle essentiel dans la transfor-
mation d’un épithélium normal en cancer invasif (7).
Cependant, celles-ci peuvent également stimuler
la réponse antitumorale de l’hôte en recrutant des
lymphocytes (8). Le CCA semble donc un candidat
potentiel pour l’immunothérapie. Deux études ayant
évalué l’efficacité des anti-PD1 (Programmed Death 1)
dans le CCA ont été publiées récemment.
La première était un essai de phase II monobras multi-
centrique qui a testé le nivolumab (3 mg / kg/ 2 sem.)
en monothérapie chez 37 patients porteurs d’un
CCA métastatique chimioréfractaire (9). Le nombre
médian de lignes de chimiothérapie antérieures
était de 2, et 86 % des patients avaient reçu des
sels de platine. Deux patients étaient VIH+. Le taux
de réponse objective était de 24 %, avec une durée
médiane de réponse de 5,8 mois. La médiane de
survie sans progression (SSP) et celle de survie
globale (SG) étaient respectivement de 4,1 et
11,5 mois. La tolérance était globalement satisfai-
sante sans aucune toxicité de grade > 3. Les effets
indésirables les plus fréquents étaient l’anémie, la
fatigue et le rash cutané (respectivement 70 %,
68 % et 30 %). Par rapport aux non-répondeurs,
les patients répondeurs avaient une proportion
plus élevée de lymphocytes T CD8+ (p = 0,011) et
granzyme B+ (p = 0,005). Plus de 40 % des cellules
tumorales des répondeurs exprimaient PD-L1
(Programmed Death-Ligand-1), contre 10 % pour
les non-répondeurs (p = 0,006).
Le deuxième essai est l’étude KEYNOTE-028, qui
a évalué l’efficacité du pembrolizumab (10 mg/
kg/2 sem.) chez 25 patients avec un CCA locale-
ment avancé ou métastatique exprimant PD-L1
sur au moins 1 % des cellules tumorales, en échec
de traitement (10). Dans cet essai de phase Ib
monobras, les critères de jugement principaux
étaient la tolérance et le taux de réponse. Plus de
la moitié (52 %) des patients avaient reçu au moins
2 lignes de traitement antérieurs. Le taux d’effets
indésirables liés au pembrolizumab était de 64 %,
les plus fréquents étant la diarrhée (16 %), la fatigue
(16 %) et les nausées (12 %). Aucune toxicité de
grade ≥ 4 n’était à déplorer. Concernant l’ef ficacité,
le taux de réponse objective était de 17 %, tandis
que 42 % des patients présentaient une stabilité
tumorale. Les médianes de SSP et de SG étaient
respectivement de 3 et 9,3 mois.
Au total, ces études préliminaires ont apporté des
signaux d’efficacité encourageants vis-à-vis de
l’immunothérapie dans le CCA localement avancé
ou métastatique en échec de traitement, mais ces
données doivent être confirmées dans des essais de
plus grande ampleur.

ACTUALITÉ THÉRAPEUTIQUE
EN ONCOLOGIE
La Lettre de l'Hépato-gastroentérologue • Vol. XX - n° 3 - mai-juin 2017 | 123
Optimisation de la
chimiothérapie dans les formes
localement avancées
En cas de CCA localement avancé, une RCT à
base de 5-fluorouracile (5-FU) et mitomycine C
(MMC) est recommandée par le TNCD (Thésaurus
national de cancérologie digestive) [6], d’après
les résultats de 3 essais de phase III publiés au
milieu des années 1990 (11-13). Le contrôle local
a ainsi été amélioré, mais sans impact sur la SG.
Plusieurs études ultérieures ont cherché à opti-
miser le protocole de chimiothérapie, soit pour
gagner en efficacité soit pour améliorer la tolérance.
Ainsi, même si l’essai RTOG 98-11 a montré que le
remplacement de la MMC par le cisplatine dimi-
nuait le taux de toxicité aiguë de grade 3-4 (passé
de 34 % à 20 %) [14], les résultats à long terme
favorisaient la MMC par rapport au cisplatine en
matière de survie sans maladie (SSM) [67,8 versus
57,8 % ; p = 0,006] et de SG (78,3 versus 70,7 % ;
p = 0,026) à 5 ans (15). Dans l’essai britannique
ACT II publié en 2013, une chimiothérapie de main-
tenance par 5-FU + cisplatine n’améliorait pas la
SSM à 3 ans par rapport à l’absence de traitement
(74 % et 73 %, respectivement ; p = 0,70) [16]. En
revanche, la substitution du 5-FU intraveineux par
la capécitabine orale est possible, même si cette
pratique repose sur des études de faible niveau
de preuve, à savoir un essai de phase II monobras
sur 31 patients (17) et une étude rétrospective sur
105 patients (18).
La place des thérapies ciblées dans le traitement des
CCA, en particulier celle des anti-EGFR (Epidermal
Growth Factor Receptor), reste en cours d’évalua-
tion. L’oncoprotéine E5 de l’HPV amplifie les signaux
promitotiques médiés par l’EGFR (19). Plus de 80 %
des CCA surexpriment le récepteur à l’EGFR et moins
de 5 % présentent des mutations de KRAS (20).
De plus, les anti-EGFR sont validés dans le traite-
ment d’autres tumeurs liées à l’HPV, comme les
carcinomes épidermoïdes ORL localement avancés,
en association avec la radiothérapie (21). L’étude
américaine de phase II monobras E3205 évaluait
l’intérêt de l’ajout de cétuximab à une RCT de type
cisplatine + 5-FU chez 61 patients porteurs d’un
CCA non métastatique (22). Seuls les 28 premiers
patients inclus avaient reçu 2 cycles de chimio-
thérapie néo-adjuvante de type cisplatine + 5-FU.
Le taux de récidive locorégionale à 3 ans (critère
de jugement principal) était de 23 %. À titre de
comparaison, ce taux était de près de 35 % dans les
essais pivots (13, 14). Concernant la tolérance, les
effets indésirables les plus fréquents étaient la diar-
rhée (68 %), la neutropénie (50 %) et les nausées
(32 %). Il y a eu 3 décès dont 1 possiblement lié
au traitement (insuffisance rénale et pneumopa-
thie). En France, rappelons que l’essai de phase II
ACCORD 16, au design similaire (5-FU + cisplatine +
cétuximab), avait été interrompu prématurément en
raison de la survenue de 15 effets indésirables graves
chez 14 des 16 premiers patients inclus (23). Seuls
5 patients avaient reçu la totalité du traitement
prévu. Les principales toxicités de grade 3/4 étaient
générales (81 %), digestives (56 %), cutanées (31 %),
infectieuses (25 %) et hématologiques (19 %). Les
résultats actualisés à long terme ont été publiés en
2015 (24). Le taux de récidive à 4 ans était de 47 %
(6 récidives locorégionales et 1 récidive à distance),
et la SG à 4 ans de 73 %. Pour rappel, le taux de
récidive à 5 ans était de 32 % dans l’essai de phase III
RTOG 98-11 (15). Un autre essai de phase I brésilien
évaluant le cétuximab en plus du 5-FU/cisplatine
avait été interrompu pour les mêmes raisons en
2013 (25).
Le panitumumab, autre anti-EGFR, a aussi été
testé dans plusieurs études, notamment l’essai de
phase II monobras espagnol VITAL dont les résul-
tats concernant la tolérance ont été communiqués
à l’ASCO 2014
®
(26). Sur les 36 patients analy-
sables, 92 % ont présenté des effets indésirables
de grade 3/4 (anémie, diarrhée et réactions cuta-
nées essentiellement). Les données d’efficacité
sont toujours en attente. En France, l’étude de
phase I/II FFCD 0904 évaluant le panitumumab en
plus d’une RCT à base de 5-FU + MMC est ouverte
aux inclusions (NCT01581840). Deux autres essais
testant l’efficacité des anti-EGFR dans le CCA
ont été quant à eux interrompus prématuré-
ment faute de recrutement (NCT01843452 et
NCT01382745).
Par rapport à la population générale, les patients
VIH+ ont 60 fois plus de risque de développer
un CCA (27). Dans une étude rétrospective
multicentrique comparant 40 patients VIH+ et
81 patients VIH–, le taux de contrôle local à 5 ans
apparaissait très inférieur en cas d’infection par le
VIH (38 versus 87 %, p = 0,008), sans pour autant
affecter la SG à 5 ans (61 versus 65 %, p = 0,2) [28].
Le taux de récidive locorégionale élevé chez les
patients VIH+ pourrait s’expliquer par une majo-
ration des toxicités sévères liées à la RCT, notam-
ment cutanées et hématologiques, à l’origine de
trai tements sub-op timaux (28). Récemment,
Sparano et al. ont publié les résultats de l’étude
AMC045, équivalent de l’étude E3205 mais dédiée

ACTUALITÉ THÉRAPEUTIQUE
EN ONCOLOGIE
124 | La Lettre de l'Hépato-gastroentérologue • Vol. XX - n° 3 - mai-juin 2017
Coordonnée par le Pr T. Aparicio
aux patients VIH+ (29). Les taux de récidive locoré-
gionale et de SG à 3 ans étaient respectivement de
20 % et 79 %. Cependant, la tolérance était assez
médiocre, avec 72 % de toxicités de grade 3-4
(essentiellement toxicité hématologique, diarrhées,
infections), et une mortalité attribuable au traite-
ment de 4 %. À notre connaissance, aucun autre
essai prospectif consacré aux patients VIH+ avec
un CCA n’a été publié.
Facteurs pronostiques
L’optimisation des traitements et la gestion des
toxicités semblent indispensables en cas de CCA.
En effet, une analyse post hoc de l’essai ACT II,
communiquée à l’ASCO 2015
®
, a montré que, en
cas de délai à la réalisation ou de réduction de dose
de la chimiothérapie à la cinquième semaine, la
survie sans récidive était significativement diminuée
(p = 0,001) [30]. De plus, en cas de récidive loco-
régionale, les résultats de l’amputation abdomino-
périnéale de “rattrapage” sont modestes, puisque
le taux de SG à 2 ans après chirurgie n’était que de
54 % dans l’étude ACT II (31).
La réponse clinique complète à la RCT constitue
un facteur pronostique notable. Dans une analyse
post hoc récemment publiée de l’essai ACT II, la SG
à 5 ans était de 59 % en cas d’absence de réponse
18 semaines après le début du traitement, contre
84 % en cas de réponse (32). Cependant, le taux de
réponse clinique complète augmentait à mesure que
l’on s’éloignait de la RCT, passant de 52 à 78 % entre
11 et 26 semaines après le début du traitement. Les
auteurs suggéraient donc d’effectuer l’évaluation de
la réponse au traitement néo-adjuvant 26 semaines
après son initiation, afin d’éviter des chirurgies de
“rattrapage” inutiles.
Chimiothérapie dans les formes
métastatiques
Le CCA est une tumeur rare, et les métastases à
distance concernaient 10 à 20 % des patients à
5 ans dans les groupes traités par RCT au sein des
études pivotales, rendant la réalisation d’essais
de phase III très difficile dans cette indication.
Le protocole de chimiothérapie recommandé en
première ligne repose sur une association de 5-FU
et de cisplatine (6), d’après les résultats d’une
étude rétrospective française sur 19 patients
avec un CCA métastatique, dans laquelle la
SG était de 32 % à 5 ans, avec une médiane de
survie de 34,5 mois (33). Divers protocoles ont
été rapportés dans la littérature, tels que cispla-
tine/MMC/adriamycine, bléomycine/vincristine/
méthotrexate, ou carboplatine/5-FU/pacli-
taxel (34). Les taux de réponse complète étaient
globalement inférieurs à 10 %, sauf pour le schéma
carboplatine/5-FU/paclitaxel où il atteignait
29 % (34). Les taxanes semblent intéres santes en
cas de CCA métastatique, car une chimiothérapie
de type DCF (docétaxel/cisplatine/5-FU), adminis-
trée chez 8 patients présentant une récidive locale
et/ou régionale et/ou à distance d’un CCA, était
associée à un taux de réponse complète de 50 %
et à une SG approchant les 3 ans (35). L’étude
multicentrique française de phase II EPITOPES
HPV02, évaluant l’efficacité du DCF en cas de
CCA métastatique ou localement avancé résistant
à la RCT, est actuellement en cours d’inclusion
(NCT02402842). L’essai international de phase II
InterACCT sera le premier essai randomisé dans
cette indication (NCT02051868). Il comparera
le cisplatine/5-FU au carboplatine/paclitaxel.
Le critère de jugement principal sera le taux de
réponse 24 semaines après la fin du traitement.
Quatre-vingts patients seront inclus pour des
résultats attendus en février 2018.
Vaccination
Par analogie avec le vaccin contre le HPV respon-
sable du cancer du col utérin, l’idée de la vaccina-
tion anti-HPV dans le cadre de la prévention des
lésions d’AIN (Anal Intraepithelial Neoplasia) s’est
récemment développée. Trois essais de phase III
ont démontré l’efficacité du vaccin quadrivalent
dans la prévention des infections persistantes à
HPV, des condylomes, de la survenue et de la réci-
dive des AIN (36-38). Cependant, aucun impact
sur le CCA n’a pu être démontré, faute d’événe-
ment. Aux États-Unis, la vaccination des filles et
des garçons entre 9 et 26 ans a été approuvée par
la Food and Drug Administration (FDA)-, dans le
cadre de la prévention des condylomes anaux,
des AIN et des CCA. En France, le vaccin anti-HPV
est seulement recommandé chez les filles entre
11 et 13 ans (2 doses à 6 mois d’intervalle), ou
en rattrapage entre 14 et 19 ans (3 doses à 0, 2
et 6 mois) [39]. En revanche, il est recommandé
de vacciner tous les patients VIH+ quel que soit
leur sexe, en plus d’un examen proctologique
annuel (40).

ACTUALITÉ THÉRAPEUTIQUE
EN ONCOLOGIE
La Lettre de l'Hépato-gastroentérologue • Vol. XX - n° 3 - mai-juin 2017 | 125
L’auteur déclare avoir des liens
d’intérêts : ABBVIE (interven-
tions ponctuelles, invitations
congrès), AMGEN (board,
invitations congrès), HOSPIRA
(droits d’auteurs), MSD (droits
d’auteurs, invitations congrès),
ROCHE (financement recherche),
SIMON-KUCHER & PARTNERS
(consulting), VIFOR-PHARMA
(interventions ponctuelles, droits
d’auteurs, invitations congrès).
Perspectives
Parmi les essais en cours dans le CCA, plusieurs
concernent l’immunothérapie. L’ADXS11-001 est
un vaccin thérapeutique consistant en une fusion
de la protéine E7 de l’HPV16 et de la protéine Heat
Shock 65 de Mycobacterium bovis. Il est actuelle-
ment testé dans une étude de phase I/II monobras
(NCT01671488), en association avec une RCT de
type 5-FU + MMC et avec une radiothérapie de type
IMRT (radiothérapie conformationnelle par modula-
tion d’intensité). Les résultats préliminaires communi-
qués en 2015 rapportaient une réponse complète et
sans récidive chez les 10 patients inclus (41). La greffe
autologue de lymphocytes anti-HPV, consistant à
prélever chez le patient atteint d’un CCA des lympho-
cytes intratumoraux, à les multiplier in vitro puis à
les réinjecter au patient, a été testée dans un essai
de phase II récemment terminé, dont les résultats
sont en attente (NCT01585428). Enfin, les nouvelles
techniques d’irradiation comme l’IMRT, permettant
de délivrer simultanément différentes doses dans
différents volumes, sont en cours d’évaluation dans le
CCA, avec l’espoir de réduire les toxicités. Dans l’étude
de phase II américaine, les inclusions se sont ache-
vées en décembre 2016, avec des résultats en attente
(NCT00423293). L’étude française CANAL-IMRT-01
est quant à elle en cours d’inclusion (NCT02701088).
Conclusion
Après la révolution majeure de la RCT il y a 20 ans,
le traitement du CCA localement avancé a peu
évolué. Le protocole de chimiothérapie reste le
même, à savoir une association de 5-FU et de
MMC, et la place des thérapies ciblées, notam-
ment les anti-EGFR, reste très débattue et en cours
d’évaluation. Cependant, les premiers résultats
concernant l’immunothérapie semblent promet-
teurs, même s’ils demandent à être confirmés.
Compte tenu de sa rareté et d’une proportion
tout aussi faible de patients métastatiques, la
conduction d’essais randomisés dans le CCA est
un véritable défi. Malgré tout, la première étude
de ce type est en cours, comparant cisplatine/5-FU
et carboplatine/paclitaxel (NCT02051868). En
France, les résultats d’EPITOPES HPV02, évaluant
l’efficacité du DCF, seront scrutés avec intérêt,
au vu de l’espoir généré par ce schéma thérapeu-
tique lors d’études prélimi naires (35). L’intrica-
tion entre infection à HPV et CCA devrait quant
à elle soulever la question d’une généralisation
de la vaccination anti-HPV aux 2 sexes. Enfin, la
rareté de cette maladie ne peut que nous inciter
à partager nos expériences, notamment en colli-
geant tous les cas incidents de CCA au sein de la
cohorte nationale ANABASE. ■
1. Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017. CA
Cancer J Clin 2017;67(1):7-30.
2. Nelson RA, Levine AM, Bernstein L et al. Changing patterns
of anal canal carcinoma in the United States. J Clin Oncol
2013;31(12):1569-75.
3. Binder-Foucard F, Bossard N, Delafosse P et al. Cancer
incidence and mortality in France over the 1980-2012
period: solid tumors. Rev Epidemiol Sante Publique
2014;62(2):95-108.
4. Flejou JF. An update on anal neoplasia. Histopathology
2015;66(1):147-60.
5. De Vuyst H, Clifford GM, Nascimento MC et al. Prevalence
and type distribution of human papillomavirus in carcinoma
and intraepithelial neoplasia of the vulva, vagina and anus:
a meta-analysis. Int J Cancer 2009;124(7):1626-36.
6. Moureau-Zabotto L, Abramowitz L, Borg C et al. “Cancer
du canal anal”. Thésaurus national de cancérologie digestive,
11-2016, [En ligne] http://www.tncd.org.
7. Balsitis SJ, Sage J, Duensing S et al. Recapitulation of the
effects of the human papillomavirus type 16 E7 oncogene
on mouse epithelium by somatic Rb deletion and detec-
tion of pRb-independent effects of E7 in vivo. Mol Cell Biol
2003;23(24):9094-103.
8. de Jong A, van Poelgeest MI, van der Hulst JM et al. Human
papillomavirus type 16-positive cervical cancer is associated
with impaired CD4+ T-cell immunity against early antigens
E2 and E6. Cancer Res 2004;64(15):5449-55.
9. Morris VK, Salem ME, Nimeiri H et al. Nivolumab for
previously treated unresectable metastatic anal cancer
(NCI9673): a multicentre, single-arm, phase 2 study. Lancet
Oncol 2017;18(4):446-53.
10. Ott PA, Piha-Paul SA, Munster P et al. Safety and anti-
tumor activity of the anti-PD-1 antibody pembrolizumab
in patients with recurrent carcinoma of the anal canal. Ann
Oncol 2017;28(5):1036-41.
11. Epidermoid anal cancer: results from the UKCCCR
randomised trial of radiotherapy alone versus radiotherapy,
5-fluorouracil, and mitomycin. UKCCCR Anal Cancer Trial
Working Party. UK Co-ordinating Committee on Cancer
Research. Lancet 1996;348(9034):1049-54.
12. Bartelink H, Roelofsen F, Eschwege F et al. Concomitant
radiotherapy and chemotherapy is superior to radiotherapy
alone in the treatment of locally advanced anal cancer:
results of a phase III randomized trial of the European Orga-
nization for Research and Treatment of Cancer Radiothe-
rapy and Gastrointestinal Cooperative Groups. J Clin Oncol
1997;15(5):2040-9.
13. Flam M, John M, Pajak TF et al. Role of mitomycin in
combination with fluorouracil and radiotherapy, and of
salvage chemoradiation in the definitive nonsurgical treat-
ment of epidermoid carcinoma of the anal canal: results
of a phase III randomized intergroup study. J Clin Oncol
1996;14(9):2527-39.
14. Ajani JA, Winter KA, Gunderson LL et al. Fluorouracil,
mitomycin, and radiotherapy versus fluorouracil, cisplatin,
and radiotherapy for carcinoma of the anal canal: a rando-
mized controlled trial. JAMA 2008;299:1914-21.
15. Gunderson LL, Winter KA, Ajani JA et al. Long-term
update of US GI intergroup RTOG 98-11 phase III trial for
anal carcinoma: survival, relapse, and colostomy failure
with concurrent chemoradiation involving fluorouracil/
mitomycin versus fluorouracil/cisplatin. J Clin Oncol
2012;30(35):4344-51.
16. James RD, Glynne-Jones R, Meadows HM et al. Mitomycin
or cisplatin chemoradiation with or without maintenance
chemotherapy for treatment of squamous-cell carcinoma
of the anus (ACT II): a randomised, phase 3, open-label, 2 x
2 factorial trial. Lancet Oncol 2013;14(6):516-24.
17. Glynne-Jones R, Meadows H, Wan S et al. EXTRA-a
multicenter phase II study of chemoradiation using a 5 day
per week oral regimen of capecitabine and intravenous
mitomycin C in anal cancer. Int J Radiat Oncol Biol Phys
2008;72(1):119-26.
18. Meulendijks D, Dewit L, Tomasoa NB et al. Chemora-
diotherapy with capecitabine for locally advanced anal
carcinoma: an alternative treatment option. Br J Cancer
2014;111(9):1726-33.
Références bibliographiques

ACTUALITÉ THÉRAPEUTIQUE
EN ONCOLOGIE
190 | La Lettre de l'Hépato-gastroentérologue • Vol. XX - n° 3 - mai-juin 2017
Coordonnée par le Pr T. Aparicio
19. Tsai TC, Chen SL. The biochemical and biological func-
tions of human papillomavirus type 16 E5 protein. Arch Virol
2003;148(8):1445-53.
20. Van Damme N, Deron P, Van Roy N et al. Epidermal
growth factor receptor and K-RAS status in two cohorts
of squamous cell carcinomas. BMC Cancer 2010;10:189.
21. Bonner JA, Harari PM, Giralt J et al. Radiotherapy plus
cetuximab for locoregionally advanced head and neck
cancer: 5-year survival data from a phase 3 randomised
trial, and relation between cetuximab-induced rash and
survival. Lancet Oncol 2010;11(1):21-8.
22. Garg MK, Zhao F, Sparano JA et al. Cetuximab plus
chemoradiotherapy in immunocompetent patients with
anal carcinoma: a phase II Eastern Cooperative Oncology
Group-American College of Radiology Imaging Network
Cancer Research Group trial (E3205). J Clin Oncol
2017;35(7):718-26.
23. Deutsch E, Lemanski C, Pignon JP et al. Unexpected
toxicity of cetuximab combined with conventional chemo-
radiotherapy in patients with locally advanced anal cancer:
results of the UNICANCER ACCORD 16 phase II trial. Ann
Oncol 2013;24(11):2834-8.
24. Levy A, Azria D, Pignon JP et al. Low response rate after
cetuximab combined with conventional chemoradiotherapy
in patients with locally advanced anal cancer: long-term
results of the UNICANCER ACCORD 16 phase II trial. Radio-
ther Oncol 2015;114(3):415-6.
25. Olivatto LO, Vieira FM, Pereira BV et al. Phase 1 study of
cetuximab in combination with 5-fluorouracil, cisplatin, and
radiotherapy in patients with locally advanced anal canal
carcinoma. Cancer 2013;119(16):2973-80.
26. Feliu J, Garcia-Carbonero R, Capdevila J et al. Phase II
trial of panitumumab (P) plus mytomicin C (M), 5-fluorou-
racil (5-FU), and radiation (RT) in patients with squamous
cell carcinoma of the anal canal (SCAC): safety and efficacy
profile—VITAL study, GEMCAD 09-02 clinical trial. J Clin
Oncol 2014;32(Suppl.):abstr. 4034.
27. Patel P, Hanson DL, Sullivan PS et al. Incidence of types
of cancer among HIV-infected persons compared with the
general population in the United States, 1992-2003. Ann
Intern Med 2008;148(10):728-36.
28. Oehler-Jänne C, Huguet F, Provencher S et al. HIV-spe-
cific differences in outcome of squamous cell carcinoma of
the anal canal: a multicentric cohort study of HIV-positive
patients receiving highly active antiretroviral therapy. J Clin
Oncol 2008;26(15):2550-7.
29. Sparano JA, Lee JY, Palefsky J et al. Cetuximab plus
chemoradiotherapy for HIV-associated anal carcinoma:
a phase II AIDS malignancy consortium trial. J Clin Oncol
2017;35(7):727-33.
30. Glynne-Jones R, Meadows HM, Sebag-Montefiore D et
al. Compliance to chemoradiation (CRT) using mitomycin
(MMC) or cisplatin (CisP), with or without maintenance
5-FU/CisP chemotherapy (CT) in squamous cell carcinoma
of the anus (SCCA) according to radiotherapy (RT) dose,
overall treatment time (OTT) and chemotherapy (CT) and
their impact on long-term outcome: results of ACT II. J Clin
Oncol 2015;33(Suppl.):abstr. 3518.
31. Glynne-Jones R, Meadows HM, Lopes A, et al. Salvage
surgery with abdominoperineal excision of the rectum
(APER) following loco-regional failure after chemoradia-
tion (CRT) using mitomycin (MMC) or cisplatin (CisP), with
or without maintenance 5-FU/CisP chemotherapy (CT)
in squamous cell carcinoma of the anus (SCCA) and the
impact on long-term outcomes: results of ACT II. J Clin Oncol
2016;34:(Suppl.):abstr 3523.
32. Glynne-Jones R, Sebag-Montefiore D, Meadows HM
et al. Best time to assess complete clinical response after
chemoradiotherapy in squamous cell carcinoma of the anus
(ACT II): a post-hoc analysis of randomised controlled phase
3 trial. Lancet Oncol 2017;18(3):347-56.
33. Faivre C, Rougier P, Ducreux M et al. [5-fluorouracile and
cisplatinum combination chemotherapy for metastatic squa-
mous-cell anal cancer]. Bull Cancer 1999;86(10):861-5.
34. Bustamante L, Frakes J, Hoffe S et al. Investigational
drugs for treating anal cancer and future perspectives. Expert
Opin Investig Drugs 2016;25(1):51-62.
35. Kim S, Jary M, Mansi L et al. DCF (docetaxel, cisplatin
and 5-fluorouracil) chemotherapy is a promising treatment
for recurrent advanced squamous cell anal carcinoma. Ann
Oncol 2013;24(12):3045-50.
36. Palefsky JM, Giuliano AR, Goldstone S et al. HPV vaccine
against anal HPV infection and anal intraepithelial neoplasia.
New Engl J Med 2011;365(17):1576-85.
37. Giuliano AR, Palefsky JM, Goldstone S et al. Efficacy of
quadrivalent HPV vaccine against HPV infection and disease
in males. New Engl J Med 2011;364(5):401-11.
38. Swedish KA, Factor SH, Goldstone SE. Prevention of
recurrent high-grade anal neoplasia with quadrivalent
human papillomavirus vaccination of men who have sex
with men: a nonconcurrent cohort study. Clin Infect Dis
2012;54(7):891-8.
39. http://inpes.santepubliquefrance.fr/10000/themes/
vaccination/calendrier/calendrier-vaccination.asp [accès
le 26/02/2017]
40. Vaccination des personnes immunodéprimées ou asplé-
niques. Recommandations (2e édition). Haut Conseil de la
santé publique, 2014.
41. Mayes G. Advaxis presents preliminary data from a
phase 1/2 trial of ADXSHPV in HPV-associated anal cancer
in combination with chemoradiation showing complete
response and no recurrences to date in all treated patients.
International Anal Neoplasia Society (IANS) Scientific
Meeting 2015:Mar 13-5; Atlanta, GA.
Références bibliographiques (suite page 125)
1
/
5
100%