A Réunion de l’Amicale des cardiologues de Paris I

Informations
Informations
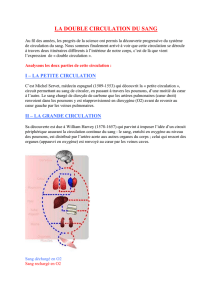
Figure 1.
Reconstruction
tridimensionnelle
pour une isolation
des veines
pulmonaires.
Abréviations :
LSPV = veine
pulmonaire
supérieure gauche ;
LIPV = veine
pulmonaire inférieure
gauche ; RSPV = veine
pulmonaire
supérieure droite ;
RIPV = veine
pulmonaire inférieure
droite.
La Lettre du Cardiologue - n° 411 - janvier 2008
14
Réunion de l’Amicale des cardiologues de Paris
et sa région sur la rythmologie interventionnelle
IPM.L. Lachurie*
Au cours de cette réunion de l’Amicale des cardiologues
de Paris et sa région, plusieurs thèmes ont été abordés,
notamment les risques de la voie endocavitaire pour
la fibrillation auriculaire (F. Hidden-Lucet) et pour la tricus-
pide (F. Jault) et les indications de la chirurgie des troubles du
rythme (N. Bonnet).
LES RISQUES DE LA VOIE ENDOCAVITAIRE
POUR LA FIBRILLATION AURICULAIRE
( F. Hidden-Lucet, rythmologie, La Pitié-Salpêtrière)
Rappel historique et technique
L’ablation de la fibrillation atriale (FA) voit le jour en 1998. On avait
constaté que les foyers arythmogènes près des veines pulmonaires
pouvaient être à l’origine de FA. On introduisait un cathéter dans
les veines pulmonaires (en faisant un transeptal) en enregistrant
les potentiels pathologiques : s’ils étaient présents, on procé-
dait à un deuxième transeptal pour réaliser une ablation par
radiofréquence des myocytes autour des veines pulmonaires et
obtenir la disparition de ces potentiels pathologiques. La meilleure
indication était la FA focale, mais le procédé était long car il y
a quatre veines pulmonaires : on les traitait deux par deux en
faisant une cartographie avec reconstruction tridimensionnelle
pour une isolation des veines pulmonaires (figure 1).
Le taux de succès de la procédure était augmenté par la déner-
vation vagale et lorsque la FA était paroxystique. Chez le sujet
âgé, la FA est le plus souvent chronique permanente : on fait des
lignes de radiofréquence complémentaires, et M. Haissaguerre
fait maintenant une défragmentation de l’oreillette. Dans une
étude publiée en 2005 par Haissaguerre sur 66 patients ayant
bénéficié d’une radiofréquence pour FA, le rythme sinusal est
restauré dans 87 % des cas après la première procédure, avec
36 % de récurrence au troisième mois.
Les complications de la radiofréquence de la FA (tableau I)
* Centre hospitalier du Montgardé, Aubergenville.
Tableau I.
Complications de l’ablation de la FA (Cappato R et al.
Circulation 2005;111:1100-5).
– Questionnaire/100 centres mondiaux faisant de l’ablation de FA 2002-2005
– 8 745 pts/90 centres, plusieurs procédures chez 27,3 %
– 6 % complication majeure :
n %
Mort péri-procédure (2 AVC, 1 perforation cardiaque, 1 cause inconnue)
4 0,05
Tamponnade 107 1,22
Sepsis, abcès, endocardite 1 0,01
Pneumothorax 2 0,02
Hémothorax 14 0,16
Paralysie phrénique permanente 10 0,11
Pseudo-anévrysme fémoral 47 0,53
Fistule A-V 37 0,42
Lésion valvulaire 1 0,01
Dissection aortique 3 0,03
AVC 20 0,28
AIT 47 0,53
Sténose VP aiguë/chronique 23/94 0,28/0,66
LC411-ok.indd 14 1/02/08 11:43:54

Informations
Informations
Survie sans récidive de FA (%)
78
37
p < 0,001
Eets indésirables (abl/méd) : 8 %/19 %
Survie (abl/méd) : 94 %/86 % p < 0,001
Groupe avec ablation
Groupe avec traitement
médical (méd)
100
80
60
40
20
0
0 180 360 540
Délai de suivi (jours) 720 900 1 080
Nombre de patients
Ablation 589 507 479 379 282 217 135
Traitement 582 456 354 277 207 141 97
médical
Figure 2. Comparaison traitement médical versus ablation dans la
prévention de la récidive de FA (Pappone C, Rosanio S, Augello G et al.
Mortality, morbidity and quality of life after circumferential pulmonary
vein ablation for atrial brillation: outcomes from a controlled
nonrandomized long-term stydy. J Am Coll Cardiol 2003;42:185-97).
La Lettre du Cardiologue - n° 411 - janvier 2008
15
On note 6 % de complications majeures : sténoses des veines
pulmonaires, tamponnades (patients sous anticoagulant), infec-
tions (sepsis, abcès, endocardite), thrombo-embolies (gazeuses)
et aussi hémothorax, paralysie phrénique, etc.
La limitation de la puissance délivrée lors de l’ablation a permis
de diminuer le risque de tamponnade, sans le supprimer. Concer-
nant le risque d’AIT et d’AVC, un antiagrégant plaquettaire en
complément de l’anticoagulation efficace n’a pas diminué le risque.
La paralysie phrénique s’explique par sa proximité avec les veines
pulmonaires ; elle est le plus souvent droite (0,48 % dans l’isole-
ment de la veine pulmonaire supérieure droite), plus rarement
gauche (suite à une application près de l’auricule gauche). L’évo-
lution se fait sans séquelles dans 66 % des cas, et dans 33 % des
cas on note la persistance partielle ou complète de la paralysie.
Les sténoses pulmonaires (complications graves) apparaissent
une à 48 semaines après la procédure, se manifestant par une
toux, une hémoptysie, une dyspnée, une douleur thoracique
(pour que le patient devienne symptomatique, il faut plusieurs
sténoses pulmonaires). Le traitement par dilatation se complique
de resténose et l’implantation de stent se complique de throm-
bose… La fistule atrio-œsophagienne est rare mais mortelle.
Elle se situe à l’endroit où l’on a fait des applications répétées
(surtout près de la veine pulmonaire supérieure gauche) : on
essaye de diminuer le risque en repérant l’œsophage, en diminuant
la durée des applications et en réduisant la puissance pour limiter
la profondeur de la lésion. Les tachycardies atriales gauches par
réentrée post-radiofréquence touchent 2,5 à 22 % des patients :
on recommence alors la procédure.
Ablation par radiofréquence pour qui ?
D’après l’étude de C. Pappone et al., le traitement de la FA par
radiofréquence est responsable de moins d’effets secondaires que ne
l’est le traitement médical (8 % versus 19 %), d’une survie améliorée
(94 % versus 86 %) et d’une plus grande efficacité (figure 2).
LES RISQUES DE LA VOIE ENDOCAVITAIRE
POUR LA TRICUSPIDE
( F. Jault, chirurgie thoracique et cardiovasculaire,
La Pitié-Salpêtrière)
Les complications sur la tricuspide en présence d’un pacemaker
(PM) ou d’un multisite sont essentiellement :
– infectieuses (nécessitant l’ablation du matériel par voie per-
cutanée ou chirurgicale et une antibiothérapie prolongée) ;
– thrombo-emboliques ;
– valvulaires : rétrécissement tricuspide (suite à une fibrose),
insuffisance tricuspide (IT) en dehors de toute atteinte infec-
tieuse.
F. Jault a insisté sur la nécessité d’évoquer une insuffisance
tricuspide chez des patients avec un PM en tableau clinique
de défaillance cardiaque à prédominance droite. L’échocardio-
graphie transœsophagienne préopératoire permet de constater
l’IT, mais son mécanisme n’est retrouvé que dans environ 45 %
des cas. Le traitement, qui nécessite une chirurgie tricuspide,
montre, en per-opératoire, des lésions à type d’adhérences et
de perforations (Ling G et al. JACC 2005).
LES INDICATIONS DE LA CHIRURGIE
DES TROUBLES DU RYTHME
( N. Bonnet, chirurgie thoracique et cardiovasculaire,
La Pitié-Salpêtrière)
Les troubles de la conduction
Le premier pacemaker (PM) extracorporel date de 1955 (P. Zoll
et W. Lillehei) ; le premier PM implanté par voie sous-épicar-
dique date de 1958 (P. Elmqvist et A. Sennig) ; par la suite, l’im-
plantation des PM s’est faite par voie endocavitaire. Il existe
cependant des indications pour lesquelles l’abord direct du
cœur pour stimulation en cas de bloc auriculoventriculaire est
nécessaire : en cas de problème de voie d’abord (thrombose cave
supérieure, anatomie particulière acquise ou congénitale) ou en
pédiatrie, en cas d’endocardite. Sur le plan technique, la voie
d’abord chirurgicale est une thoracoscopie, une thoracotomie
droite ou gauche, ou une sternotomie ; l’abord cardiaque est
épicardique ou endocardique ; il est possible de stimuler l’une
des cavités cardiaques. Dans le cas d’une endocardite sur sonde,
il peut s’agir d’une extraction simple ou sous CEC (échec de
l’extraction simple, végétation volumineuse ou nécessité d’un
geste chirurgical associé).
Dans l’implantation de multisite, on fait une mini-thoracotomie
antérieure gauche, un mapping du ventricule gauche. La voie
épicardique est choisie lorsqu’une chirurgie cardiaque combinée
par sternotomie est prévue (ce qui inclut les endocardites sur
sonde), ou en cas d’échec ou de contre-indication à la voie du
sinus coronaire. L’intérêt de la technique est d’augmenter le
nombre de patients effectivement resynchronisés, d’aller vers
une standardisation de la procédure multisite, et de rechercher
les facteurs prédictifs de difficultés techniques de la voie du
sinus coronaire.
LC411-ok.indd 15 1/02/08 11:43:55

Informations
Informations
YZhXgY^ihYZ;dgbVi^dcBY^XVaZ 8dci^cjZ
:Y^bVg`HVcikdjhegdedhZYZhG:KJ:HYZ;DGB6I>DC
$JcXdb^iYZgYVXi^dchX^Zci^ÒfjZZijcXdb^iYZaZXijgZfj^egdedhZciYZhVgi^XaZhh^\cheVgaZhVjiZjgh\VgVcih
YZaÉ^cYZmVi^dcVXXdbeV\chYZaZjghXddgYdccZh
$9Zhg[gZcXZhW^Wa^d\gVe]^fjZhhnhibVi^fjZbZciVeeZaZhYVchaZiZmiZ
$AVcdi^dcYZÆXdcÓ^iYÉ^cigiÆXaV^gZbZci^cY^fjZVÒcYZ\VgVci^gaÉdW_ZXi^k^i!aVfjVa^iZiaÉ^cYeZcYVcXZhX^Zci^ÒfjZ
YZhVgi^XaZhejWa^h
$JcZejWa^X^ik^hjZaaZZi$djgYVXi^dccZaaZYjbY^XVbZciZiYjbVig^ZabY^XVaeVg[V^iZbZci^YZci^ÒZ!
hVch^ciZggdbegZaVXdci^cj^iYÉjcVgi^XaZ
$AZhVgi^XaZhYÉdgYgZhX^Zci^ÒfjZZiY^YVXi^fjZXdchi^ijZciaÉZhhZci^ZaYjXdciZcjgYVXi^dccZa
C#7#AZWVgbZYZhXgY^ihYZ;B8ejWa^eVgaZb^c^higZYZaVHVci
YXgZiYj&(_j^aaZi'%%+!eVgjVj?djgcVad[ÒX^ZaaZ.Vdi'%%+egdedhZfjVigZ
XVi\dg^ZhYÉVXi^dcYZ;B8ZiYÉkVajVi^dcYZhegVi^fjZhegd[Zhh^dccZaaZhYdciaVXVi\dg^Z'!XdbegZcVciaZh[dgbVi^dch^cY^k^YjZaaZhZi|Y^hiVcXZji^a^hVci
idjihjeedgibVig^ZadjaZXigdc^fjZ!cdiVbbZciaZhVWdccZbZcih|YZheg^dY^fjZhdjaÉVXfj^h^i^dcYÉdjkgV\ZhbY^XVjm#
6WdccZo"kdjhZiWc[^X^Zo
<V\cZo)XgY^iheVgVcZckdjhVWdccVciYhbV^ciZcVci|jcZYZcdhejWa^XVi^dch
kd^gcdigZWjaaZi^cYÉVWdccZbZcieV\Z'*
AV[VXijgZdjjcZViiZhiVi^dckVa^YZgdcikdigZ;B8
BANDO FMC REVUE-L-Q.indd 1 1/02/08 10:41:06
Figure 3. Exclusion chirurgicale de l’auricule gauche (LAA).
La Lettre du Cardiologue - n° 411 - janvier 2008
16
Les troubles du rythme
Plusieurs techniques ont été proposées : thyroïdectomie, stellec-
tomie, chirurgie du Kent, ventriculotomie d’exclusion, chirurgie
• 276 procédures, dont 41 % combinées
– AC/FA paroxystique 58 %
– AC/FA permanente 42 %
• Résultats
– Mortalité opératoire 1,4 %
– Récurrence précoce AC/FA 44,6 %
– Trouble de conduction 16,7 %
• Long terme (6,0 ± 3,6 ans)
– Récurrence tardive AC/FA 7,8 %
– Traitement antiarythmique 20 %
• Échec corrélé durée de l’AC/FA préopératoire
Tableau II.
Résultats de l’ablation chirurgicale de la FA (AC/FA) par
sternotomie, puis section-suture des chemins électriques (Cox-
Maze III, RJ Damiano et al., JTCS 2005).
de la FA. La chirurgie de la FA garde essentiellement sa place
dans la chirurgie combinée, surtout dans la chirurgie valvulaire
mitrale, moins souvent dans les pontages aorto-coronaires, et
plus rarement dans la FA isolée (thoracoscopie, Cox-Maze,
exclusion de l’auricule gauche) [tableau II et figure 3]. ■
LC411-ok.indd 16 1/02/08 11:43:56
1
/
3
100%