Résistance génétique à la maladie hémorragique virale du

CNERA – Petite faune sédentaire de plaine
Rapport scientifique 2009sONCFS [ 11 ]
Exemple d’études et recherche
Résistance génétique à la maladie hémorragique virale du lapin
Il apparaît cependant que si Sec1 est fonctionnel, son activité
enzymatique est faible. Cette mutation n’est donc pas directe-
ment responsable du caractère résistant (
se
) des animaux. En
conséquence, c’est probablement la mutation d’un gène de
régulation de l’activité de Sec1 qui conduit à la faible expression
du gène responsable du caractère de résistance à la maladie. Alors
que chez l’homme des mutations peuvent inactiver totalement
le gène Fut2 et rendre les individus résistants aux NoV, chez le
lapin le gène Sec1 est toujours actif mais, sous l’action d’un gène
régulateur, produit une plus ou moins grande quantité d’enzyme
et donc de récepteurs cellulaires. Contrairement à l’homme ou les
individus sont sensibles ou résistants, chez le lapin les individus
sont plus ou moins sensibles selon le niveau d’expression de Sec1.
Depuis l’émergence de la RHD en France, le RHDV a évolué et
5 génogroupes se sont succédés depuis 1988, à l’image de ce qui a
été observé pour le calicivirus responsable de l’EBHS chez le lièvre
d’Europe. La présente étude a été réalisée avec un RHDV du géno-
groupe 1 qui se fixe sur l’antigène H type 2 du groupe sanguin. Les
travaux actuellement réalisés visent à déterminer sur quels antigènes
du groupe sanguin se fixent les virus des génogroupes 2 à 5. En outre,
un test génétique de détermination du groupe sanguin est en phase
de mise au point. Les récepteurs cellulaires de ces virus sont en effet
formés par les antigènes tissulaires du groupe sanguin. L’objectif est
de disposer d’outils pour suivre en parallèle l’évolution du virus et de
la diversité génétique des populations de lapins pour pouvoir prédire
la sensibilité des populations aux nouvelles souches virales. Une
extension de ce travail au modèle lièvre/EBHS est envisagée.
Références – Guillon P., 2008. Antigènes tissulaires du groupe sanguin ABH acteurs de la protection innée antivirale : exemples des calicivirus (NV et RHDV) et du coronavirus
SRAS-CoV. Thèse de doctorat, université de Nantes, 179 pp.
Guillon P., Ruvoën-Clouet N., Le Moullac-Vaidye B., Marchandeau S. & J. Le Pendu. 2009. Association between expression of the H histo-blood group antigen,
_ 1,2 fucosyltransferases polymorphism of wild rabbits, and sensitivity to rabbit hemorrhagic disease virus. Glycobiology 19: 21-28.
Dans le cadre du programme visant à étudier le modèle lapin/
maladie hémorragique virale (RHD : rabbit haemorrhagic disease),
un volet consiste à comprendre les mécanismes de sensibilité/
résistance des individus au virus. Ce travail est mené en partenariat
avec une équipe de l’Inserm (U892), spécialisée sur l’étude des
calicivirus humains.
Le RHDV est un calicivirus, famille à laquelle appartiennent aussi
les Norovirus (NoV) responsables d’épidémies de gastro-entérites
chez l’homme. Le mode de transmission de ces virus est similaire :
ingérés par la bouche, ils transitent par le système digestif et
pénètrent dans les cellules en se fixant sur des récepteurs cellulaires
présents à leur surface, puis s’y répliquent, provoquant la maladie.
Ils sont ensuite excrétés dans les fèces. Ces récepteurs sont les
antigènes tissulaires du groupe sanguin. Chez les mammifères trois
gènes sont impliqués dans leur synthèse : Fut1, Fut2 et Sec1. Chez
l’homme seul Fut2 s’exprime sur les cellules épithéliales du tube
digestif. Des mutations peuvent l’inactiver et rendre les individus
résistants à la maladie. Ces individus résistants sont non sécréteurs
(se), par opposition aux sécréteurs (Se) qui possèdent un récepteur
cellulaire. De précédentes études ont montré que les souches
de RHDV ayant circulé en France à la fin des années 1980 et au
début des années 1990 se fixent sur l’antigène H type 2 du groupe
sanguin. Le but de ce projet est de rechercher des mutations qui
pourraient inactiver les gènes Fut2 et Sec1, les deux gènes qui
s’expriment chez le lapin, et rendre les animaux résistants à la RHD,
à l’image de ce qui existe chez l’homme pour les Norovirus.
Des travaux préliminaires ont montré que la proportion de lapins se,
donc résistants, était plus forte dans les populations ayant subi de
fortes épidémies de RHD, ce qui suggère une pression de sélection
des individus exercée par la maladie (
tableau 1
).
Un suivi à long terme de la population de lapins de Chèvreloup (78)
a permis de réaliser des prélèvements génétiques sur les individus
présents avant et après une forte épidémie de RHD ayant causé une
mortalité de l’ordre de 80 à 90 %. Nous avons étudié la variabilité
allélique des gènes Fut2 et Sec1 pour rechercher d’éventuelles
mutations associées aux animaux ayant survécu à l’épidémie, donc
a priori résistants (
se
). Alors qu’une précédente étude réalisée à
partir de marqueurs microsatellites avait révélé une faible diversité
génétique dans cette population, ces gènes ont montré un fort
degré de polymorphisme ce qui suggère qu’ils sont soumis à une
forte pression de sélection positive. Les résultats mettent en outre en
évidence un processus de conversion génique entre les deux gènes.
La comparaison des fréquences alléliques entre les animaux morts
pendant l’épidémie et ceux y ayant survécu montre que l’allèle v5
de Sec1 est significativement plus fréquent chez les animaux ayant
survécu à l’épidémie (figure 1).
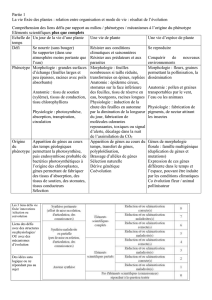
Population Proportion
de non-sécréteurs
Impact de la RHD
(taux de mortalité)
Dompierre/Yon
14,8 %
(n = 27)
0
Cerizay
47,1 %
(n = 70)
≈ 50 %
Chèvreloup
71,8 %
(n = 32)
≈ 90 %
Tableau 1. Pourcentage de phénotypes non-sécréteurs (se) dans trois popula-
tions de lapins différemment affectées par la RHD (taux de mortalité).
Figure 1. Comparaison des fréquences alléliques des gènes Fut2 et Sec1 entre les
lapins morts pendant une épidémie de RHD et ceux ayant survécu.
Allèles de Fut2
0,6
0,5
0,4
0,3
0,2
0,1
0
0,5
0,4
0,3
0,2
0,1
0
v1 v2 v4 v5 v7 v8 v9
vA vB vE vF vG
Morts Survivants
Morts Survivants
Fréquence
Fréquence
Allèles de Sec1
1
/
1
100%