Physiologie digestive 2e temps Word

1
Physiologie digestive 2ème temps : bloc
duodéno-pancréatique
I. Les sécrétions pancréatiques
1. Pancréas
2. Types de sécrétions.
3. Régulation de la sécrétion du suc pancréatique
4. Activité du suc pancréatique.

2
I. Les sécrétions pancréatiques
Nous arrivons au duodénum où vont se déverser les sécrétions pancréatiques. Les aliments du
bol alimentaire après les premières étapes de digestion vont prendre le nom de chyme. A ce
niveau, le chyme acide, expulsé par la vidange gastrique, va rencontrer en premier les sécrétions
pancréatiques et biliaires.
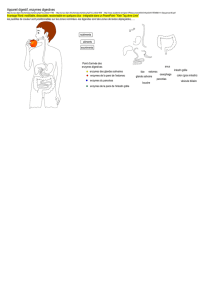
1. Le pancréas
Organe situé profondément enfoui dans l’abdomen, derrière l’estomac, devant et au-dessus des
reins. Formé d’une tête - enchâssée au niveau de la première anse duodénale -, d’un corps et
d’une queue. Le pancréas s’étend transversalement du duodénum jusqu’à la rate. Le canal de
Wirsung (excréteur) véhicule les sécrétions vers le milieu extérieur. Il s’abouche dans le
duodénum avec le cholédoque.
Les fonctions exocrines du pancréas sont la sécrétion d’enzymes pancréatiques au niveau
duodénale (lipases digérant les graisses, protéases) et des sécrétions de bicarbonates qui luttent
contre l’acidité gastrique.
La fonction endocrine est la sécrétion d’hormones (déversées directement dans le sang), assurée
par des cellules endocrines au niveau des îlots de Langerhans (1% du volume cellulaire du
pancréas), telles que l’insuline, la somatostatine et le glucagon.
Organe vital.
De nombreuses pathologies sont associées au dysfonctionnement du pancréas : diabète, cancer
très grave, pancréatite, mucoviscidose.
Mucoviscidose : anomalie de production de la protéine CFTR qui intervient dans le transport
Na/Cl, ce qui entrainera la formation d’un liquide épais qui va obstruer les glandes pancréatiques
empêchant une bonne excrétion, et par la suite une détérioration de son fonctionnement. Il y aura
donc une accumulation de mucus dans les acini, ce qui va provoquer leurs atrophie, cette
insuffisance de production des sécrétions pancréatiques va entrainer des problèmes d’absorption

3
des différents nutriments : sur le plan clinique, diarrhées chroniques avec des selles extrêmement
grasses à cause de la non-absorption des lipides accompagnée de dénutrition.
Le pancréas est une glande amphicrine (à la fois endocrine et exocrine). La fonction exocrine
(sécrétion d’enzymes) sera assurée par des cellules exocrines regroupées en acini dont chaque
canal fusionnera en canaux principaux pour parvenir jusqu’au canal pancréatique qui s’abouchera
avec le cholédoque au niveau de la première anse duodénale.
2. Le type de sécrétion
Le suc pancréatique (synthèse : 1.5 à 3L/24h ; la production dépasse celle des sécrétions acides)
a un pH basique (environ 8) et est composé de :
- 99% d’eau,
- 0.5% de substances minérales (ions bicarbonates et Ca2+) qui auront un rôle de tampon
du pH très acide du chyme provenant de l’estomac et d’ions calcium qui auront un rôle
d’activateur d’enzymes.
- 0,5% de substances organiques seront constituées par un grand nombre d’enzymes
(protéases, lipases).
Les enzymes pancréatiques vont faire le plus gros travail de digestion, initié d’une part par les
glandes salivaires en faible proportion et d’autre part par les sécrétions acides de l’estomac. Ces
enzymes sont produits par le pancréas sous forme inactive pour éviter la digestion des cellules
pancréatiques, on note (elle cite juste les enzymes mais ne va pas dans le détail) :
- Enzymes protéolytiques dégradant les protéines au sein de la chaine
carbonée notamment la trypsine, les endopeptidases. Des exopeptidases qui dégradent les
protéines à l’extrémité de la chaine carbonée : carboxypeptidase A et B, leucine
aminopeptidase.

4
- Des enzymes pancréatiques lipolytiques : lipase et colipase qui vont dégrader les
triglycérides, phospholipases (surtout A2) qui vont dégrader les phospholipides.
- Des enzymes glycolytiques : l’α amylase, enzyme que l’on retrouve au niveau
salivaire qui catalyse la coupure hydrolytique au niveau de la liaison α1-4 de l’amylose.
- Des enzymes nucléolytiques qui dégradent les nucléotides (les DNA, les ARN) :
ADNase et ARNase. Ces sont des phosphatases qui vont dépolymériser les chaines de
nucléotides au niveau des liaisons phosphates. Important au niveau du renouvellement
cellulaire.
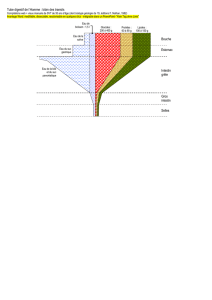
3. La régulation de la sécrétion du suc pancréatique
Cette sécrétion est liée à l’acte alimentaire. On va avoir une régulation nerveuse et une régulation
hormonale. Deux types de régulation qui vont agir de concert pour réguler la sécrétion du suc
pancréatique.
- Régulation nerveuse par le nerf X (nerf vague, nerf pneumogastrique). La
distension de l’estomac due à la présence d’aliments en son sein va provoquer, grâce aux
branches afférentes du nerf X au niveau de la paroi stomacale qui sont sensibles à la
distension de l’estomac, une stimulation du bulbe rachidien et des voies efférentes
(branches du nerf X qui innervent le pancréas). Ces branches vont stimuler la sécrétion
d’un suc pancréatique riche en enzymes. C’est le réflexe de distension de l’estomac.
- La régulation hormonale se met en route de manière plus lente. La stimulation de
la sécrétion du suc pancréatique sera exercée par la sécrétine (première hormone ayant été
identifiée).

5
La sécrétine est sécrétée par les cellules S situées au niveau de la muqueuse du tube digestif du
duodénum et du jéjunum.
Elle inhibe la production de gastrine, la production de suc gastrique de manière générale et rend
ainsi le pH de plus en plus alcalin pour favoriser l’activité des différentes enzymes pancréatique.
Elle inhibe également la motricité de l’estomac. « C’est une manière de dire à l’estomac que le
bol alimentaire n’est plus dans l’estomac et qu’il n’y a plus besoin de sécréter de suc gastrique. »
Elle stimule également, au niveau pancréatique, la production minérale. Le pancréas est riche en
ions HCO3- et la sécrétine intervient en particulier sur la stimulation de la production de l’ion
bicarbonate.
Résumé des 4 effets de la sécrétine :
1. Stimule la sécrétion minérale de suc pancréatique (ions bicarbonates) et par
conséquent d’augmenter le volume du suc pancréatique.
2. Effet inhibiteur sur la sécrétion gastrique en réprimant la sécrétion d’HCl.
3. Stimulation de la production d’insuline. « La sécrétine est une façon de prévenir
l’organisme de l’arrivée de nutriments et d’énergie, qu’il faut se préparer à les
utiliser ».
4. Effet trophique positif, augmente le taux de multiplication cellulaire.
Une autre hormone, la CCK PZ (cholécystokinine pancréatozymine), intervient également dans
la sécrétion du suc pancréatique et inhibe la production des sécrétions gastriques. Elle est produite
par les cellules I intestinales. Le facteur de production de CCK PZ est la présence de composés
nutritionnels (acides gras, peptone, acides aminé indispensables).
On a un effet croisé : le nerf X stimule la production de CCK par ces cellules I notamment au
niveau duodénal. La CCK stimule la production d’enzymes.
La CCK-PZ intervient en particulier dans la libération des grains de zymogènes mais également
en synergie avec les acini pour la production de sécrétine. Elle intervient donc dans la stimulation
de la production hydrominérale pancréatique.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%