D1_UE9_SEMIO_ADH_REGNIER_2016

UE 9 - Hormonologie, Reproduction!
REGNIER!
!
Promo : DFGSM3 Plage horaire : 10h30 – 11h30 date :
09/02/2016!
Ronéistes : Arthur Wind!
!
!
Sémiologie Clinique et Paraclinique de l’hormone
Anti-Diurétique (ADH)!
!
!
I – Rappels de physiologie!
II- L’ADH en pathologie!
• ADH insuffisante ou inactive = diabète insipide!
• Excès de sécrétion d’ADH = SIADH!
!
!
!
!
!
!
!
!
!
!
!
Dr REGNIER nous informe que les étiologies ne font pas partie du programme et qu’il ne faut pas
s’attarder dessus. En revanche, elle ajoute qu’il peut être intéressant de se pencher dessus
individuellement pour l’apprentissage de la sémiologie. A priori, il ne devrait pas y avoir de QCM
sur ces parties du cours.!
!
Note VP ronéo : N’ayant pas reçu le ronéo dans le bon format, j’ai essayé de remettre en page tant bien que
mal. Désolée, si y a des passages que vous trouvez pas très clairs. !
!
!
!
1

I – Rappels de physiologie !
!
L’ADH est l’hormone anti-diurétique : elle va « retenir l’eau ». C’est une hormone peptidique
sécrétée par l’hypothalamus. Elle est aussi appelée vasopressine.!
!
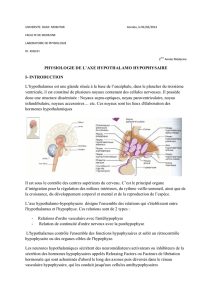
•L’hypothalamus!
Il a un rôle dans le contrôle endocrinien, contrôle de la faim, de la soif, et des émotions : les
neurones de l’hypothalamus produisent des neuro-hormones. !
On peut distinguer 2 types de neurones :
• Neurones magnocellulaires : ce sont de grands neurones à granules sécrétoires situés à la
partie antérieure de l’hypothalamus (noyaux paraventriculaire et supraoptique) qui
produisent l’ocytocine et l’ADH destinés à la posthypophyse.!
• Neurones parvicellulaires : ce sont de petits neurones à granules sécrétoires situés à la
partie postérieure de l’hypothalamus (noyaux hypothalamo-hypophysiotropes) qui
produisent les hormones qui contrôlent l’hypophyse antérieure.!
!
L’ADH est produite par l’hypothalamus antérieur, au niveau du corps du neurone. Elle est
transportée le long de l'axone puis « sécrétée » (déversée dans la circulation sanguine) au niveau de
la POST-hypophyse.!!
Elle décrit le schéma.!
Toute lésion de l'hypothalamus ou de l'hypophyse entrainera donc un problème de sécrétion d'ADH.!
!
•Rôles de l’ADH!
L’ADH voit ses rôles varier selon sa concentration.!
A faible concentration, elle aura une activité rénale (anti-diurétique) : elle réabsorbe de l'eau
(jusqu'à 10L d'eau par jour).!!
A forte concentration (conditions exceptionnelles) : activité de vasoconstriction. !
Notamment en conditions pathologiques (hémorragies…), l’ADH va être augmentée et jouer ce rôle
vasoconstricteur.!
!
L'hypothalamus détecte des variations de pression osmotique dans l'organisme et adapte sa
sécrétion d'ADH en fonction.!
Lors des grandes hémorragies, il y a une diminution de la pression dans les vaisseaux, et les
barorecepteurs de l'hypothalamus vont le stimuler afin qu'il se mettre à sécréter de l'ADH en très
forte quantité. L'ADH a des récepteurs sur la paroi des vaisseaux, et va entrainer la
vasoconstriction : la tension artérielle augmente.!
!
La synthèse d’ADH est régulée principalement par l’osmolarité plasmatique (rappel cf. plus loin),
en conditions physiologiques.!
!
!
2

•Un peu de chimie …rappel de 1ère et 2ème année!
!
L’osmolaRité est la concentration molaire de toutes les particules osmotiquement actives dans
un litre de plasma. !
!
L’osmolaLité est la même concentration rapportée au kg d’eau. Comme le plasma contient 930
ml d’eau, → Osmolarité = osmolalité mesurée x 0.93 !
!
L'osmolarité mesurée par le laboratoire de biochimie inclut toutes les substances osmotiquement
actives. !
En pratique médicale, l'osmolarité plasmatique est calculée (PcOsm) en faisant la somme des
trois principaux solutés (ionogramme sanguin): sodium, glucose et urée selon la formule :
PcOsm = (Na+ x 2) + glycémie + urémie(solutés exprimés en mmol/l).
!
L’osmolarité calculée normale est entre 285 et 295 mOsm/l. !
Sauf situations particulières, la différence entre osmolarité mesurée et osmolarité calculée est faible.
!
Le paragraphe suivant reprend ces notions en les développant un peu plus. La prof précise qu’on le
lit personnellement (dans 3 mois par exemple…) si on veut mais elle ne le commente pas en cours.!
La membrane cellulaire se comporte comme une membrane semi-perméable. Les mouvements
transmembranaires d'eau et d'électrolytes entre les secteurs extra- et intracellulaires régissent les
concentrations plasmatiques des électrolytes. Leur mesure est capitale pour le diagnostic et le traitement des
anomalies de l'hydratation. !
La concentration osmolaire totale d'une solution, ou osmolarité, est définie comme la somme des
concentrations molaires de tous les solutés qu'elle contient. L'osmolarité plasmatique (POsm) est
d'environ 295 mOsm/l. L'osmolalité plasmatique se définit comme la concentration des substances
osmotiques dans un kilogramme d'eau, exprimée en milli-osmole par kilogramme (mOsm/kg). Un litre de
plasma ne contient qu'environ 0,93 L d'eau, parce que les protéines et les lipides occupent un volume non
négligeable. En pratique, les concentrations des solutés sont mesurées par litre de solution (molaire), plus
que par kilogramme de solvant (molale). Les deux mesures sont si étroitement liées qu'aucune correction
n'est nécessaire, et c'est le terme d'osmolarité qui sera retenu pour la suite de l'exposé. L'osmolarité est
mesurée par le delta cryoscopique ou la résistivité plasmatique. L'osmolarité mesurée inclut toutes les
substances osmotiquement actives. !
En pratique, l'osmolarité plasmatique est calculée (PcOsm) et déterminée par la somme des trois
principaux solutés : sodium, glucose et urée selon la formule : !
PcOsm = (Na+ x 2) + glycémie + urémie (en mmol/l).!
PcOsm calculée est égale à 290 mOsm/l. !
La différence entre osmolarité mesurée et osmolarité calculée est faible. Lorsque cette différence est
supérieure à 10 mOsm.L-1, deux causes doivent être envisagées : ou bien un soluté non présent dans la
formule est présent dans le plasma, ou bien le contenu en eau du plasma diminue en raison de la présence en
quantité inhabituelle de substances normalement présentes. Le premier cas, le plus fréquent, correspond soit
à la présence de produits parfois ingérés dans un but suicidaire : alcool, méthanol, éthylène glycol, acétone
ou paraldéhyde, soit à l'accumulation de substances osmotiques (mannitol ou glucose) perfusées dans un but
thérapeutique. Dans le second cas, plus rare, il s'agit d'une hyperlipidémie ou d'une hyperprotéinémie
supérieure à 100 g.L-1. La concentration sérique de Na+ est alors inférieure à la normale et l'osmolarité
mesurée est normale. L'osmolarité calculée sous-estime alors l'osmolarité mesurée de plus de 10 à 15 mOsm/
l. !
L'osmolarité efficace (PeOsm) ou tonicité est définie comme la somme des concentrations molaires des
solutés osmotiquement efficaces. Elle peut être calculée par la même formule que l'osmolarité calculée,
après avoir enlevé l'urée, qui est diffusible au travers de la membrane cellulaire : !
PeOsm = (Na+ x 2) + glycémie (en mmol/l). !
En pratique, la répartition de l'eau dans l'organisme est sous la dépendance des variations de la seule
osmolarité efficace. Celle-ci rend compte des mouvements d'eau à travers la membrane cellulaire semi-
perméable et donc de l'hydratation des cellules. L'osmolarité extracellulaire est égale à l'osmolarité
intracellulaire, quel que soit le site de l'organisme. Un état d'hypertonicité se définit comme une
3

augmentation d'osmolarité efficace supérieure à 10 mOsm/l. Il peut être dû à une augmentation d'au moins 10
mmol/l de la concentration d'un soluté neutre ou à une augmentation d'au moins 5 mmol/l de la concentration
d'un cation et seul le cation Na+ peut augmenter de 5 mmol/l. En effet, l'augmentation des deux autres : K+
et Ca2+ de 5 mmol/l est incompatible avec la vie. Une hypernatrémie est toujours hypertonique parce qu'une
augmentation de Na+ supérieure à 5 mmol/l ne peut être compensée ni par une diminution d'un autre cation,
ni par une diminution du glucose. À l'inverse, une hypertonicité n'est pas nécessairement en rapport avec une
hypernatrémie, car elle peut être due à une augmentation de la concentration d'une substance neutre (glucose,
mannitol, glycérol).!
!
!
Les osmorécepteurs hypothalamiques sont très sensibles à des faibles variations (1%) de
l’osmolalité plasmatique. Quand l’osmolalité plasmatique augmente (« sang trop concentré »)
quand les apports d’eau sont inférieurs aux sorties, les osmorécepteurs envoient des signaux aux
cellules post-hypophysaires qui sécrètent alors rapidement l’ADH. On appelle « set-point » le seuil
d’osmolalité plasmatique à partir duquel la sécrétion d’ADH commence. Ce set point varie d’un
individu à l’autre entre 285 et 295 mOsmol/kg d’eau (280-295 sur la diapo).!
!
!
II – L’ADH en pathologie!
La subdivision suivante n’a pas forcément de pertinence en clinique : le patient ne va pas forcément venir en
disant « je n’ai pas assez d’ADH docteur… »!
!
• ADH insuffisante ou inactive = diabète (=fuite urinaire) insipide
(=d’eau)!
Signes cliniques : !
-POLYURIE ! POLYDYPSIE (en conséquence)!
- Polydipsie : augmentation de la consommation d'eau!
La diurèse peut aller de 3 L à 18 L par jour ! !
L’état général est conservé et absence de symptômes (osmolarité et natrémie plasmatiques
restent normales) si la polydipsie compense la polyurie. Le seul signe est les urines qui sont
diluées. !
/!\ Il peut y avoir une tendance à la déshydratation si les boissons ne compensent pas la
polyurie.!
-NYCTURIE!
La polyurie est aussi nocturne.!
Ce point permet de différencier le diabète insipide d’autres causes de polydipsies (ex : la
potomanie) puisque la nycturie n’est présente que dans ce tableau.
!
!
!
!
!
4

Signes biologiques : !
• Dilution des urines : !
• Densité urinaire < 1005!
• Osmolalité urinaire < 200 mosm/kg! !
Le test de restriction hydrique : ce test est le seul qui permet vraiment de poser le diagnostic de
diabète insipide. Cependant ce test n’est pratiqué que s’il y a besoin de confirmer le diagnostic de
diabète insipide (par exemple éliminer une polydypsie d’origine psychologique). Il n’est pas
toujours utile ! C’est compliqué, dangereux et pas évident à interpréter: il est fait uniquement à
l’hôpital sous surveillance +++.!
C’est une épreuve dynamique. On demande au patient d’arrêter de boire : !
• Les urines ne se concentrent pas (UOsm < 300 mOsm/kg).!
• La diurèse ne se réduit pas, ou insuffisamment.!
• Le patient se déshydrate : on surveille ++++ la perte de poids et la baisse de TA. !
• La natrémie s'élève et s'associe à des signes biologiques d'hémoconcentration (inflation de
l'hématocrite, de la protidémie, de l'uricémie).!
• Arrêt du test (cf. aussi diapo suivante) si perte de poids corporelle > 5%.!
• A la fin du test on dose l’ADH et on peut aussi injecter du MINIRIN®!
!
(Ronéo année dernière) Pour son interprétation, il faut que le dosage d’ADH soit fait au moment ou
l’osmolarité plasmatique est normale ou élevée (on essaie de voir si elle est capable d’augmenter
ou pas).!
!
A la fin du test on fait une injection d’ADH. Le dosage d’ADH et l’injection peuvent
permettre de différencier :!
• Un défaut de synthèse d’ADH !
• Taux plasmatique d’ADH est abaissé!
• L’administration d’ADH synthétique (MINIRIN®) (en fin de test) corrige les signes de
déshydratation (normalisation de l’osmolarité plasmatique et augmentation de l’osmolarité
urinaire)!
= Diabète insipide CENTRAL!
!
• Une inefficacité de l’ADH (pathologies génétiques par exemple)!
• Taux plasmatique n’est pas abaissé.!
• Le MINIRIN® ne corrige pas la déshydratation
= Diabète insipide NEPHROGENIQUE!
(anomalie des récepteurs à l'adh au niveau du rein)
!
!
!
!
5
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%