Télécharger

THEME 3 : MATERIAUX CHAPITRE 7 : CYCLE DE VIE DES MATERIAUX
PROTECTION DU FER
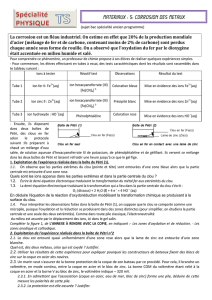
Matériel par poste :
. Montage électrolyse (voir schéma) + agitateur + plaque acier et zinc
+ éprouvette graduée 100mL + chronomètre
Matériel prof :
. 2L de solution acidifiée de sulfate de zinc saturée
. sèche-cheveux
rique, utilisée d ans l’habitation .
I – PROTECTION DU FER PAR ELECTROZINGAGE
De nombreux bâtiments sont recouverts de tôles d’acier zinguées. Le zinc protège l’acier contre la corrosion.
Deux techniques sont utilisées :
- la galvanisation, réalisée par immersion de la pièce en acier dans un bain de zinc fondu ;
- l’électrozingage, opération au cours de laquelle du zinc est déposé par électrolyse.
Vous allez réaliser cette seconde technique.
• Décaper soigneusement une plaque d’acier et une plaque de zinc avec du papier de verre.
• Peser soigneusement ces deux plaques avec une balance électronique :
mi(acier) = …………………….. g
mi(zinc) = …………………….. g
• Lors de l’électrolyse, la cathode est la plaque d’acier (siège d’une
réduction) et l’anode est la plaque de zinc (siège d’une réduction). La
solution d’électrolyte est une solution acidifiée de sulfate de zinc, Zn2+(aq) +
SO42-(aq), déjà préparée ; on en utilisera un volume égal à 80 mL. Une
agitation modérée de la solution électrolytique permettra d’avoir une solution
homogène.
1) Justifier le fait de relier la plaque de zinc à la borne + et la plaque d’acier à la borne -.
Indiquer sur le schéma: le sens du courant imposé par le générateur et le sens de
déplacement des électrons libres dans les parties métalliques du circuit.
• Mettre en marche le générateur (tension maximale) et déclencher le
chronomètre. Régler rapidement l’intensité à I = 0,45 A et l’ajuster
éventuellement pendant la durée de l’expérience.
Observer avec soin les phénomènes qui se produisent aux électrodes, en
particulier à la cathode. Noter les observations.
• Au bout de 15 min retirer les électrodes du montage. Les sécher
délicatement avec un papier absorbant et à l’aide du sèche-cheveux avant de
les peser de nouveau :
mf(acier) = …………………….. g
mf(zinc) = …………………….. g
2) Le seul couple mis en jeu lors de cette électrolyse est le couple Zn2+(aq)
/ Zn(s). Écrire la demi-équation électronique associée à chaque électrode
en utilisant ce seul couple rédox.
3) Justifier l’appellation d’électrolyse à « anode soluble » donnée à cette électrolyse.
4) Que peut-on dire de la concentration en ion Zn2+(aq) au cours de l’électrolyse ? Expliquer.
5) Déterminer les variations de masses m(acier) et m(zinc) de l’électrode d’acier et de l’électrode de zinc. Que
constate-t-on en première approximation ?
Infos :
La charge électrique Q qui a circulé entre les deux électrodes lors de l’électrolyse, lorsque le générateur à débité un
courant électrique d’intensité I pendant la durée t, est : Q = I×t avec Q en C, I en A et t en s.
Cette charge est liée à la quantité d’électron n(e-), en mol, ayant circulée par la relation: Q = Qm.n(e-) avec Qm la
charge transportée par une mole d’électrons : Qm = 9,65.104 C.
6) Déterminer la masse réelle de zinc mréelle(Zn) formée sur l’électrode en acier.
7) En détaillant la méthode utilisée, exprimer la masse théorique de zinc mthéo(Zn) formée sur l’électrode en acier en
fonction de I, t, Qm et M(Zn). Calculer mthéo(Zn) sachant que M(Zn) = 65,4 g.mol-1.
8) Proposer une ou des explication(s) à une éventuelle différence de masse entre mréelle(Zn) et mthéo(Zn).
9) En supposant que le dépôt de zinc sur la cathode est uniforme sur une seule face de surface S, déterminer l’épaisseur
de la couche de zinc déposée notée e(Zn), sachant que la masse volumique du zinc est ρ(Zn) = 7,1 g.cm-3.

THEME 3 : MATERIAUX CHAPITRE 7 : CYCLE DE VIE DES MATERIAUX
II – PROTECTION DE LA COQUE D’UN BATEAU
La corrosion est un phénomène bien connu des marins. Les bateaux dont la coque est en acier en sont
victimes et doivent en être protégés. Une méthode de protection consiste à poser à la surface de la coque
des blocs de métal que l’on appelle « anodes sacrificielles ».
L’objectif de l’exercice est d’évaluer, à l’aide des documents ci-après, la masse de l’anode sacrificielle nécessaire à la
protection d’un bateau.
Document 1. Le phénomène de corrosion
La corrosion d’un métal M est sa transformation à l’état de cation métallique Mk+ par réaction avec le dioxygène
dissous dans l’eau.
Le métal perd un ou plusieurs électrons, il est oxydé selon la demi-équation rédox : M Mk+ + k e-.
Une mole de métal oxydé produit k moles d’électrons.
Document 2. Potentiels standard de différents métaux
Pour prévoir les réactions d’oxydoréduction, on peut s’appuyer en première approche sur l’échelle
suivante, appelée échelle des potentiels standard. Tous les couples oxydant/réducteur peuvent être
classés par leur potentiel standard.
Échelle des potentiels standard de quelques couples à 20°C :
Élément
Couple
Potentiel standard (V)
Plomb
Pb2+ / Pb
-0,126
Étain
Sn2+ / Sn
-0,138
Nickel
Ni2+ / Ni
-0,257
Fer
Fe2+ / Fe
-0,447
Zinc
Zn2+ / Zn
-0,760
Aluminium
Al3+ / Al
-1,67
Magnésium
Mg2+ / Mg
-2,37
Lorsque deux métaux sont en contact et peuvent être oxydés par le dioxygène, c’est celui dont le couple a
le potentiel standard le plus faible qui s’oxyde : il constitue l’anode et protège l’autre métal qui ne réagira
pas.
Anode sacrificielle

THEME 3 : MATERIAUX CHAPITRE 7 : CYCLE DE VIE DES MATERIAUX
Document 3. Protection d’un bateau avec coque en acier
Lors de l’oxydation de l’anode sacrificielle, il s’établit un courant de protection au niveau de la surface S de la coque
immergée. Sa densité de courant moyenne, intensité de courant par unité de surface, vaut :
j = 0,1 A.m-2.
Ce courant a son origine dans la charge électrique échangée lors de la réaction d’oxydo-réduction.
L’intensité I d’un courant électrique peut s’exprimer en fonction de la charge électrique Q échangée au cours de la
réaction pendant une durée
t :
Q
It
où, dans le système international, I s’exprime en ampère (A), Q en coulomb (C) et t en seconde (s).
Résolution de problème
Questions préalables
Un bateau possède une coque en acier donc composée essentiellement de fer. Écrire la demi-équation de
l’oxydation du fer métallique en considérant uniquement les couples du document 2.
Citer en justifiant votre réponse, les métaux du tableau du document 2 susceptibles de protéger la coque en
acier d’un bateau. Pourquoi l’anode utilisée est-elle qualifiée de « sacrificielle » ?
Problème
On désire protéger pendant une année la coque en acier d’un bateau par une anode sacrificielle en zinc. La surface
de coque immergée dans l’eau de mer vaut S = 40 m². Une anode sacrificielle sur une coque de bateau doit être
remplacée quand elle a perdu 50 % de sa masse.
Quelle est la masse totale d’anode sacrificielle en zinc qu’on doit répartir sur la coque pour la protéger pendant une
année ? Exercer un regard critique sur la valeur trouvée.
Données :
Masse molaire du zinc : M = 65,4 g.mol-1
Une mole d’électrons possède une charge électrique q = 9,65×104 C
Remarque :
L’analyse des données, la démarche suivie et l’analyse critique du résultat sont évaluées et nécessitent d’être
correctement présentées.

THEME 3 : MATERIAUX CHAPITRE 7 : CYCLE DE VIE DES MATERIAUX
CORRECTION : PROTECTION DU FER
I – PROTECTION DU FER PAR ELECTROZINGAGE
• Masses initiales des plaques décapées :
mi(acier) = 94,95 g
mi(zinc) = 52,87 g
1) La cathode est la plaque d’acier : il s’y produit une réduction,
donc une consommation d’électrons. Les électrons doivent donc
arriver sur la plaque d’acier. Par conséquent la plaque d’acier est
reliée à la borne négative du générateur.
L’anode est la plaque zinc : il s’y produit une oxydation, donc une
libération d’électrons. Les électrons doivent donc partir de la
plaque de zinc. Par conséquent la plaque de zinc est reliée à la borne
positive du générateur.
• Conditions expérimentales :
Régler la valeur de l’intensité I avec le potentiomètre
t = 15 minutes = 15×60 = 900 s.
I = 0,45 A.
• Observations :
- Un dépôt gris se forme sur la plaque d’acier (cathode).
- Un dégagement gazeux se forme aussi autour de la plaque d’acier.
- Un léger dépôt noir se forme sur l’anode.
• Masses initiales des plaques décapées :
mf(acier) = 95,10 g
mf(zinc) = 52,71 g
2) À l’anode (oxydation) Zn(s) Zn2+(aq) + 2e- (la masse de l’anode diminue) ;
À la cathode (réduction) Zn2+(aq) + 2e- Zn(s) (la masse de la cathode augmente).
3) Il s’agit d’une électrolyse à « anode soluble » car au cours de l’expérience, le zinc de l’anode s’oxyde en ions zinc (II)
et passe donc en solution (solubilisation).
4) Lorsqu’un ion Zn2+(aq) est formé à l’anode, un autre ion Zn2+(aq) est consommé à la cathode : la concentration en
ion Zn2+(aq) au cours de l’électrolyse reste constante.
5) m(acier) = mf(acier) – mi(acier) = 95,10 – 94,95 = 0,15 g.
m(zinc) = mf(zinc) – mi(zinc) = 52,71 – 52,87 = - 0,16 g.
En première approximation : m(acier) - m(zinc) à 7 % près.
6) Expérimentalement : mréelle(Zn) = m(acier) = 0,15 g.
7) À la cathode : Zn2+(aq) + 2e- Zn(s) donc
Masse théorique de zinc mthéo(Zn) formée sur la cathode : mthéo(Zn) = n(Zn).M(Zn) =
(1)
Or : Q = I × t et Q = Qm.n(e-) donc I×t = Qm.n(e-) soit
(2)
En reportant (2) dans (1) il vient : mthéo(Zn) =
Comparaison :
donc les deux valeurs sont relativement proches.
8) Quelques explications pouvant expliquer l’écart :
o L’intensité I n’est pas restée parfaitement constante à 0,45 A pendant les 15 min.
o Séchage insuffisant des plaques.
o Incertitudes sur les pesées des masses.
o Dégagement gazeux réaction parasite.
I
I
e-

THEME 3 : MATERIAUX CHAPITRE 7 : CYCLE DE VIE DES MATERIAUX
9) En notant e(Zn) l’épaisseur du dépôt uniforme de zinc sur la surface S de la cathode, le volume V(Zn) de zinc formé
est alors : V(Zn) = S.e(Zn).
Or, ρ(Zn) = mréelle(Zn) / V(Zn) donc ρ(Zn) = mréelle(Zn) / (S.e(Zn)) soit :
En théorie, avec S = 4,0×5,0 = 20 cm2
II – PROTECTION DE LA COQUE D’UN BATEAU
Questions préalables
- Demi-équation d’oxydation du fer métallique : Fe = Fe2+ + 2 e–
- Métaux susceptibles de protéger la coque en acier :
Les métaux dont le potentiel standard est inférieur à celui du fer conviennent.
Il s’agit du zinc, de l’aluminium et du magnésium.
Ces métaux vont être oxydés à la place du fer.
Le métal protecteur est rongé, les atomes métalliques sont transformés en ions métalliques qui sont dissous.
Problème :
Déterminons d’abord la masse de zinc consommée en une année.
Comme nZn =
Zn
Zn
m
M
alors mZn = nZn.MZn
Équation d’oxydation du zinc de l’anode : Zn = Zn2+ + 2 e–
D’après cette équation nZn =
()ne
2
, donc mZn =
()ne
2
.MZn
La charge électrique échangée au cours de la réaction est : Q = n(e–).q où n(e–) correspond à la quantité de matière
d’électrons libérée par l’oxydation du zinc.
Ainsi n(e–) =
Q
q
, alors mZn =
.
Q
2q
.MZn
D’après I =
Qt
, on a Q = I.Δt.
Densité de courant : j = 0,1 A.m-2
Au regard des unités, on peut penser que j =
I
S
donc I = j.S ainsi Q = j.S.Δt Expression (2)
Finalement mZn =
.. .
.Zn
jS t M
2q
mZn =
, ( ) ,
,4
0 1 40 365 24 3600 65 4
2 9 65 10
= 4,27×104 g
Soit environ 43 kg de zinc consommé par an.
L’anode sacrificielle doit être remplacée lorsqu’elle a perdu 50 % de sa masse.
La masse totale de zinc à répartir doit être égale au double de la masse consommée.
mtotale = 2.mZn = 2×
, ( ) ,
,4
0 1 40 365 24 3600 65 4
2 9 65 10
mtotale = 8,5×104 g = 85×103 g = 85 kg.
On doit garder un seul chiffre significatif (cf. j = 0,1 A.m-2) donc mtotale = 9×101 kg.
Il faut donc répartir 9×101 kg de zinc sur la surface de la coque.
Ce résultat semble élevé, la photo montre une anode sacrificielle qui semble assez petite. Il y a sans doute plusieurs
blocs de zinc répartis sur la coque.
1
/
5
100%