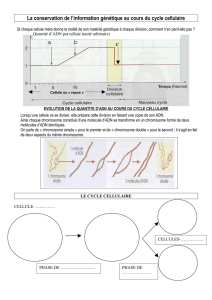
Lire l`article complet

28 | La Lettre du Gynécologue • n° 347 - décembre 2009
Les pertes fœtales précoces
DOSSIER
Étude de la fragmentation
de l’ADN spermatique et
des aneuploïdies spermatiques
en cas de fausses couches
à répétition
Sperm DNA damage and aneuploidy studies in recurrent
pregnancy loss
P. Clément*, I. Hammoud**, D. Molina Gomes**, M. Albert**, J. Selva**, F. Vialard**
* Laboratoire Clément, 8, avenue Henri-
Barbusse, 93110 Le Blanc-Mesnil et
17, avenue d’Eylau, 75116 Paris.
** Laboratoire de biologie de la repro-
duction, cytogénétique et génétique
médicale, CHI Poissy-Saint-Germain,
10, rue du Champ-Gaillard, 78303
Poissy Cedex. EA2343, université de
Versailles-Saint-Quentin-en-Yvelines,
78000 Versailles.
E
n cas de fausses couches (FC) à répétition, les
causes génétiques féminines d’infertilité sont
plus fréquentes en raison principalement des
aneuploïdies ovocytaires. Or, il existe également
des causes génétiques masculines qui peuvent être
regroupés en deux grands types d’anomalies.
➤
Les aneuploïdies spermatiques, avec les anoma-
lies de nombre des chromosomes et les anomalies
de structure des chromosomes. Si les premières sont
souvent de novo, les secondes peuvent être soit
de novo, soit, le plus souvent, due à une anomalie
cytogénétique constitutionnelle de l’individu. Il est
aujourd’hui admis qu’environ 10 % des spermato-
zoïdes de sujets normaux sont porteurs d’anoma-
lies chromosomiques (réparties en 3 % d’anomalies
numériques et 7 % d’anomalies de structure) et la
répartition des aneuploïdies reste homogène parmi
tous les chromosomes (1).
➤
Les altérations de la structure de l’ADN, avec un
ADN fragmenté ou mal “empaqueté” conduisant à
une absence d’expression dans les premiers stades de
développement ou à des fausses couches spontanées
(FCS) à plus long terme.
L’objectif de cette revue est de faire le point sur les
connaissances actuelles, et des résultats prélimi-
naires obtenus par le GEMA (Groupe d’étude des
maladies abortives) pour connaître les étiologies
des FCS à répétition.
Aneuploïdies spermatiques
Les taux d’aneuploïdies spermatiques restent bien
inférieurs à ceux observés lors de l’ovogenèse. Néan-
moins, il existe différentes catégories de patients
où ces taux augmentent : les patients ayant une
altération de la spermatogenèse et un caryotype
normal et les patients porteurs d’un remaniement
chromosomique.
Patients à caryotype normal
Les patients à caryotype normal et ayant une alté-
ration de la spermatogenèse sont connus comme
étant des patients à risque d’aneuploïdie fœtale
augmenté (2). Cette augmentation est due à une
incidence des aneuploïdies spermatiques plus élevée
chez les patients infertiles que chez les sujets fertiles.
Selon les études, le taux d’aneuploïdie varie chez les
patients infertiles de 33 à 74 % contre une varia-
tion de 4 à 8 % chez des patients témoins fertiles
et normospermiques (3).
De plus, certaines anomalies morphologiques sper-
matiques, comme la macrocéphalie, sont reconnues
comme étant associées à un haut risque d’anomalies
chromosomiques, y compris pour les spermatozoïdes
non macrocéphales (4).

La Lettre du Gynécologue • n° 347 - décembre 2009 | 29
Résumé
Dans le protocole GEMA, il a été décidé d’étudier
systématiquement les caractéristiques spermatiques
mais aussi les taux d’aneuploïdies pour savoir si les
patients de couple ayant des FCS à répétition et un
caryotype normal n’étaient pas une population à
risque d’une augmentation du taux d’aneuploïdie
spermatique.
Pour cela, nous avons utilisé la technique d’hybrida-
tion fluorescente in situ sur sperme (sperm-FISH),
avec l’utilisation de sondes fluorescentes, méthode
de choix pour l’étude et l’évaluation des aneuploïdies
dans le sperme humain. Actuellement, nous avons
pu analyser le sperme de plus de 80 patients. Les
premiers résultats, en analysant les chromosomes
X, Y et 18, semblent montrer une augmentation du
taux d’aneuploïdie des spermatozoïdes (p < 0,0005)
chez ces patients avec un taux d’anomalies sper-
matiques pour les chromosomes analysés à 0,9 %
par rapport à une population de patients témoins
normospermiques (n = 11) ayant eu au moins une
grossesse évolutive et où ce taux est de 0,6 %.
En revanche, si l’on considère que le taux de 1 % (en
analysant les X, Y et 18) constitue la limite au-delà
de laquelle un patient présente une augmentation
du risque d’aneuploïdie spermatique, la proportion
d’individus ayant plus de 1 % de spermatozoïdes
aneuploïdes est de 18 % chez les témoins et de 26 %
chez les patients ayant des FCS (différence non signi-
ficative). On observe par ailleurs 5 % de patients
ayant plus de 2 % de spermatozoïdes aneuploïdes,
situation jamais retrouvée pour les patients témoins.
Patients porteurs d’un remaniement
chromosomique équilibré (figure 1)
Parallèlement, nous avons évalué, chez les patients
porteurs d’un remaniement chromosomique (caryo-
type constitutionnel anormal) dont la conjointe a eu
des FCS, le risque de malségrégation chromosomique
dans les spermatozoïdes. Ce risque est associé à une
augmentation de la probabilité d’avoir un enfant
porteur d’un syndrome malformatif avec retard
mental et/ou de FCS précoces et/ou d’un arrêt du
développement embryonnaire précoce, aboutissant
in fine à un certain degré d’hypofertilité pour les
couples concernés.
L’étude de la ségrégation des chromosomes réalisée
sur les spermatozoïdes permet d’apprécier l’inci-
dence des déséquilibres chromosomiques et, en
fonction de la taille des fragments impliqués dans
le remaniement chromosomique, d’évaluer les
risques d’échec d’implantation, de FC précoce ou
de naissance d’un enfant présentant un déséquilibre
chromosomique, en sachant que plus le remanie-
ment concerne des fragments de petite taille, plus
le risque augmente.
Classiquement, on distingue trois grands types de
remaniements chromosomiques :
– les translocations réciproques ;
– les translocations robertsoniennes ;
– les inversions péri- ou paracentriques.
◆Translocations réciproques
L’étude de la ségrégation des spermatozoïdes
humains est désormais réalisée par la technique
sperm-FISH, à l’aide de trois sondes : une ou deux
sondes centromériques et une ou deux sondes télo-
mériques (figures 2 et 3).
Le taux de déséquilibre varie, selon le type de
translocations, entre 18,6 % (14) et 93,4 % (3,48),
avec, en moyenne sur l’ensemble des translocations
analysées, un taux proche de 50 %. Actuellement,
dans notre population de patients GEMA, les taux
d’aneuploïdies sont comparables avec une moyenne
également proche de 50 %. Au total, la technique
L’étude génétique des spermatozoïdes des patients dont le couple présente des fausses couches à
répétition consiste en l’étude des aneuploïdies et de la fragmentation de l’ADN. À coté des patients
porteurs d’une anomalie chromosomique et dont l’étude de la ségrégation des spermatozoïdes doit
être évaluée, on observe une légère augmentation des taux d’aneuploïdies des spermatozoïdes et de la
fragmentation de l’ADN. Ces augmentations sont particulièrement importantes pour certains patients qui
doivent être identifiés. Enfin, l’augmentation de la fragmentation de l’ADN pourrait être corrélée à des
anomalies morphologiques identifiables en observant les spermatozoïdes à un très fort grossissement.
Mots-clés
Sperm-FISH
Fragmentation de
l’ADN
Translocation
Ségrégation
MSOME
Figure 1. Caryotype masculin montrant une trans-
location équilibrée 46,XY,t(11;22 ; q12;q12). Les
dérivés du chromosome 11 (der11) et du chro-
mosome 22 (der22) sont pointés par les flèches.
Key messages
Spermatozoa genetic study for
patient with recurrent miscar-
riage consists to aneuploidy
screening and DNA fragmen-
tation evaluation. For patient
heterozygote for a chromosome
rearrangement, spermatozoa
segregation must be evaluated
for genetic counselling. For
patient, with normal karyotype,
we observe a slight increase of
spermatozoa aneuploidy and
DNA fragmentation rates,
particularly increase for few
patients who must be identi-
fied. Furthermore, DNA frag-
mentation rate increase could
be correlated to morphological
abnormalities identified using
the motile sperm organelle
morphology examination.
Keywords
sperm-FISH, DNA
fragmentation, translocation,
segregation, MSOME.

30 | La Lettre du Gynécologue • n° 347 - décembre 2009
Les pertes fœtales précoces
DOSSIER
sperm-FISH permet d’apprécier les taux de déséqui-
libre et d’évaluer le risque des grossesses conduisant
à un arrêt méiotique. La problématique repose sur
l’incapacité des généticiens à définir actuellement
un risque théorique sans avoir recours à la FISH, les
résultats entre translocations variant en fonction
des segments impliqués.
◆Translocations robertsoniennes
(figures 4 et 5)
Ces translocations, les plus fréquentes dans la popu-
lation générale (2 ‰), sont dues à un processus de
fusion centromérique entre chromosomes acrocen-
triques (13, 14, 15, 21, 22).
À l’inverse des patients porteurs de translocation
réciproque, les résultats d’analyse gamétique sont
plus homogènes, avec environ 15 % de spermato-
zoïdes porteurs d’un remaniement chromosomique
déséquilibré (5, 6). Ces analyses ont principalement
été réalisées chez des patients infertiles (oligosper-
miques) porteurs de translocations rob(13 ;14) et
rob(14 ;21).
Le diagnostic de translocation robertsonienne est
parfois réalisé de façon fortuite, suite à une étude
familiale lors de la découverte de l’anomalie en
diagnostic prénatal. Dans ce cas, les patients sont
souvent normospermiques et il est possible que
les taux de ségrégation varient en fonction de la
numération spermatique ou du contexte clinique.
De plus, il n’est pas certain que les taux soient iden-
tiques pour les autres types de translocations robert-
soniennes différentes des rob(13 ;14) et rob(14 ;21).
Figure 2. Étude de la ségrégation d’une translocation réciproque par sperm-FISH.
Figure 3. Analyse par FISH des métaphases avec les sondes spécifiques (a) décrites en (h) et avec la sonde de peinture du chromo-
some 11 (b). Analyse de la ségrégation chromosomique dans les spermatozoïdes par sperm-FISH, avec une ségrégation normale (c
: 11/22 ou der11/der22), une ségrégation adjacente 1 (d : der11/22 et e :11/der22), une ségrégation adjacente 2 (f : 11/der11) et une
ségrégation 3 : 1 (g : 22). h : schéma montrant la translocation et les sondes spécifiques utilisées pour l’analyse des spermatozoïdes
avec en bleu, le centromère du chromosome 11, en rouge, la sonde Tuple1 en 22q11.2 et en vert, la sonde ARSA en 22q13.3 ; en mauve,
les fragments transloqués.

La Lettre du Gynécologue • n° 347 - décembre 2009 | 31
DOSSIER
◆Inversions
Il existe deux types d’inversions, les péricentriques et les
paracentriques, selon que les points de cassures sont
de part et d’autres du centromères (péricentrique) ou
sur un même bras chromosomique (paracentrique).
➤Inversions péricentriques (figures 6 et 7)
Les études réalisées sur le sperme de porteurs d’in-
versions péricentriques font apparaître une grande
hétérogénéité dans les pourcentages de déséquilibres
méiotiques (de 0 à 37 %). Il semblerait cependant
que l’incidence de spermatozoïdes déséquilibrés
soit liée à la proportion du segment inversé et de sa
taille. Ainsi, le risque devient important si le segment
représente plus de 50 % de la taille du chromosome
et s’il fait plus de 100 Mb (7, 8).
Nous avons montré que l’inversion péricentrique
dite classique du chromosomes 2 : inv(2)(p11q13),
fréquemment retrouvée dans la population générale,
n’était pas associée à un risque accru de FCS et que,
dans ce cas, le recours au diagnostic prénatal en cas de
grossesse devait être discuté avec les patients de façon
des plus rassurante quant au risque de transmission
d’un anomalie chromosomique déséquilibrée (9).Références
bibliographiques
1. Pellestor, F. Differential distri-
bution of aneuploidy in human
gametes according to their sex.
Hum Reprod 1991;6(9):1252-8.
2. Hens L, Bonduelle M, Liebaers I,
Devroey P, Van Steirteghem AC.
Chromosome aberrations in 500
couples referred for in-vitro fertili-
zation or related fertility treatment.
Hum Reprod 1988;3(4):451-7.
3. Pang MG, Hoegerman SF,
Cuticchia AJ et al. Detection of
aneuploidy for chromosomes 4,
6, 7, 8, 9, 10, 11, 12, 13, 17, 18, 21,
X and Y by fluorescence in-situ
hybridization in spermatozoa from
Figure 4. Étude de la ségrégation d’une translocation robertsonienne par sperm-FISH.
Figure 5. Analyse par FISH de la ségrégation chromosomique dans les spermatozoïdes d’un patient porteur d’une
translocation robertsonienne 45,XY,rob(13 ;14)(q10 ;q10) avec une sonde spécifique pour le chromosome 13 (vert)
et une pour le chromosome 14 (rouge). a : spermatozoïde normal ; b : spermatozoïde avec une disomie du chro-
mosome 13 ; c : spermatozoïde avec une nullosomie du chromosome 14 ; d : spermatozoïde avec une nullosomie
du chromosome 13 ; e : spermatozoïde avec une disomie du chromosome 14.
Figure 6. Schéma des inversions péri- et
paracentriques.
Figure 7. Analyse par FISH de la ségrégation chromosomique dans les
spermatozoïdes d’un patient porteur d’une inversion péricentrique du
chromosome 10 en utilisant les sondes spécifiques du centromère du
chromosome 10 (bleu), des extrémités du bras court (vert) et long (rouge)
du chromosome 10. a : spermatozoïde normal avec un spot pour chaque
sonde ; b : spermatozoïde anormal avec 2 spots verts et sans spot rouge ;
c : spermatozoïde anormal avec 2 spots rouges et sans spot vert.

32 | La Lettre du Gynécologue • n° 347 - décembre 2009
Les pertes fœtales précoces
DOSSIER
➤Inversions paracentriques
Très peu de cas ont été rapportés dans la littérature,
mais tous montrent un risque de malségrégation
faible, inférieur à 1 % (4, 10). Ces résultats semblent
confirmer le caractère anodin de ces remaniements
qui pourraient être assimilés à des variants chro-
mosomiques sans risque génétique associé, à l’ex-
ception des chromosomes 9, 18 et 14 pour lesquels
des chromosomes dicentriques issus d’inversions
paracentriques ont été observés à terme (11).
Remaniement chromosomique
et effet interchromosomique
Parallèlement, le potentiel effet interchromoso-
mique (augmentation du risque de malségrégation
des chromosomes non impliqués dans la transloca-
tion comme le chromosome 21 et les chromosomes
sexuels X et Y) a été évalué. Les études sont encore
très contradictoires à ce sujet, puisque certains
auteurs rapportent l’existence d’un effet interchro-
mosomique pour divers chromosomes (12), alors que
pour d’autres il reste purement anecdotique (13, 14).
Fragmentation nucléaire
spermatique et morphologie
spermatique chez les patientes
ayant des fausses couches
spontanées à répétition
Fragmentation de l’ADN
Il est certain que la qualité du génome paternel
intervient aux différentes étapes de la féconda-
tion et surtout du développement embryonnaire
précoce, notamment à partir de l’activation du
génome embryonnaire (stade de 8 cellules chez
l’être humain correspondant au troisième jour après
la fécondation). À ce titre, la qualité de l’ADN du
spermatozoïde peut être étudiée et une mesure de
la fragmentation de l’ADN, réalisée.
Les origines de la fragmentation de l’ADN peuvent
être nombreuses. Les origines génétiques sont liées
à certaines insuffisances des enzymes de réparation
de l’ADN au moment de la spermiogenèse, processus
d’augmentation des substances oxydantes liés à
l’âge (15), à des processus infectieux et inflam-
matoires, ou à des facteurs environnementaux
(toxiques, hydrocarbures, insecticides, chaleur)
Références
bibliographiques
nine patients with oligoasthenote-
ratozoospermia undergoing intra-
cytoplasmic sperm injection. Hum
Reprod 1999;14(5):1266-73.
4. Guthauser B, Vialard F,
Dakouane M, Izard V, Albert M,
Selva J. Chromosomal analysis of
spermatozoa with normal-sized
heads in two infertile patients
with macrocephalic sperm
head syndrome. Fertil Steril
2006;85(3):750e5-750e7.
5. Roux C, Tripogney C, Morel F et
al. Segregation of chromosomes in
sperm of Robertsonian transloca-
tion carriers. Cytogenet Genome
Res 2005;111(3-4):291-6.
6. Ogur G, Van Assche E, Vegetti W
et al. Chromosomal segregation in
spermatozoa of 14 Robertsonian
translocation carriers. Mol Hum
Reprod 2006;12(3):209-15.
7. Anton E, Blanco J, Egozcue J, Vidal
F. Sperm studies in heterozygote
inversion carriers: a review. Cyto-
genet Genome Res 2005;111(3-4):
297-304.
8. Morel F, Laudier B, Guérif F et
al. Meiotic segregation analysis in
spermatozoa of pericentric inver-
sion carriers using fluorescence
in-situ hybridization. Hum Reprod
2007;22(1):136-41.
9. Ferfouri F, Clement P, Gomes DM
et al. Is classic pericentric inversion
of chromosome 2 inv(2)(p11q13)
associated with an increased risk of
unbalanced chromosomes? Fertil
Steril 2009;92(4):1497.e1-4.
10. Bhatt S, Moradkhani K, Mrasek
K et al. Breakpoint characterization:
a new approach for segregation
analysis of paracentric inversion
in human sperm. Mol Hum Reprod
2007;13(10):751-6.
11. Lefort G, Blanchet P, Belgrade N
et al. Stable dicentric duplication-
deficiency chromosome 14 resul-
ting from crossing-over within a
maternal paracentric inversion.” Am
J Med Genet 2002;113(4):333-8.
12. Machev N, Gosset P, Warter S,
Treger M, Schillinger M, Viville S.
Fluorescence in situ hybridization
sperm analysis of six translocation
carriers provides evidence of an
interchromosomal effect. Fertil
Steril 2005;84(2):365-73.
13. Pellestor F, Imbert I, Andréo B,
Lefort G.Study of the occurrence of
interchromosomal effect in sper-
matozoa of chromosomal rearran-
gement carriers by fluorescence
in-situ hybridization and primed
in-situ labelling techniques. Hum
Reprod 2001;16(6): 1155-64.
14. Kékesi A, Erdei E, Török M,
Drávucz S, Tóth A. Segregation
of chromosomes in spermatozoa
of four Hungarian translocation
[16]. Plusieurs techniques (SCSASperm Chromatin
Structure Assay, COMET, TUNEL) sont utilisées pour
mesurer la fragmentation de l’ADN spermatique,
et il est encore actuellement difficile de fixer réel-
lement une valeur seuil pathologique. Cette valeur
est d’autant plus difficile à fixer dans le cadre de
l’assistance médicale à la procréation (AMP) que
l’ovocyte contient des enzymes de réparation de
l’ADN qui peuvent compenser une fragmentation
augmentée. Ces enzymes sont d’autant plus efficaces
que les ovocytes sont de bonne qualité et provien-
nent de femmes plus jeunes. Les résultats de ce
test doivent donc être interprétés avec précaution,
car il est possible d’obtenir une grossesse évolutive
même en cas de fragmentation augmentée de l’ADN
spermatique.
Ces anomalies d’ADN spermatiques ont probablement
aussi des effets à long terme durant la grossesse, à
l’origine de FCS. Cela a été confirmé par une méta-
analyse (17), incluant 11 études précédentes concer-
nant 1 549 cycles d’AMP, 640 grossesses et 122 FCS.
Cette étude conclut à une augmentation des taux de
FCS en fécondation in vitro (FIV) avec ou sans micro-
injection (ICSI), en fonction du taux de fragmentation
nucléaire, et à une valeur prédictive de ce test.
Dans le cadre de protocole GEMA, nous avons
étudié la fragmentation de l’ADN spermatique
(technique TUNEL) et les résultats préliminaires
semblent montrer, chez ces patients, que les taux
de fragmentation sont augmentés par rapport à
ceux d’une population témoin. Dans 9 % des cas,
le taux est supérieur à 13 % (valeur seuil), alors que
dans la population témoin aucun patient n’a un taux
supérieur à 10 %.
Morphologie spermatique
La morphologie spermatique est également un
élément à prendre en compte dans le cadre des infer-
tilités et des risques de FCS chez les couples. L’étude
généralement réalisée est le spermocytogramme au
grossissement 1 000. Différentes études montrent
une corrélation entre la morphologie spermatique et
la fertilité naturelle (18) ainsi que pour la fertilité en
insémination intra-utérine ou en FIV (19). En ce qui
concerne la technique de FIV avec ICSI, le choix du
spermatozoïde est effectué au grossissement 300,
voire 400, et la corrélation avec les taux de FCS
est plus contradictoire. En effet, certaines études
montrent une corrélation entre les deux (20), en
particulier pour les anomalies de l’acrosome, de la
chromatine et de la pièce intermédiaire. À l’inverse,
d’autres études n’ont pas montré de corrélation (21).
 6
6
1
/
6
100%