1S-Planning Progression

Analyse du programme de 1
ère
S – Propositions d’organisation et de progression
I.Tarride 1
Lecture du BO
Repérage des activités expérimentales
21 dont certaines comportent plusieurs activités notamment en chimie.
Forte composante expérimentale.
Rythme rapide, imposé par l’enchaînement des activités expérimentales (compétences attendues).
Inventaire des notions
Plus de 30 « thèmes » (et parfois des thèmes vastes…)
Pas de répétition, pas de redondance, pas le temps de traîner…
Des compétences mettant en œuvre l’autonomie des élèves clairement identifiées
Des compétences formulées par « Recueillir et exploiter des informations sur… » (14 activités suggérées / 1 semaine sur 2)
Nécessité de mettre les élèves en activité.
Constats :
Programme vaste - Peu de temps scolaire – Comment boucler ce programme ?
Nécessité de faire travailler les élèves hors temps scolaire : Activités à faire à la maison – découverte des notions en amont des séances
Nécessité de trouver d’autres modes de fonctionnement : réserver la présence en classe à l’appropriation – rendre l’élève acteur avant et pendant les
séances – différencier les apprentissages en classe… d’autres pistes à trouver.
Nécessité d’exploiter tous les temps scolaires, notamment l’accompagnement personnalisé et les TPE (pour la partie Créer-innover).
Nécessité de trouver des formes d’évaluation qui n’amputent pas trop les séances
Moindre liberté pédagogique sur le choix de la progression :
Nécessité d’établir des passerelles entre les séries au 1
er
trimestre (Commencer par l’Optique).
Progressivité suggérée (Observer – Comprendre – Agir)
Mise en œuvre propre à chaque établissement :
Pas d’alternance des TP physique-chimie (Problèmes des salles … coordination avec les seconde qui procèdent par blocs et les TS qui alternent encore)
Horaires en groupes à la discrétion de l’établissement
Accompagnement personnalisé, concurrence des disciplines scientifiques

Analyse du programme de 1
ère
S – Propositions d’organisation et de progression
I.Tarride 2
La proposition de progression organise l’année sur 33 semaines
(12 pour le thème Observer – 12 pour le thème Comprendre – 9 pour le thème Agir)
Pas d’alternance physique chimie – des blocs de 4 à 6 TP de physique ou de chimie
Au total : 11 TP de physique – 15 TP de Chimie – 2 Activités documentaires
Une semaine sans TP programmée toutes les 6 semaines – 5 dans l’année.
(Évaluation – synchronisation / adaptation du rythme – projet « Créer innover »)
Chaque semaine sont listées les notions du BO, à acquérir.
La proposition s’appuie sur 1,5 h de cours par semaine + 1,5 h de TP en groupe + 0,5 h d’AP.
L’AP peut s’organiser en mettant 2 classes en parallèle et en regroupant d’une part avec l’un des professeurs,
les élèves ayant besoin de soutien et d’autre part, avec l’autre ceux qui peuvent approfondir.
Les groupes ne sont pas nécessairement figés, l’attribution des groupes aux professeurs non plus.
La partie « Créer – innover » peut aussi être mise en œuvre dans le cadre des TPE
dont les sujets peuvent être orientés vers des concepts du programme de 1
ère
S

Analyse du programme de 1
ère
S – Propositions d’organisation et de progression
I.Tarride 3
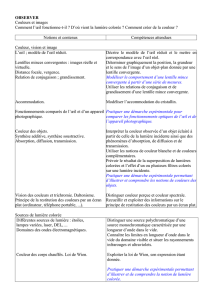
OBSERVER
Couleurs et images
Comment l’œil fonctionne-t-il ? D’où vient la lumière colorée ? Comment créer de la couleur ?
12 semaines – 10 TP (4 physique – 6 chimie) – 18 heures d’activités-cours
– 6 heures d’AP
2 évaluations – 2 semaines sans TP programmé
Notions et contenus
Compéte
nces attendues
Progression
-
Organisation des activités
Couleur, vision et image
L’œil ; modèle de l’œil réduit.
Lentilles minces convergentes : images réelle et
virtuelle.
Distance focale, vergence.
Relation de conjugaison ; grandissement.
Accommodation.
Fonctionnements comparés de l’œil et d’un
appareil photographique.
Décrire le modèle de l’œil réduit et le mettre en
correspondance avec l’œil réel.
Déterminer graphiquement la position, la grandeur et le sens
de l’image d’un objet-plan donnée par une lentille
convergente.
Modéliser le comportement d’une lentille mince convergente
à partir d’une série de mesures.
Utiliser les relations de conjugaison et de grandissement
d’une lentille mince convergente.
Modéliser l’accommodation du cristallin.
Pratiquer une démarche expérimentale pour comparer les
fonctionnements optiques de l’œil et de l’appareil
photographique.
Semaine 1 :
TP1 : L’œil et l’appareil photographique – Effet d’une lentille convergente
sur la lumière - Image d’un objet donnée par une lentille convergente
Notions :
- Propagation de la lumière
- formation d’images par une lentille convergente.
- L’œil et l’œil réduit / L’appareil photo
- L’accommodation / La mise au point
- Construction graphiques d’images
AP / autonomie :
- Construction d’images réelles – Images virtuelles (la loupe)
Semaine 2 :
TP2 Établissement des relations de conjugaison et de grandissement
Notions :
- Application des relations de conjugaison et de grandissement
- images réelles / virtuelles
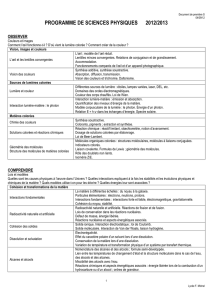
Couleur des objets.
Synthèse additive, synthèse soustractive.
Absorption, diffusion, transmission.
Vision des couleurs et trichromie. Daltonisme.
Principe de la restitution des couleurs par un
écran plat (ordinateur, téléphone portable, etc.).
Interpréter la couleur observée d’un objet éclairé à partir de
celle de la lumière incidente ainsi que des phénomènes
d’absorption, de diffusion et de transmission.
Utiliser les notions de couleur blanche et de couleurs
complémentaires.
Prévoir le résultat de la superposition de lumières colorées et
l’effet d’un ou plusieurs filtres colorés sur une lumière
incidente.
Pratiquer une démarche expérimentale permettant d’illustrer
et comprendre les notions de couleurs des objets.
Distinguer couleur perçue et couleur spectrale.
Recueillir et exploiter des informations sur le principe de
restitution des couleurs par un écran plat.
Semaine 3 :
TP3 : Vision des couleurs - Synthèse additive – Couleur des objets
(diffusion, absorption, transmission)
Notions :
- Synthèse additive
- couleur perçue / couleur spectrale
- Trichromie – Vision des couleurs – Daltonisme
- Principe de la couleur des filtres et des objets diffusants (diffusion,
absorption, transmission)
AP / Autonomie : Couleurs primaires et couleurs secondaires de la
synthèse additive ; cercle chromatique – Restitution des couleurs par les
écrans plats

Analyse du programme de 1
ère
S – Propositions d’organisation et de progression
I.Tarride 4
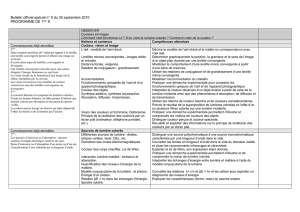
Sources de lumière colorée
Différentes sources de lumière : étoiles, lampes
variées, laser, DEL, etc.
Domaines des ondes électromagnétiques.
Couleur des corps chauffés. Loi de Wien.
Interaction lumière-matière : émission et
absorption.
Quantification des niveaux d’énergie de la
matière.
Modèle corpusculaire de la lumière : le photon.
Énergie d’un photon.
Relation E = h dans les échanges d’énergie.
Spectre solaire.
Distinguer une source polychromatique d’une source
monochromatique caractérisée par une longueur d’onde
dans le vide.
Connaître les limites en longueur d’onde dans le vide du
domaine visible et situer les rayonnements infrarouges et
ultraviolets.
Exploiter la loi de Wien, son expression étant donnée.
Pratiquer une démarche expérimentale permettant d’illustrer
et de comprendre la notion de lumière colorée.
Interpréter les échanges d’énergie entre lumière et matière à
l’aide du modèle corpusculaire de la lumière.
Connaître les relations λ = c/ ν et E = h.ν et les utiliser pour
exploiter un diagramme de niveaux d’énergie.
Expliquer les caractéristiques (forme, raies) du spectre
solaire.
Semaine 4
TP 4 Différentes sources lumineuses – influence de la température de la
source (corps chaud), influence de la nature de la source (émission
atomique)
Notions :
- source mono / polychromatique
- domaine visible, infrarouges et ultraviolets.
- Loi de Wien et applications
- échanges d’énergie entre lumière et matière,
niveaux d’énergie.
- Caractéristiques (forme, raies) du spectre solaire.
Matières colorées
Synthèse soustractive.
Colorants, pigments ; extraction et synthèse.
Molécules organiques colorées : structures
moléculaires, molécules à liaisons conjuguées.
Indicateurs colorés.
Interpréter la couleur d’un mélange obtenu à partir de
matières colorées.
Pratiquer une démarche expérimentale mettant en œuvre
une extraction, une synthèse, une chromatographie.
Reconnaître si deux doubles liaisons sont en position
conjuguée dans une chaîne carbonée.
Établir un lien entre la structure moléculaire et le caractère
coloré ou non coloré d’une molécule.
Repérer expérimentalement des paramètres influençant la
couleur d’une substance (pH, solvant,etc.).
Recueillir et exploiter des informations sur les colorants, leur
utilisation dans différents domaines, et les méthodes de
détermination des structures (molécules photochromes,
indicateurs colorés, peintures, etc.).
Semaine 5
TP5 Extraction et chromatographie des pigments des épinards ou autre
(par exemple un végétal dont l’un des pigemnts est sensible au pH)
Notions :
- couleur d’un mélange
- synthèse soustractive
AP / Autonomie : Histoire des arts et de la couleur
Semaine 6
:
É
valuation
/ Synchronisation / Projet
s
Semaine 7
TP6 synthèse d’un pigment
Notions :
- réaction chimique
- équation de réaction
AP / Autonomie : Recherche d’informations sur les colorants. Méthodes de
détermination des structures

Analyse du programme de 1
ère
S – Propositions d’organisation et de progression
I.Tarride 5
Semaine 8 :
TP7 Paramètres influençant la couleur
Notions :
– indicateur coloré
- influence des paramètres
– relation structure couleur
Réaction chimique : réactif limitant,
stoechiométrie, notion d’avancement.
Dosage de solutions colorées par étalonnage.
Loi de Beer-Lambert.
Identifier le réactif limitant, décrire quantitativement l’état final
d’un système chimique.
Interpréter en fonction des conditions initiales la couleur à
l’état final d’une solution siège d’une réaction chimique
mettant en jeu un réactif ou un produit coloré.
Pratiquer une démarche expérimentale pour déterminer la
concentration d'une espèce colorée à partir d'une courbe
d'étalonnage en utilisant la loi de Beer-Lambert.
Semaine 9
TP8 Détermination de la concentration d’une solution colorée par
étalonnage Beer-Lambert
Notions :
- concentrations
- Loi de Beer-lambert
- suivi de l’avancement d’une réaction par spectrophotométrie
AP / Autonomie : Tableau d’avancement, un outil pour suivre l’évolution
d’une réaction
Liaison covalente.
Formules de Lewis ; géométrie des molécules.
Rôle des doublets non liants.
Isomérie Z/E.
Savoir que les molécules de la chimie organique sont
constituées principalement des éléments C et H.
Décrire à l’aide des règles du « duet » et de l’octet les
liaisons que peut établir un atome (C, N, O, H) avec les
atomes voisins.
Interpréter la représentation de Lewis de quelques molécules
simples.
Mettre en relation la formule de Lewis et la géométrie de
quelques molécules simples.
Prévoir si une molécule présente une isomérie Z/E.
Savoir que l'isomérisation photochimique d'une double
liaison est à l'origine du processus de la vision.
Mettre en œuvre le protocole d’une réaction photochimique.
Utiliser des modèles moléculaires et des logiciels de
modélisation.
Semaine 10
TP9 Géométrie des molécules - Utiliser un logiciel de construction
moléculaire en 3D
Notions :
- Liaison covalente
- Schéma de Lewis des molécules
- Géométrie des molécules
Semaine 11
TP10 Réaction photochimique (isomérisation)
Notions :
- isomérie Z-E - Principe de la vision
AP / Autonomie : Géométrie des molécules - Isoméries
Semaine 1
2
:
Évaluation / Synchronisation / Projet
s
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%