exemple_de_progression_en_1s

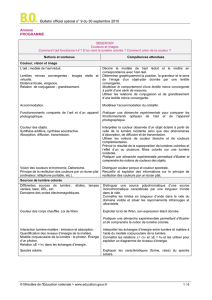
Exemple de progression en 1°S :
Remarque : Observer / Comprendre / Agir .
Arts et Sciences : De la restauration d’une œuvre aux faussaires.
I. Analyse d’une œuvre.
La recherche de repentis : UV, IR.
Analyse de pigments. Compositions des
couleurs utilisées.
Connaître les limites en longueurs d’onde
dans le vide du domaine visible et situer les
rayonnements IR et UV.
Interpréter la couleur d’un mélange obtenu à
partir de matières colorées.
Pratiquer une démarche expérimentale
mettant en œuvre une extraction, une
chromatographie.
Savoir que les molécules de la chimie
organique sont constituées principalement
des éléments C et H.
Reconnaître si deux doubles liaisons sont en
position conjuguée dans une chaîne
carbonée.
Etablir un lien entre la structure moléculaire
et le caractère coloré d’une molécule.
Mettre en œuvre un protocole d’extraction
d’une espèce chimique d’un solvant.
II. La datation des œuvres.
Datation au carbone 14 : qu’est-ce que c’est ?
Détermination de dates par lecture d’une
courbe.
Désintégration β et datation du vin.
Texte historique sur l’utilisation de tel ou tel
pigment : lieux géographique, époques
d’utilisation et d’invention…
Associer à chaque édifice organisé la ou les
interactions fondamentales prédominantes.
Utiliser la représentation symbolique AZX ;
Définir l’isotopie et reconnaître des isotopes.
Recueillir et exploiter des informations sur la
radioactivité naturelle et de la radioactivité
artificielle.
Connaître la définition et les ordres de
grandeurs de l’activité exprimée en
Becquerel.
III. Restaurer une œuvre.
Extraire une œuvre échouée au fond de la
mer : techniques d’électrolyses….
Pourquoi une œuvre se dégrade-t-elle ?
Comment se dégrade-t-elle ?
Recueillir et exploiter des informations sur
les piles ou les accumulateurs.
Reconnaître l’oxydant, le réducteur dans un
couple.
Ecrire l’équation d’une réaction
d’oxydoréduction en utilisant les demi-
équations redox.
Nommer des molécules organiques.
Reconnaître la classe d’un alcool.
Ecrire l’équation d’oxydation d’un alcool et

Appliquer des joints, des pigments, des
vernis protecteurs…
d’un aldéhyde.
Recueillir et exploiter des informations sur
les applications de la structure de certaines
molécules ( superabsorbants, tensioactifs…)
Prévoir si un solvant est polaire.
Reconnaître une chaîne carbonée linéaire,
ramifiée ou cyclique. Nommer un alcane, un
alcool.
Donner les formules semi-développées
correspondant à une formule brute donnée
dans le cas de molécules simples.
Interpréter :
La plus ou moins grande miscibilité des
alcools avec l’eau.

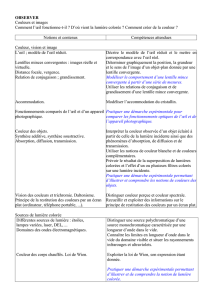
Nos yeux : il faut en prendre soin !
I. Les mécanismes de la vision.
Le principe de l’accommodation.
La vision en couleur : les récepteurs
chromatiques, de quoi dépend la couleur
d’un objet ( est-il toujours bleu, rouge ou
cyan ? )
Chimie de la vision.
La vie en rose.
Décrire le modèle réduit de l’œil et le mettre
en correspondance avec l’œil réel.
Modéliser l’accommodation du cristallin.
Mettre en relation des formules de Lewis et
la géométrie de certaines molécules simples.
Prévoir si une molécule présente une
isomérie Z/E.
Savoir que l’isomérisation photochimique
d’une double liaison est à l’origine du
processus de la vision.
Mettre en œuvre le protocole d’une réaction
photochimique.
Interpréter la couleur observée d’un objet
éclairée à partir de celle de la lumière
incidente ainsi que des phénomènes
d’absorption, de diffusion et de transmission.
II. Les défauts de l’œil.
Daltonisme : quand la vision trichromique ne
fonctionne pas.
Du pointillisme à l’écran plat.
Presbytie, myopie, hypermétropie.
Cataracte.
Distinguer couleur perçue, couleur spectrale.
Recueillir et exploiter des informations sur le
principe de restitution des couleurs ( par un
écran plat )
Recueillir et exploiter des informations sur
l’actualité scientifique et technologique, sur
des métiers ou des formations scientifiques et
techniques en lien avec des ressources
locales.
III. Soigner les yeux.
Collyre : composition…
Porter des lentilles. Dans quel matériau
construire les lentilles ? Verres
autonettoyants.
Verres protecteurs contre le soleil.
Les verres antireflets ? …
La chirurgie au laser.
Ecrire l’équation de la réaction associée à la
dissolution dans l’eau d’un solide ionique.
Savoir qu’une solution est électriquement
neutre.
Elaborer et réaliser un protocole de
préparation d’une solution ionique de
concentration donnée en ions.
Recueillir et exploiter des informations sur
une synthèse de molécule biologiquement
active en identifiant les groupes
caractéristiques.
Recueillir et exploiter des informations pour
relier les propriétés physiques d’un matériau
à sa structure microscopique.
Connaître diverses formes d’énergie.

Diverses utilisations du laser.
I.Qu’est-ce qu’un laser ? .
Etude de textes scientifiques.
Interpréter les échanges d’énergie entre
lumière et matière à l’aide du modèle
corpusculaire de la lumière.
Connaître les relations lambda = c/f et deltaE
= h*nu et les utiliser pour exploiter un
diagramme de niveaux d’énergie.
II. Refroidir la matière avec des lasers.
Notion de froid et de chaud pour la matière.
Chauffer de l’eau avec un laser.
Etude de docs sur le refroidissement
d’atomes par des lasers.
Un pas vers la supraconductivité…
Interpréter à l’échelle microscopique les
aspects énergétiques d’une variation de
température et d’un changement d’état.
Pratiquer une démarche expérimentale pour
mesurer une énergie de changement d’état.
Distinguer puissance, énergie.
Connaître et utiliser la relation
puissance/énergie.
Comparer et connaître les ordres de grandeur
de puissances.
Pratiquer une démarche expérimentale pour :
Mettre en évidence l’effet Joule.
Exprimer la tension aux bornes d’un
générateur et d’u récepteur en fonction de
l’intensité du courant électrique.
Recueillir et exploiter des infos portant sur
un système électrique à basse consommation.
III. Manipuler la matière avec un laser.
Vers la nanotechnologie…( travailler à partir
d’un article de revue scientifique )
Recueillir et exploiter des informations sur
un aspect de la nanochimie…

Les aurores boréales.
I. Le Soleil.
Le Soleil, une source de lumière polychromatique.
Des réactions de fusion.
Distinguer une source polychromatique d’une
source monochromatique caractérisée par une
longueur d’onde dans le vide.
Connaître les limites en longueurs d’onde dans le
vide du domaine visible et situer les rayonnements
IR et UV.
Utiliser les lois de conservation pour écrire
l’équation d’une réaction nucléaire.
Recueillir et exploiter des informations sur les
réactions nucléaires.
II. Le champ magnétique terrestre.
Approche historique du champ magnétique
terrestre : comment mis en évidence, mesure…
Description du champ magnétique terrestre, travail
sur des sources de champ magnétique…
Les étoiles à neutrons.
Décrire le champ associé à des propriétés physiques
qui se manifestent en un point de l’espace.
Comprendre comment la notion de champ a émergé
historiquement d’observations expérimentales.
Pratiquer une démarche scientifique pour
cartographier un champ magnétique.
Connaître les caractéristiques :
Des lignes de champ vectoriel.
D’un champ uniforme.
Du champ magnétique terrestre.
III. Comment se forment les aurores boréales ?
Recherche sur la formation des aurores boréales.
Comprendre comment un corps peut émettre de la
lumière.
Absorption.
Schématiser une chaîne énergétique pour interpréter
les conversions d’énergie en termes de conservation.
Communiquer sur la science.
Interpréter les échanges d’énergie entre lumière et
matière à l’aide du modèle corpusculaire de la
lumière.
Connaître les relations lambda = c/f et deltaE =
h*nu et les utiliser pour exploiter un diagramme de
niveaux d’énergie.
 6
6
1
/
6
100%