chimie générale

chimie générale
Etude d'une solution de permanganate de potassium
: le dosage de cette solution peut se faire par une r
d'oxydoréduction en utlisant une solution contenant des ions ferreux Fe2+ en milieu acide.
MnO4-/ Mn2+ : E01=1,51 V ; Fe3+ / Fe2+ : E02=0,77 V
1. Ecrire les demi-équations électroniques puis l'équation de la réaction spontané
e qui a lieu. Justifier le sens
d'évolution.
2. Calculer la variation d'enthalpie standart
G0correspondant à cette réaction.
3. En déduire la constante d'équilibre à T=298 K. F=96500 C et R=8,31 JK-1mol-1.
Etude d'un équilibre de précipitation : les calculs rénaux sont essentiellement constitué
s d'oxalate de calcium
CaC2O4, composé peu soluble constitué d'ion Ca2+ et C2O42-. On né
glige le comportement basique des ions
oxalates C2O42-.
1. Ecrire l'équation de l'équilibre de dissolution de CaC2O4.
2. Calculer la solubilité s de ce sel dans l'eau pure.
3. Comparer qualitativement la solubilité s' de CaC2O4
dans une solution de chlorure de calcium Ca
la solubilité s dans l'eau pure. Justifier.
4. Calculer la solubilité s' de CaC2O4dans une eau miné
rale contenant initialement 0,02 mol/L de chlorure de
calcium.
produit de solubilité de CaC2O4: Ks= 3,6 10-9.
corrigé
MnO4-est l'oxydant le plus fort ; Fe2+ est le réducteur le plus fort.
MnO4-+ 8H++ 5e-= Mn2+ + 4H2O
5Fe2+ = 5 Fe3+ +5 e-.
MnO4-+ 8H++ 5Fe2+ = Mn2+ + 5 Fe3+ + 4H2O
E = 1,51 -0,77 = 0,74 V
G0= -nFE = -5*96500*0,74 = -357000 J.
G0= -RT ln K
ln K=
G0/( -RT ) = -357000 /(-8,31*298)=144,18.
K= 4 1062.
Corrig
é
BTS Analyses Biologiques 2003 Sciences Physiques
-
http://www.chimix.com
-
CHIMIX
T
é
l
é
charg
é
sur http://www.aidexam.com

CaC2O4(s)=Ca2++C2O42-.
Ks=[Ca2+][C2O42-]=s² = 3,6 10-9 d'où s= 6 10-5 mol/L.
Dans une solution contenant des ions calcium tels que [Ca2+] >> s :
le produit [Ca2+][C2O42-] est constant pour une température donnée ; si [Ca2+] >>s alors s'=[C2
O
si [Ca2+] = 0,02 mol/L alors s' = 3,6 10-9 /0,02= 1,8 10-7 mol/L.
Ecole Supérieure Chimie
Formation ingénieur chimiste
Prépa intégrée
www.escom.fr
Préparer un BTS Optique
Organisme Supérieur des Métiers
de l'Optique, inscriptions ouvertes
www.osmoptique.fr
Cours de physique
Votre cours de physique avec nos
sites sélectionnés pour vous
www.mode.fr
Microscope
Achetez en ligne votre microscope
Dé
couvrez nos offres
shopping.cherchons.com
chimie organique
Le styrène C6H5-CH=CH2peut être obtenu à la suite des opérations suivantes :
1. L'éthanol C2H5OH subit une oxydation ménagée, en milieu acide, par un excè
s de permanganate de
potassium. On obtient un acide A. Donner sa formule semi-développée et son nom.
2. L'acide A soumis à l'action du pentachlorure de phosphore PCl5mène à
un chlorure d'acyle B. Donner la
formule semi-développée et le nom de B.
3. Le benzène C6H6soumis à l'action du chlorure d'acyle B en pré
sence de chlorure d'aluminium AlCl
un produit C réagissant avec la 2,4-
DNPH mais n'ayant aucune action sur la liqueur de Fehling. A quelle
famille appartient le composé C ?
- Donner le mécanisme de l'action du benzène sur B.
- Donner la formule semi-développée de C.
4. Le composé C subit une réduction à l'aide d'hydrure d'aluminiumlithium LiAlH4
et donne un alcool D
optiquement actif. Donner la formule semi-développée de D.
- Représenter les deux énantiomères de D suivant la représentation de Cram et pré
ciser leur configuration
absolue en énonçant les règles utilisées.
5. En présence d'acide sulfurique, on réalise la déshydratation intramolé
culaire de l'alcool D. Le produit
obtenu est le styrène. Ecrire l'équation de la réaction correspondante
corrigé
A est l'acide éthanoïque CH3-COOH
B est le chlorure d'éthanoyle CH3-COCl
C est une cétone : test positif avec la 2,4-DNPH mettant en évidence le groupe carbonyle; test né
gatif avec la
Corrig
é
BTS Analyses Biologiques 2003 Sciences Physiques
-
http://www.chimix.com
-
CHIMIX
T
é
l
é
charg
é
sur http://www.aidexam.com

liqueur de Fehling ( le test est positif avec un aldehyde)
C6H5-CO-CH3.
D est : C6H5-CHOH-CH3.
numéroter de façon décroissante chacun des quatre substituants selon son numé
ro atomique.
OH (1) ; C6H5- (2) ; CH3(3) ; H (4).
On place alors l'atome (ou le groupement) de numéro le plus élevé derrière.
On regarde dans quel sens, sens horaire ou trigonométrique, on passe du numé
ro 1, au 2, au 3.
- Si le sens de rotation est le sens horaire (ou anti-trigonomé
trique), le carbone est Rectus (R),
- Si le sens de rotation est le sens trigonométrique (ou anti-
horaire), le carbone est Sinister (S).
C6H5-CHOH-CH3--> C6H5-CH=CH2+ H2.
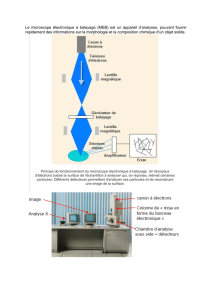
microscopie
Les grandeurs algébriques sont écrites en gras et en bleu.
Un microscope optique est constitué d'un objectif de distance focale f'1=O1F'1
=1 cm et d'un oculaire de distance
focale f'2=O2F'2= 4 cm. La distance entre les centres optique est O1O2=21,7 cm.
Corrig
é
BTS Analyses Biologiques 2003 Sciences Physiques
-
http://www.chimix.com
-
CHIMIX
T
é
l
é
charg
é
sur http://www.aidexam.com

1. Donner le schéma de principe du microscope dans le cas de l'observation à
l'infini ( sans accomodation).
Préciser la nature et la position des images intermédiaire et finale.
2. Définir la puissance en précisant les unités employées.
3. Rappeler la définition de la puissance intrinsèqye Pi.
- Montrer que Pipeut s'exprimer par la relation Pi=
/ ( f'1f'2) où
=F'1F'2
- Calculer Pi.
4. Sous quel angle
' serait observé une hématie de diamètre 4
m à travers le microscope ?
5. Sachant que l'objectif a une ouverture numérique n sin u = 0,85, calculer la limite de ré
solution L de cet
instrument avec une longueur d'onde
= 650 nm. On donne L= 0,61
/ (n sin u).
6. Dans un microscope électronique, les électrons accéléré
s par une tension acquiert une vitesse de 1,68 10 8
m/s. On rappelle qu' à une particule de masse m et de vitesse v est associé
e une onde de longueur d'onde
h/(mv).
- Calculer
.
- Calculer la limite de résolution théorique de ce microscope si l'ouverture numé
rique du faisceau
d'électrons est n sin u = 9 10-4. Comparer avec le résultat précédent et conclure.
h= 6,62 10-34 Js ; masse de l'électron m= 9 10-31 kg.
corrigé
L'image intermédiaire est réelle et située au foyer objet de l'oculaire ; l'image dé
finitive est virtuelle, rejet
l'infini.
puissance du microscope:
Soit
'
l'angle en radians sous lequel est vue l'image A'B' donnée par l'objectif L1.
tan
'
= A'B' / F2O2= A'B'/f'2. L' angle
'
étant petit tan
'
voisin de
'
radians.
Par définition, la puissance du microscope est égale au rapport du diamètre apparent de l’
image instrumentale
'
(dans le cas d’un angle petit) à la taille de l’objet observé P= '/AB
puissance en dioptrie (
) et AB en mètre
P= A'B'/ AB* 1/f'2=
/f'2;
est le grandissement de l'objectif
=O1A'/O1A=( O1F'1+F'1A' )/O1A=(f'1+
) / O1Avoisin de
/ f'1.
Corrig
é
BTS Analyses Biologiques 2003 Sciences Physiques
-
http://www.chimix.com
-
CHIMIX
T
é
l
é
charg
é
sur http://www.aidexam.com

P =
/ (f'1f'2)
Soit l'angle
sous-tendu par l'objet étudié lorsqu'il est placé à la distance minimale de
vision nette d ; soit l'angle
'
sous lequel l'image de ce même objet est observé à
travers une loupe ou un
microscope. On appelle grossissement (noté G) le rapport G='/
Le microscope et son oculaire sont utilisés de façon intrinsèque (image instrumentale à l’
infini), donc la puissance
est intrinsèque est égale à : Pi= 4 G.
Pi=
/ ( f'1f'2) ;
=21,4-1-4 = 16,4 cm = 0,164 m ; f'1= 0,01 m et f'2= 0,04 m
Pi=0,164/(0,01*0,04)= 410
.
diamètre apparent de l'objet observé à la distance minimale de vision distincte dm
=0,25 m :
= 4 10-6 / 0,25 = 1,6 10-5 rad
Pi= 410
d'où G= 410/4 = 102,5 =
'
/
= soit
'
= 102,5 = 102,5*1,6 10-5 =1,64 10-3
m
limite de résolution L= 0,61* 650 10-9 / 0,85 = 4,66 10-7 m.
= h/(mv) = 6,62 10-34 / (9,1 10-31*1,68 108)= 4,33 10-12 m.
limite de résolution théorique : L1= 0,61* 4,33 10-12 / 9 10-4 =2,93 10-9 m.
environ 100 fois plus grande que la limite de ré
solution du microscope optique : on pourra observer des objets 100
fois plus petits
Corrig
é
BTS Analyses Biologiques 2003 Sciences Physiques
-
http://www.chimix.com
-
CHIMIX
T
é
l
é
charg
é
sur http://www.aidexam.com
1
/
5
100%