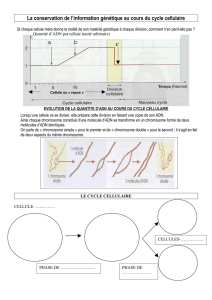
Clonage dans un plasmide (pUC) • Site multiple de clonage au

Clonage dans un plasmide (pUC)
• Site multiple de clonage au niveau
d'une portion du gène de la β-galacto-
sidase
E. coli
(
LacZ'
).
• Sélection des bactéries transformées
(plasmide avec ou sans insert):
ampR
• Sélection des bactéries transformées
(plasmide avec insert): crible blanc/bleu
en présence d'IPTG et de X-gal.
• Réplication indépendante de celle du
chromosome bactérien (
ori
)
• Capacité de clonage: 3 - 4 kb

Cycles du bactériophage λ
λλ
λ (phage tempéré)
Cycle lytique Cycle lysogénique
Injection de l'ADN du phage dans la bactérie
Réplication de l'ADN Intégration de l'ADN du
phage dans le chromosome
bactérien (prophage)
Réplication en même temps
que le chromosome bactérien
Synthèse des protéines
de la capside
Assemblage des
particules phagiques
Lyse bactérienne Excision du prophage
Induction Stimulus
externe

Génome du phage λ
λλ
λ
cosL cosR
Gènes essentiels au déroulement du cycle
lytique (synthèse ADN, assemblage des
particules phagiques, lyse) → 60% du génome
Gènes essentiels au déroulement du
cycle lysogénique → 25% du génome
Génome λ
λλ
λ: ADN bicaténaire de 48,5 kb
Structures du génome
• Molécule linéaire dans les particules phagiques
• Circularisation au niveau des extrémités cos (segments d'ADN simple
brin complémentaires) dans les bactéries infectées par le phage

Construction du vecteur de clonage
λ
λλ
λ de type sauvage
Délétion des gènes
non essentiels au
déroulement du cycle
lytique
cosL cosR
Bam
H1
Fragment de substitution
cosL cosR
Gène de sélection (ex:
lacZ
)Vecteur de clonage λ
λλ
λ (≅45 kb)
Insertion d'un fragment de
substitution (≅ 15 kb)
cosL cosR
ADN exogène
Délétion du fragment
de substitution
Insertion de l'ADN
exogène
Contrainte liée à l'assemblage de particules phagiques infectieuses
La taille de la molécule d'ADN doit être comprise entre 38 et 51 kb
Clonage de fragments d'ADN exogène de tailles comprises
entre 9 et 22 kb

Procédure de clonage
dans le phage λ
λλ
λ
(T4 DNA ligase)
cosRcosR
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
1
/
35
100%