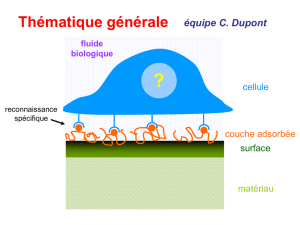
elimination competitive de deux colornats anioniques par

UNIVERSITE DES SCIENCES ET DE LA TECHNOLOGIE MOHAMED BOUDIAF
U.S.T.O.M.B.
FACULTE DES SCIENCES. DEPARTEMENT DE CHIMIE INDUSTRIELLE
MEMOIRE DE MAGISTER
SPECIALITE : CHIMIE DE MATERIAUX
OPTION : PHYSICO-CHIMIE DES MATERIAUX ET DES MINERAUX
Présenté par
Mlle. GRADA Nacera
Thème :
« ELIMINATION COMPETITIVE DE DEUX
COLORNATS ANIONIQUES PAR DES
HYDROXYDES »
Devant le jury :
Président : M. Zoubir DERRICHE Professeur à l’USTO-MB.
Rapporteur : Mm Zohra BOUBERKA Maître de conférence à l’USTO-MB.
Examinateurs: M. Abdelaziz BENDRAOUA Maître de conférence à l’USTO-MB.
M. Noureddine BENDERDOUCHE Professeur à l’U-Mostaganem.
M. Abdallah AZIZ Maître de conférence à l’UMostaganem
Promotion 2010

Remerciements
Ce travail a été effectué au sein du Laboratoire de physico-chimie des Matériaux,
département de chimie industrielle de l’Université des sciences et de la technologie -Mohamed
Boudiaf- d’Oran (USTO-MB), sous la direction de Monsieur le professeur Zoubir DERRICHE. Je le
remercie de m’avoir accueilli au sein de son laboratoire.
Je tiens à exprimer ma profonde reconnaissance à Madame Zohra BOUBERKA, Maître de
conférences à l’USTO. Je lui adresse ma gratitude pour son encadrement chaleureux et ses
remarques éclairées. Ainsi sa disponibilité, les conseils, l’encouragement, la patience et
l’amabilité dont elle a fait preuve.
J’exprime ma profonde reconnaissance et ma gratitude à Melle Halima AIT MAHAMED,
étudiante thèse de doctorat à l’USTO, pour sa disponibilitée, son aide précieuse, ses conseils
avisés et sa confiance ; ainsi pour ses qualités humaines et scientifiques.
J’adresse mes plus vifs remerciements à tous les membres du jury,
Monsieur Abdelaziz BENDRAOUA, Maître de conférence à l’U.S.T.O, pour m’avoir fait
l’honneur de juger ce travail.
Monsieur Abdallah AZIZ, Maître de conférence à l’université de Mostaganem, pour
l’honneur qu’elle m’a fait en acceptant d’examiner et de juger ce travail.
Monsieur Noureddine BENDERDOUCHE, Maître de Conférence à l’université de
Mostaganem, pour l’honneur qu’il m’a fait en acceptant d’examiner et de juger ce travail.
Je tiens à remercier Mlle Faiza YAKHOU, Technicienne supérieure du laboratoire de
physico-chimie des Matériaux, pour son aide précieuse, sa disponibilité, sa gentillesse et aussi
pour son amitié.
Je tiens également à remercier tous les membres du laboratoire qui ont tenu une grande place
pendant la réalisation de ce mémoire.

Une pensée amicale à : BENDJILALI Hafida , BOUZID Samia , BENTALEB Kahina, BELAROUSI
Amel, Brahim et saliha avec lesquels j’ai pu partager de bons moments de joie durant l’année
pratique. Merci pour votre amitié.

Dédicace
A ma gracieuse mère que Dieu la bénisse et la protège de tout mal.
A la mémoire de mon père, toujours vivante dans nos coeurs.
.
A mes chères sœurs Dalila, Rachida, Khiera
A mes chers frères : Mohamed, Djeloul, Houari, Ghalem, Aziz.
A tous ceux qui me sont chers sans citer les noms pour que je n’oublie personne.
A tous ceux qui m’ont illuminé la voie de la science.

Tableaux
Tableau II.1. Les caractéristiques des deux colorants utilisés
Tableau III.1. Paramètre de maille de la goethite synthétisée
Tableau III.2. Valeurs de PZC de la goethite selon la littérature
Tableau IV.1. Constantes de vitesse de l’adsorption du colorant Orange II et Remazol brillant
bleu sur la goethite à différentes concentrations initiales de colorants.
Tableau IV.2. Constantes de vitesse de l’adsorption du colorant Orange II et Remazol brillant
bleu sur la goethite à différentes températures.
Tableau IV.3. Paramètres de Freundlich et Langmuir pour l’adsorption du colorants Orange II et
Remazole bleu brillant.
Tableau IV.4. Paramètres de Freundlich et Langmuir pour l’adsorption du colorants Orange II et
Remazole bleu brillant seul et en compétition par la goethite.
Tableau IV.5. Paramètres cinétiques de l’adsorption du colorant Orange II et Remazol brillant
bleu sur l’hydroxyde d’aluminium à différentes concentrations initiales de colorants.
Tableau IV.6. Paramètres cinétiques de l’adsorption du colorant Orange II et Remazol brillant
bleu sur l’hydroxyde d’aluminium à différentes températures.
Tableau IV.7. Paramètres de Freundlich et Langmuir pour l’adsorption du colorants Orange II et
Remazole bleu brillant par l’hydroxyde d’aluminium.
Tableau IV.8. Paramètres de Freundlich et Langmuir pour l’adsorption du colorants Orange II et
Remazole bleu brillant seul et en compétition par l’hydroxyde d’aluminium.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
1
/
81
100%