Chapitre 7 : Cohésion de la matière Les plus petits constituants de

Chapitre 7 : Cohésion de la matière
1. Les plus petits constituants de la matière
1.1. Particules élémentaires
localisation
Charge élémentaire
Masse
Proton
Dans le noyau
+e
1,673*10-27
Neutron
Idem
0
1,673*10-27
Electron
Autour du noyau
-e
9,1*10-30
Q= n*e
1.2. L’atome
ZAX
A= nombre de masse / nucléons
Z= nombre de charge / protons –électriquement neutre donc aussi électrons-
2. Les interactions de la matière
4 fondamentales
noyau
forte
Assure la cohésion du noyau atomique.
noyau
faible
Responsable de quelques types de radioactivité.
Atome, molécule, homme
électromagnétique
Répulsive ou attractive, agit entre des objets
chargés, portée infinie mais qui diminue avec la
distance.
Système solaire, galaxie
gravitationnelle
Toujours attractive, agit entre des particules ayant 1
masse, portée infinie qui diminue avec la distance.
Elle assure la cohésion d’édifices à l’échelle
astronomique
Chapitre 8 : Radioactivité et réactions nucléaires
1. Réaction nucléaire
1.1. Réaction nucléaire spontanée
Interaction dans le noyau : électromagnétique (répulsive) et forte (attractive)cohésion du noyau =
équilibre des interactions
-noyau stable
-noyau instable : désintégration radioactive = un noyau père peut expulser spontanément 1 particule
(électron, position ou noyau d’hélium) (et donc créer un autre noyau fils) et émettre un rayonnement
(gamma de grande énergie).
Electron 0-1e
Rayonnement ß-
Position 01e
Rayonnement ß+
Noyau d’hélium 4 24He
Rayonnement α
Radioactivité naturelle : Activité d’un échantillon= nombre de désintégration par seconde (Bq). (1Bq=
1 désintégration par seconde)
1.2. Réaction nucléaire provoquée
Fission de noyaux lourds : un noyau lourd éclate sous l’impact d’un neutron
Fusion de noyaux légers : 2 noyaux légers s’associent pour former 1 noyau plus lourd. (Soleil)
un rayonnement radioactif gamma est émis, de l’énergie est libérée
2. Equation de réaction nucléaire
Nombre de masse conservé
Nombre de charge conservé
3. L’énergie liberée
Perte de masse lors de la réaction : ∆m : (valeur absolu) mproduits - mréactifs en kg
Energie libérée correspondante : E=mc² (Einstein) en Joules. C=299792458m.s-1

1. Chapitre 9: Cohésion des solides ioniques
1.1. Électrisation par frottement
Par frottement les électrons sont transférés d’un corps à l’autre (Si les électrons s’en vont d’un corps,
celui est alors chargé positivement et l’autre négativement)
Deux corps portant des charges de même signe se repoussent (signe différent s’attirent)
1.2. Loi de Coulomb
Lors des interactions électrostatiques : Force électrostatique (unité C) qu’exerce un corps A sur B
F= k * 𝑣𝑎𝑙𝑒𝑢𝑟 𝑎𝑏𝑠𝑜𝑙𝑢𝑒: 𝑐ℎ𝑎𝑟𝑔𝑒 𝐴 ∗ 𝑐ℎ𝑎𝑟𝑔𝑒 𝐵
𝑑² (d: distance entre A et B; k= 9,0*109
F (a/b) & F (b/a) même direction & valeur / entre A et B / répulsive si ^m signe ; attractive si non
1.3. Le solide ionique
Constitué d’anions (-) et de cations (+) régulièrement disposé -> électriquement neutre -- Formule
statistique (Cl-)
Chaque ion s’entoure d’ions de signe opposé
Cohésion vient de l’interaction électrostatique entre les charges opposées
2. Molécule polaire
2.1. Polarité et moment dipolaire
Dipôle électrique: 2 charges ponctuelles différentes. Il est caractérisé par son moment dipolaire p
(vecteur): va de – à +
Charge ponctuelle : q+ et q- (avec q- plus avide en électrons ; plus électronégatif)
2.2. Électronégativité
Aptitude d’un atome à attirer vers lui le doublet d’électrons dans une liaison covalente. (Élevée =
attire +)
Une liaison est polaire si l’électronégativité des deux atomes est différente. Le moment dipolaire est
d’autant plus élevé que l’électronégativité est différente.
2.3. Polarité d’une molécule
- apolaire pour molécule dipolaire d’atomes identique
-généralement polaire pour molécule dipolaire d’atomes différents
Cas d’une molécule polyatomique : somme géométrique des moments dipolaires (si pvecteur =
vecteur nul molécule apolaire)
3. Cohésion de solides moléculaires
3.1. Les solides moléculaires
Constitué de molécules régulièrement disposées dans l’espace. Leur cohésion est assurée par des
interactions intramoléculaires VdW (Van der Waals) et hydrogène. Elle est beaucoup moins forte que
celle des cristaux ioniques
3.2. Les interactions Van der Waals
Interactions électrique entre dipôles (VdW : assurent la cohésion du solide). 2 cas :
Molécules polaires : dipôles permanent : interactions électrostatiques entre dipôles (de signe
opposé)
Molécules apolaires : électrons du doublet n’ont pas de position fixe ; dipôles instantanées ->
réagissent : leur interaction assure la cohésion du solide
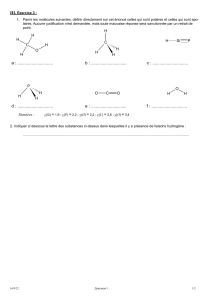
3.3. Liaisons hydrogène

Interaction attractive supplémentaire. Atome H (lié à un atome A, très électronégatif) se lie avec B (F,
O, N ou Cl) très électronégatif et porteur d’une double liaison. Elle est représentée par des pointillés.
4. Chauffage d’un solide
Energie thermique (chaleur) est transformée en énergie cinétique (croissance des agitations des
molécules et de la température).
Quand elle est suffisante= énergie utilisée pour rompre interaction (agitation ne croit pas,
température reste constante) = fusion
Solide : entièrement liquide : agitation thermique croit à nouveau, interaction existantes
disparaissent : vaporisation à température constante
1. Chapitre 10 : Comment prévoir qu’un solvant est polaire
Solution : soluté, solvant. Si elle contient des ions elle est électrolytique : elle conduit le courant et
elle est électriquement neutre
1.1. Solvants polaires et apolaires
Polaire lorsqu’il est constitué de molécules polaires (-> Chap 9)
Apolaire lorsqu’il est constitué de molécules polaires (Solvant avec que C et H : apolaire (car
l’électronégativité des 2 atomes est presque identique)
2. Dissolution d’un solide ionique dans un solvant polaire
2.1. Dissolution d’un solide ionique dans l’eau : 3 étapes
1) Dissociation du solide ionique : Cations (+) attirés par les pôles négatifs des molécules ;
anions (-) par les pôles positifs des molécules. Les interactions molécule-eau diminuent les
forces attractive du solide : les ions se dissocient du solide ionique
2) Hydratation des ions : les ions passent en solution et s’entourent de molécules d’eau
3) Dispersion des ions : Agitation thermique : ions se dispersent dans l’eau
2.2. Équation de réaction de la dissolution
Conservation des éléments chimiques et de la charge : exemple
3. Dissolution d’un composé moléculaire dans un solvant polaire
Même chose que pour l’eau (eau = polaire) sauf que l’hydratation est appelée solvatation
Les solides ioniques sont très soluble dans les solvant polaires.
3.1. Soluté polaire dans solvant polaire
Solutés moléculaires polaires : très soluble dans les solvants polaires
-> interact° dipôle-dip de type VdW s’établissent entre les moléc. Polaires du soluté et celles du solv.
->parfois aussi + formation liaisons OH : solubilité favorisé
3.2. soluté apolaire dans un solvant apolaire
solutés apolaires sont solubles dans les solvants apolaires
4. Concentration d’un ion en solution
Concentration molaire en soluté apporté -- Concentration molaire : quantité de matière /
Volume sol. C=n/v
Concentration molaire des ions en solution
Concentration de l’ion Mp+ : [Mp+] = n(Mp+)/Vsol ; Exemple :
Ici : C(S) : concentration soluté ; FeCl3 -- [Fe3+]= 1 C(S) --[Cl-]= 3 C(S)
En effet, d’après le tableau d’avancement : n(S)-xmax=0 -pour Fe3+ : xmax = n(S) -pour 3Cl- : 3xmax= 3n(S)
1
/
3
100%