Etude du cycle cellulaire du pneumocoque : vers de

1 / 4
Lyon, le 26 juin 2015
Etude du cycle cellulaire du pneumocoque :
vers de nouvelles cibles thérapeutiques
Christophe Grangeasse, responsable de l’équipe « Bactéries
pathogènes et phosphorylation des protéines » nous raconte sa
dernière découverte dans la division cellulaire bactérienne et remet
en question le dogme établi…
Votre équipe qui a été pionnière
dans l’étude de la phosphorylation
des protéines chez les bactéries, a
récemment été récompensée par
l’Académie des sciences1. Quelle est
donc cette « grande avancée en
biologie » pour laquelle vous avez
été primé avec votre étudiante
Aurore Fleurie ?
Nos projets de recherche sont centrés
sur l’étude des modifications post-
traductionnelles des protéines
bactériennes et plus particulièrement la
phosphorylation. L’existence de cette
modification chez les bactéries a été
longtemps un sujet de controverse et ce
n’est qu’au début des années 2000 que
l’existence de serine/threonine-kinases
et de tyrosine-kinases a été clairement
reconnue chez ces microorganismes.
Nous avons notamment été les premiers
à caractériser biochimiquement et
génétiquement une activité tyrosine-
kinase dans une bactérie. Plus
récemment, l’analyse de
phosphoprotéomes bactériens a montré
que de nombreuses protéines sont
phosphorylées sur la serine/threonine et
tyrosine confirmant que ces
modifications sont centrales dans la
régulation de la physiologie bactérienne.
C’est en voulant caractériser la fonction
d’une protéine phosphorylée de fonction
inconnue que nous avons mis en
évidence ce processus indispensable de
la division cellulaire chez le
pneumocoque et vraisemblablement
chez de nombreuses autres bactéries.
En quoi ce système de régulation
est-il original ?
La protéine identifiée, que nous avons
appelée MapZ, se comporte comme une
véritable balise moléculaire qui indique le
centre de la cellule à la machinerie de
division. Il s’agit donc d’un système de
régulation positif. Ce processus est
complétement inédit dans le sens ou les
systèmes précédemment identifiés chez
des bactéries modèles comme Bacillus
subtilis et Escherichia coli agissent
négativement en empêchant la
machinerie de division de se positionner
aux extrémités de la bactérie et en
favorisant ainsi son positionnement au
centre de la cellule.

2 / 4
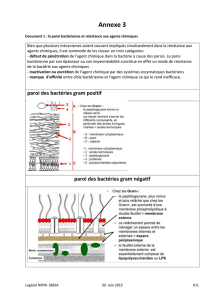
Il faut savoir que la division cellulaire
bactérienne se fait en deux grandes
étapes : l’élongation et la constriction de
la cellule. Pendant la phase d’élongation,
la bactérie produit du peptidoglycane, le
composant majeur de la paroi qui
confère la forme définitive à la cellule.
Ce peptidoglycane va pousser MapZ vers
le centre des deux cellules filles. MapZ
va donc marquer de manière
permanente le milieu de la cellule. A
partir d’une certaine taille, le
peptidoglycane ne va plus être utilisé
pour allonger la cellule mère mais pour
permettre la séparation des deux cellules
filles. Nous avons montré que cette
phase de constriction est également
contrôlée par la phosphorylation de
MapZ par la serine/thréonine kinase
membranaire StkP.
Ce mécanisme d’identification du
site de division bactérien est-il
conservé ?
Le gène codant pour MapZ est présent
dans plusieurs phyla bactériens. Une
analyse exhaustive des génomes
bactériens nous a permis de le détecter
chez les entérocoques, streptocoques et
lactocoques. Il n’est pas présent chez les
bactéries à Gram négatifs. Ceci illustre la
diversité des mécanismes de division
cellulaire bactérienne. Chaque bactérie
est donc un microorganisme à part
entière et chaque espèce développe des
processus qui lui sont propres et pas
forcément généralisables.
Vos travaux ont fait l’objet d’une
publication dans la prestigieuse
revue Nature2 et ont eu un grand
écho dans la communauté
scientifique… Quelles en sont les
applications potentielles ?
La résistance du pneumocoque aux
antibiotiques est notamment liée à sa
capacité à produire des mutations au
niveau des enzymes impliquées dans la
synthèse de la paroi. Ces mutations
rendent le pneumocoque insensible à de
nombreux antibiotiques actuellement
utilisés. Au niveau de la prévention, c’est
le même constat. Plus de cent sérotypes
du pneumocoque existent alors que les
vaccins n’en ciblent qu’une vingtaine. Il y
a donc un risque de voir des sérotypes
nouveaux, non ciblés par les vaccins,
émerger et induire des infections. A ce
jour, le pneumocoque est toujours
responsable de plus d’un million et demi
de morts par an dans le monde,
principalement chez les enfants et les
personnes âgées. Il y a donc un besoin
urgent de trouver de nouveaux moyens
de lutte contre les infections liées à cette
bactérie.
Dans ce contexte, les protéines
impliquées dans les mécanismes de la
division cellulaire représentent un
réservoir très intéressant de cibles
thérapeutiques pour lutter contre les
infections bactériennes. En effet c’est un
processus indispensable qui n’est
pourtant encore pas exploité aujourd’hui.
En bloquant la division cellulaire, on aura
alors un nouveau moyen de traitement
des infections liées au pneumocoque et
potentiellement à d’autres bactéries
pathogènes. De plus, vue la diversité des
mécanismes, on peut envisager que ces
futures molécules permettront de lutter
sélectivement contre certaines espèces
en ménageant d’autres espèces
profitables pour la santé.
De la même manière, une autre
approche intéressante consiste à cibler la
synthèse de la capsule polysaccharidique
du pneumocoque. Ces composés
définissent le sérotype d’une souche et

3 / 4
sont également le principal facteur de
virulence du pneumocoque. Cette
synthèse de capsule est également
contrôlée par phosphorylation par une
autre protéine-kinase qui est également
étudiée au laboratoire. Cette protéine-
kinase phosphoryle ses cibles au niveau
de la tyrosine et est également
conservée dans la plupart des phyla
bactériens. Cet axe est notamment
étudié au laboratoire depuis de
nombreuses années chez d’autres
bactéries modèles comme
Staphylococcus aureus et nous avons
déjà déposé un brevet3 sur cela.
L’étude de la régulation par
phosphorylation de la division cellulaire
et de la synthèse de la capsule
polysaccharidique chez le pneumocoque
sont donc devenues les deux
thématiques de recherche principales de
mon équipe.
Vous avez bénéficié avec Céline
Brochier du financement par
ECOFECT des gratifications d’un
stage de Master 2 cette année. Votre
étudiant, Pierre Garcia a d’ailleurs
présenté ses premiers résultats lors
de la journée ECOFECT. Comment
envisagez-vous l’avenir ?
Pierre travaille également sur la division
cellulaire du pneumocoque mais en
utilisant une approche novatrice et
interdisciplinaire alliant phylogénomique
et biologie cellulaire. Grâce aux données
expérimentales que nous avons
obtenues, l’idée de ce projet est de
reconstruire l’histoire des gènes de la
division cellulaire bactérienne et
d’étudier leur environnement génétique
pour identifier de nouveaux acteurs de la
division, construire un modèle intégré et
tester la portée de ce modèle chez
d’autres bactéries. Les résultats de
Pierre sont très prometteurs et il a déjà
identifié un nouveau gène impliqué dans
la morphogenèse du pneumocoque. Ses
travaux ont débouché sur un projet de
thèse et Pierre candidate auprès de
l’EDISS pour une bourse doctorale. En
parallèle, nous allons avec Céline
demander un financement à ECOFECT
via l’appel à projets au fil de l’eau. Nous
envisageons donc le recrutement de
deux doctorants complémentaires sur ce
projet et partageant leur temps de
travail entre nos deux laboratoires.
Qu’est-ce que le LabEx vous apporte
d’autre ?
Grâce à ECOFECT, j’ai pu rencontrer des
personnes que je ne connaissais pas.
Notamment c’est au cours des
rencontres organisées, que j’ai eu
l’occasion de discuter avec Céline et de
poser les bases du projet que nous
développons actuellement ensemble. Les
thématiques du LabEx correspondent
bien à nos axes de développement. Le
groupe de travail sur l’antibio-résistance
qui est en train de se constituer
m’intéresse particulièrement et je pense
que ce sera le lieu idéal pour créer de
nouvelles interactions avec d’autres
groupes du LabEx.
Qu’est-ce qui vous anime dans votre
métier de chercheur ?
J’ai toujours été un expérimentateur
dans l’âme mais honnêtement je ne me
destinais pas spécialement au métier de
chercheur. Cela s’est construit petit à
petit au fil de mes études. Aujourd’hui
mon métier me passionne. Même si je ne
manipule (presque) plus faute de temps,
ce qui me manque un peu, je consacre
l’essentiel de mon travail à la recherche
de financements, la communication de
nos résultats lors de congrès et par la

4 / 4
rédaction d’articles, le management de la
recherche et la mise en place de
nouveaux projets. Heureusement, j’ai la
chance d’être entouré dans l’équipe de
collègues formidables et notamment de
super doctorants qui sont également
passionnés par les thématiques que nous
développons. Le métier de chercheur
évolue avec la carrière et c’est aussi
super excitant ! Ainsi, je participe à
différent comités d’évaluation de
l’activité de laboratoires, de projets de
recherche ou encore de l’activité de
doctorants. Je participe également à des
comités d’organisation ou scientifique de
congrès comme celui que nous avons
monté l’an dernier en Allemagne sur les
modifications post-traductionnelles des
bactéries. Un deuxième colloque sur
cette thématique qui est en plein essor
devrait avoir lieu en septembre-octobre
2016 à Lyon.
Le rendez-vous est pris…
1 : Les grandes avancées françaises en biologie présentées par leurs auteurs – Académie des
sciences – mardi 26 mai 2015, Aurore Fleurie et son directeur de Recherche Christophe Grangeasse
(Bases moléculaires et structurales des systèmes infectieux, CNRS UMR5086, Université de Lyon 1,
69007 LYON), « Division de la cellule bactérienne : au commencement était une balise
moléculaire... ».
2 : Fleurie A*, Lesterlin C*, Manuse S*, Zhao C, Cluzel C, Lavergne JP, Franz-Wachtel M, Macek B,
Combet C, Kuru E, VanNieuwenhze MS, Brun YV, Sherratt D, Grangeasse C (2014). MapZ marks
the division sites and positions FtsZ rings in Streptococcus pneumoniae Nature, 516:259-62
* co-premiers auteurs
3 : Grangeasse C, Nessler S, Morera S, Meyer P, Cozzone AJ, Terreux R. “Inhibitors of bacterial
tyrosine kinase and uses thereof”, WO 2009/133209-A1, publié le 05/11/09.
A propos de l’équipe de Christophe Grangeasse : http://perso.ibcp.fr/christophe.grangeasse/
A propos du Laboratoire d’Excellence ECOFECT :
Financé par l’ANR dans le cadre du programme « Investissements d’Avenir », ECOFECT est un
Laboratoire d’Excellence sélectionné en 2011 et regroupant 195 personnes. Il vise à décrypter les
maladies infectieuses et leur rôle dans l’évolution des organismes pour mieux les prévenir et les
soigner, à comprendre comment les changements globaux transforment les maladies humaines et
animales et ambitionne de développer des diagnostics intégrés et des traitements durables plus
justes. ECOFECT construit une expertise nouvelle, en se fondant sur la complémentarité de
différentes communautés d’excellence existant sur Lyon : d’une part virologues, bactériologistes,
immunologistes et cliniciens et d’autre part écologues et évolutionnistes.
http://ecofect.universite-lyon.fr
Contacts : Christophe Grangeasse, christophe.grangea[email protected] et Laurence Naiglin,
laurence.naiglin@univ-lyon1.fr , Tel. 04 72 43 18 05
1
/
4
100%