Texte de la 28ème conférence de l`Université de tous les

1
Texte de la 28ème conférence de l'Université de tous les savoirs réalisée le 28 janvier 2000
par Jean-Paul Renard
Le Clonage
La naissance du mouton Dolly "a fait la une" dans les médias du monde entier. Chez cette
brebis, le noyau qui contient son patrimoine génétique a été prélevé de la glande mammaire
d'une de ses congénères. Il a ensuite été transplanté dans un ovule prélevé sur une autre
brebis, ovule dont on avait préalablement retiré le matériel génétique, c'est à dire les
chromosomes maternels. Preuve était faite que même les mammifères peuvent se reproduire
par une autre voie que la voie sexuée ! D'où la grande inquiétude : serait-il possible de faire
chez l'homme ce que l'on a fait chez l'animal ?
Qu'est-ce qu'un clone ?
Un clone est un ensemble d'organismes génétiquement identiques.. Il est possible de cloner
des molécules, des cellules ou des êtres vivants, qu'il s'agisse de micro-organismes, de
végétaux ou d'animaux. Le clonage est un mode de reproduction naturel chez de nombreuses
espèces. Ainsi, les bactéries peuvent se reproduire par scissiparité, les plantes par bouturage
ou marcottage, et de nombreux invertébrés (abeille, puceron, daphnies) par parthénogenèse.
Dans tous les cas et contrairement à une idée répandue, le clone au sens de copie conforme
n'existe pas en biologie : car même s’ils sont génétiquement identiques, deux organismes
vivants manifesteront très vite des différences dues au fait que l’environnement vient moduler
l’action des gènes.
Telle était la définition du clone avant l’annonce de la naissance du mouton Dolly. Depuis, la
publicité que lui a consacré la revue scientifique “ Nature ” a fait évoluer l’usage de ce mot: il
sert maintenant le plus souvent à désigner un animal, fut il unique, obtenu à partir du noyau
d’une cellule non reproductrice, c’est à dire d’une cellule somatique, prélevée sur un animal
adulte. Dolly était unique puisque l’animal sur le quel avait été prise la cellule donneuse de
noyau, cellule qui avait été cultivée puis conservée à l’état congelé, était mort bien avant la
naissance du fameux mouton. Mais Dolly fut appelée “ clone ”. Depuis, d’autres mammifères
clonés ont vu le jour, notamment des veaux et plus récemment des souris, quelques chèvres et
quelques porcs. Depuis deux ans, nous avons produit quelques souris et une douzaine de
veaux clonés de la race Holstein au laboratoire de l’INRA de Jouy-en-Josas. Certains de ces
veaux sont issus de noyaux provenant du même animal donneur et sont donc bien
génétiquement identiques. Pourtant la répartition des taches noires et blanches de leur pelage
diffère d’un individu à l’autre ; placés au milieu d’autres veaux non clonés, on a quelques
difficultés à les reconnaître ; si on les observe plus attentivement , on constate par exemple
que leur comportement alimentaire est en certains points très semblable, mais en d’autres très
différents.. On est loin de la vision simpliste du clonage comme ” photocopieuse ”.
Les voies du clonage
Trois techniques très différentes permettent d'obtenir des animaux génétiquement identiques : la dissociation, la
section ou le transfert de noyaux.
La dissociation consiste à prendre les cellules d'un tout jeune "embryon". Le mot embryon est
utilisé ici comme un nom générique désignant les premiers stades du développement depuis le
stade “ une cellule ”, c’est à dire celui de l'œuf fécondé, jusqu’au stade blastocyste à partir
duquel se réalise l’implantation dans l’utérus de la mère. Au delà commence le

2
développement du fœtus, même si souvent on réserve l’usage de ce mot à la période plus
tardive à partir de laquelle apparaît une forme organisée (avec une partie antérieure et une
partie postérieure) qui prendra ensuite un aspect caractéristique de l’espèce concernée. Pour
obtenir un clone par dissociation, il faut partir des cellules issues soit de la première (deux
cellules), de la deuxième (quatre cellules), ou, tout au plus, de la troisième (huit cellules)
division de l’œuf. En les replacant soit seules, soit par groupe de deux dans la petite coque de
glycoprotéines qui entoure l’œuf, la zone pellucide, on obtient autant d’embryons qui peuvent
ensuite, chacun ou par groupe de deux, être transplantés dans une femelle porteuse. Le singe
“ Tétra ”, né récemment dans un laboratoire de l’Oregon aux USA, a été obtenu de cette
façon. Une équipe canadienne de l’Université de Guelph a pu, il y a quelques années, produire
4 veaux à partir des huit cellules d’un embryon ce qui constitue un record.
La scission d'un embryon se fait à un stade un peu plus tardif au stade blastocyste (ou
blastula). A ce stade, les cellules de l’embryon viennent juste de commencer à se différencier
en deux types bien distincts, celles qui ne donneront que le placenta, et celles qui donneront le
fœtus et une partie du placenta. La zone pellucide commence à se fendre ce qui permettra au
blastocyste de s’implanter. Si on coupe en deux parties ce blastocyste, en prenant soin de
répartir à peu près également les deux types cellulaires facilement reconnaissables, on peut
obtenir des jumeaux. C'est d’ailleurs ce qui se produit naturellement, mais très
occasionnellement quand, au moment de s’échapper de la zone pellucide, l’embryon se trouve
momentanément géné par une ouverture qui se révèle être de façon fortuite trop étroite. Telle
est l’origine, chez l’homme, des jumeaux vrais, c’est à dire issus du même œuf. Et ce n’est
pas injure leur faire que de dire que biologiquement parlant, les vrais jumeaux sont bien des
clones ! Il y a quelques années, nous nous étions appuyé sur ces observations pour produire
des jumeaux bovins par scission de blastocyste ; la technique s’est avérée très efficace
puisque la moitié des vaches gestantes après transfert des deux demi embryons avaient donné
naissance à des jumeaux ! Mais couper un blastocyste en quatre révéla vite son défaut, les
quatre lots de cellules étant alors trop petits pour pouvoir chacun reformer un blastocyste
capable ensuite de pouruivre son développement.
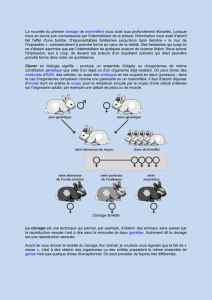
Le transfert de noyau consiste à placer au contact d'un ovule énucléé (sans chromosomes
maternels) une cellule provenant d'un tissu déjà différencié, qui contient donc les deux stocks
de chromosomes parentaux. En pratique on utilise des ovules provenant de femelles
différentes dont on ne garde que le cytoplasme; ainsi, dans le cas de la vache, ces ovules
peuvent être ponctionnées directement dans les follicules d’ovaires récupérés dans des
abattoirs, ce qui permet de disposer très rapidement de plusieurs dizaines de cytoplasme
receveurs pour les noyaux. On a recours à différents procédés pour s’assurer que le noyau de
la cellule donneuse rentre dans l'ovule receveur. Une des étapes de cette opération minutieuse
consiste à fusionner la membrane de la cellule donneuse de noyau avec celle de l’ovule. Pour
cela on se sert d’une courte impulsion électrique qui ne dure que quelques microsecondes
mais qui suffit pour déstabiliser très transitoirement les membranes et permettre à la fois leur
fusion et l’activation de l’œuf, c’est à dire la mise en route de modifications chimiques qui
conduiront à la réalisation de la première division. Le développement de "l'œuf reconstitué"
peut alors commencer. Transplanté dans une mère porteuse, le veau obtenu sera
génétiquement identique à la vache donneuse de noyau, qu'il s'agisse d’une cellule de glande
mammaire, comme cela a été le cas pour Dolly en février 1997, ou de celui d’un muscle
comme pour la vache Marguerite née à l’INRA en février 1998. Le rôle du cytoplasme de
l’ovule mérite ici d’être souligné car c’est lui qui va réorganiser le noyau pour lui faire
retrouver un état embryonnaire. Cet étonnant pouvoir est encore loin d’être compris : on sait
seulement que l’ovule est une cellule tout à fait particulière qui contient plusieurs millions de

3
molécules fabriquées au cours de l’ovogénèse, c’est à dire pendant cette longue période qui
commence dés la vie fœtale de la femelle après que se soit différenciée la gonade. Ces
molécules sont indispensables au contrôle des premières divisions de l’œuf car le noyau est à
ce moment là incapable par lui-même de toute activité de synthèse. Il ne deviendra
véritablement actif que progressivement et après que le cytoplasme de l’ovule l’ait
profondément réorganisé. Ces premiers échanges entre le noyau et le cytoplasme sont
déterminants pour la suite du développement. On commence à réaliser qu’ils peuvent affecter
le fonctionnement de gènes qui ne s ‘expriment que plus tard au cours de l’embryogénèse et
l’on soupçonne même que ces effets peuvent se faire sentir après la naissance ! En outre le
cytoplasme de l’ovule est riche en ces organites cellulaires que sont les mitochondries qui
jouent un rôle essentiel dans le contrôle du métabolisme cellulaire. Les mitochondries
possèdent leur ADN propre qui ne sera utilisé qu’après plusieurs divisions, un peu avant le
stade blastocyste,et en interaction avec l’ADN du noyau. Il faut donc qu’un “ dialogue ”
constructif puisse s’établir rapidement entre le cytoplasme de l’ovule et le noyau donneur
alors même que celui ci a en quelque sorte leurré le cytoplasme programmé chez les
mammifères pour accueillir un spermatozoïde. Comprendre comment le noyau se trouve ainsi
être dé-différencié en un noyau embryonnaire est la question fondamentale de biologie que
pose le clonage
Technique, science :technoscience et clonage
Quelque soit l’espèce considérée, le rendement de la technique de transfert de noyaux
est faible : un à trois pourcents seulement des embryons reconstitués se développement à
terme alors qu’après fécondation in vitro, ce taux est d’environ 50%. Il est vrai que nous
n'avons que très peu de recul, à peine trois ans, mais ce faible rendement est aussi un fait chez
la grenouille où pendant de nombreuses années des chercheurs tentèrent, sans succès,
d’obtenir un animal adulte (au delà du stade larvaire) à partir du noyau d’une cellule
somatique elle même prélevée sur un autre adulte. Les données qui commencent à être
publiées suggèrent que l’efficacité diminue quand le noyau provenant du même type cellulaire
(par exemple un fibroblaste) est prélevé sur un animal adulte par rapport à un fœtus sans que
l’on puisse dire pour l’instant si cette différence est due au fait qu’une plus grande partie des
noyaux donneurs est porteuse d’anomalies génétiques après prélèvement chez l’adulte ou si il
s’agit d’une moins grande aptitude à subir les remaniements imposés par le cytoplasme de
l’ovule. Si on utilise des noyaux de cellules embryonnaires (prélevés juste avant
l’implantation) l’efficacité est plus élevée et on peut obtenir (chez le bovin) en moyenne 10
veaux pour cent embryons reconstitués. Par contre l’âge de l’animal adulte semble peu
affecter les résultats. Une autre observation est que dans tous les cas, et contrairement à ce qui
se produit aussi bien dans les conditions de reproduction naturellles qu’après insémination
artificielle ou fécondation in vitro, le taux d’avortements tardifs est élevé, un peu comme si le
filtre que constitue l’implantation fonctionnait moins bien pour les embryons clonés. Les
causes sont apparemment multiples et comme nous le verrons plus loin, pas seulement
génétiques.
A ce jour, environ cent cinquante veaux clonés sont nés dans le monde, une
quarantaine de moutons, moins de vingt chèvres, quelques porcs.. C’est peu au regard des
cinq milliards de veaux nés par insémination artificielle depuis 1950, des deux millions nés
après transfert d'embryons depuis 1975 ou des cent mille issus de fécondation in vitro depuis
1988 ! Curieusement, les premiers clones de souris n’ont été obtenus que près de deux ans
après la naissance du mouton Dolly, et ceci malgré les nombreux efforts réalisés pendant près

4
de vingt ans par plusieurs équipes. Ces échecs avaient fait considérer le clonage comme
“ biologiquement impossible ” chez les mammifères ! Aujourd’hui, les succès avec cette
espèce sont encore peu nombreux. Mais la situation pourraient changer: en jouant à la fois sur
les conditions techniques de reconstitution de l’embryon et sur la composition du milieu de
culture avant transfert dans une femelle receveuse nous venons de montrer que l’on pouvait
obtenir un taux d’implantation élevé, et que c’était surtout la mortalité fœtale tardive qui était
responsable du faible rendement. Les quelques souris obtenues sont par contre
physiologiquement normales et peuvent se reproduire normalement.
Les clones commencent donc à naître régulièrement dans les laboratoires et ils forcent au
constat suivant : un clone est un animal dont la généalogie brouille très vite les repères
auxquels nous sommes habitués. Avec le clonage, un animal donneur de noyau peut avoir
plusieurs clones d’âge différents dont peuvent être dérivés des clones de clones si l’opération
de transfert de noyaux est répétée à partir de cellules prélevées sur un animal lui même issus
de clonage. Un clone femelle peut avoir cinq mères : la “ mêre ” donneuse de noyau ; celle
qui a donné le cytoplasme receveur ; la mère porteuse ; la mère qui l’allaite (nous avons
fréquemment recours à cette mêre car les mêres porteuses que nous utilisons sont des vaches
de la race charolaises moins bonne laitières que celles de la race Holstein) ; et… la mêre
génétique, c’est à dire celle qui a donné naissance à la mêre donneuse de noyau en lui
transmettant ses gènes ; il a dans tous les cas un pére, le père génétique, indispensable chez le
mammifères où la parthénogénèse (c’est à dire le développement à terme d’un ovule activé
sans fécondation), n’est pas possible. Si ce clone est un mâle, il a un deuxième père, le
donneur du noyau et jusqu’à quatre mères. Quand aux clones de clones, leur grand-mère
donneuse de noyaux est aussi leur soeur génétique (même père et même mère) et les autres
membres du premier lot de clones sont à la fois leurs tantes (ou oncles) et leurs sœurs (ou
frères). Nous venons, à des fins expérimentales de constituer une telle tribu de 10 vaches à
l’INRA : définir un système d’identification pour ces animaux n’est pas une mince affaire !
Génèse, épigénèse : le clonage, un outil pour la recherche fondamentale
Le clonage est d’abord un nouvel outil pour l’une des grands thématiques de la recherche
fondamentale : celle de la différenciation cellulaire. Au fur et à mesure que les tissus se
forment, les cellules se spécialisent dans différentes fonctions ; dans de très nombreux tissus,
on trouve des cellules qui en se divisant sont capables de donner à la fois une cellule identique
à elle-mêmes et une autre cellule différenciées : ces cellules multipotentes sont aussi appelées
cellules souches. La transformation d'une cellule souche en une cellule différenciée obéit à un
mécanisme contrôlé qu'il convient de comprendre. En effet, le dérèglement de cette division
reproduit ce qui se passe quand des cellules se mettent à proliférer de façon anarchique et à
devenir cancéreuses. Comprendre avec le transfert de noyaux comment une cellule peut en
quelque sorte revenir en arrière en modifiant le programme de développement qui l’avait faite
passer de l’état d’œuf à celui de cellule différenciée devrait nous conduire à mieux cerner les
conditions qui engagent une cellule à devenir tumorale. Avec le transfert de noyaux, la cellule
fusionnée avec le cytoplasme de l’ovule retrouve un état totipotent, c’est à dire un état qui lui
permet, à elle toute seule, de redonner toutes les cellules de l’organisme. Cet état redonne une
vigueur nouvelle aux cellules. C’est ce que montre l’expérience suivante réalisée récemment
chez la vache. Elle consiste, dans un premier temps, à mettre en culture des cellules prélevées
sur un animal, par exemple des fibroblastes qui se divisent un certain nombre de fois, environ
30 à 50 , avant de rentrer dans un état de sénéscence ; dans un deuxième temps, on produit par
clonage un fœtus à partir du noyau de ces cellules et on met à nouveau des fibroblastes en

5
culture : on constate que ceux ci peuvent alors à nouveau se diviser autant de fois que lors de
la première culture; et peut être même plus !
Cette jouvence cellulaire observée en culture a éveillé le fantasme d’immortalité qu’évoque le
clonage alors que quelques mois auparavant, mais en sens opposé, on affirmait que Dolly
vieillissait plus vite que son âge parce que certaines régions de ses chromosomes, les
extrémités ou télomères (qui jouent un rôle clé pour maintenir normal le nombre de
chromosomes à chaque division), étaient plus semblables à celles de l’animal donneur de
noyaux agé de six ans qu’à celle d’un animal de deux ans ! Dans les deux cas, c’est extrapoler
rapidement de la cellule en culture à l’animal vivant, en oubliant d’intégrer toute la
complexité des régulations qui permettent à un organisme complexe d’exister : on a sans
doute plus l’âge de ses artères que celui de ses télomères, et Dolly et les autres clones ont bien
l’âge physiologique qui correspond à leur naissance! Seuls quelques type cellulaires ont à ce
jour été utilisés comme source de noyaux. Et aucun d’entre eux ne correspondaient à des
cellules ayant atteint un stade de différenciation terminal in vivo. L’étude des remaniements
du noyau de ces cellules après clonage serait pourtant très précieux pour comprendre
comment l’environnement cellulaire peut dicter à une cellule les conditions qui aboutissent à
son engagement dans une fonction spécialisée, comme c’est le cas par exemple pour les
cellules neuronales ou bien les kératinocytes qui forment la surface de notre peau.
Le clonage permet aussi d’aborder de nouvelles questions fondamentales. C’est le cas par
exemple pour celle qui concerne le rôle important et jusqu’à une date récente ignoré, de
l’environnement de l’embryon sur le développement fœtal et celui du jeune après la
naissance. L'environnement est pris ici dans un sens très large puisqu'il peut s'agir de
l'environnement du noyau avec le cytoplasme de l'ovule, de l'environnement de l'embryon
cloné avec son milieu de culture ou celui que constitue l'environnement utérin au cours de la
vie fœtale. Le clonage révèle que cette épigénèse, c’est à dire l'ensemble des mécanismes qui
se surimposent à ceux déterminés par l'ADN et qui influencent un caractère, est de fait à
l’oeuvre dès les premiers stades du développement. L’effet à long terme de l’environnement
sur l’activité du noyau s’est manifestée de façon spectaculaire avec deux de nos clones
bovins, dont l’un était la vache Marguerite, née tout à fait normalement après clonage
somatique. Deux mois après leur naissance, soit au moment du sevrage, ces animaux n’ont pu
activer leur système immunitaire et sont morts en quelques jours d’une infection généralisée
avec gangrène fulgurante ; l’autopsie révélera que toutes les fonctions s’étaient développées
normalement à l’exception de la fonction immunitaire, le thymus n’étant pas devenu mature.
Aucune anomalie génétique ne put être décelée sur les tissus, et nous pûmes conclure que ce
déréglement physiologique trouvait son origine dans le transfert de noyau qui n’avait pourtant
pas empéché la mise en place des autres fonctions de l’organisme. D’autres manifestations
tardives du clonage commencent maintenant à être documentées : les clones issus de cellules
somatiques différenciées sont, à la naissance, en moyenne plus lourds que les veaux nés après
insémination artificielle (6 kg en moyenne), et 20 à 30 % d’entre eux ont un surpoids de 10 à
25 kg avec des manifestations de type diabétique et des anomalies cardio-vasculaires. Ces
dysfonctionnements semblent résulter du fait que, par rapport aux fœtus normaux, les fœtus
clonés ont une croissance qui semble se synchroniser plus difficilement avec les variations
d’apports nutritifs du milieu utérin. Ces désynchronisations sont aussi observées après
reproduction normale, mais avec un fréquence faible, quand l’alimentation de la mère est mal
adaptée aux besoins du fœtus. Les clones bovins se révèlent être des bons modèles pour
mieux comprendre l’origine fœtale (et non seulement génétique) de physiopathologies
prévalentes dans notre propre espèce
 6
6
 7
7
 8
8
 9
9
1
/
9
100%