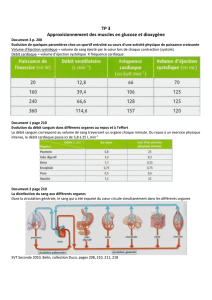
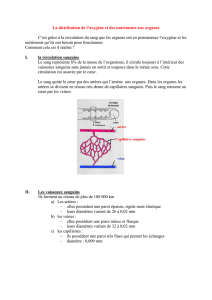
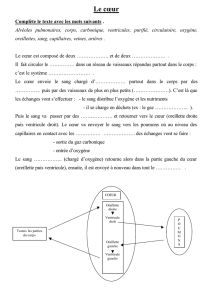
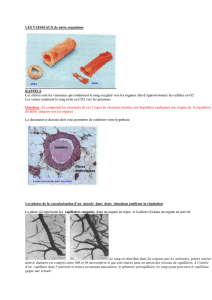
B2 - Le parc

B2 - Un exemple d’intégration d’une fonction à l’échelle de l’organisme : la circulation sanguine
Connaissances de premier ordre indispensables
Capacités exigibles
1. Le système de distribution du sang : une double circulation, pulmonaire et systémique
La circulation sanguine est un système de distribution à haut débit de nutriments, gaz, ions, hormones, au sein de l’organisme. Chez les mammifères,
existent deux boucles circulatoires, disposées en série : la circulation pulmonaire (ventricule droit - poumons - oreillette gauche) et la circulation
systémique (ventricule gauche - organes disposés en parallèle - oreillette droite). Dans chacune de ces boucles, le sang s’écoule suivant un gradient
longitudinal de pression sanguine. Au repos plus de la moitié du volume sanguin se trouve dans les veines. À débit constant, la vitesse du sang est
inversement proportionnelle à l’aire des sections cumulées des vaisseaux : c’est dans les capillaires que le sang circule le plus lentement. Les artères
élastiques ont trois fonctions : elles connectent le cœur et les organes avec une faible résistance à l’écoulement liée à leur diamètre important (fonction
de conduit). ; grâce à leur élasticité, elles complètent le travail de pompe du cœur et transforment le flux sanguin pulsé provenant du cœur, en flux
continu au niveau des organes et des tissus (fonction d’amortissement). Les artères musculaires et les artérioles, capables de vasomotricité, contrôlent
les paramètres circulatoires. La résistance périphérique totale, à laquelle est proportionnelle la pression artérielle moyenne, augmente en cas de
vasoconstriction générale (et diminue en cas de vasodilatation générale). Les débits sanguins locaux varient en fonction de l’activité des organes grâce
à la vasomotricité des réseaux artériolaires de chacun. La microcirculation est constituée des réseaux capillaires très ramifiés (offrant ainsi une vaste
superficie) que le sang parcourt à faible vitesse (du fait de la forte section cumulée) et sans chute de pression majeure (du fait de la disposition des
capillaires des réseaux en parallèle). Ces caractéristiques sont favorables aux échanges transcapillaires. Les capillaires ne sont pas doués de
vasomotricité ; les débits qui les traversent sont contrôlés en amont par les artérioles et les sphincters précapillaires. Les échanges capillaires peuvent
s’effectuer au niveau des organes, entre plasma et liquide interstitiel, ou au niveau des surfaces d’échanges de l’organisme, entre plasma et le milieu
extérieur. La nature des substances auxquelles les capillaires sont perméables est déterminée par la structure de leur paroi (nature des jonctions entre
les cellules endothéliales ou continuité de la lame basale). Les capillaires les plus répandus sont de type continu (jonctions adhérentes entre les cellules
endothéliales et lame basale continue). L'apport des nutriments, de l'oxygène, l'élimination des déchets cellulaires et la distribution des hormones
reposent sur la diffusion. Les capillaires sont aussi le siège de mécanismes de filtration - réabsorption qui déterminent la distribution des liquides, entre
plasma et lymphe interstitiel, assurent le retour au sang des protéines qui auraient filtré et alimentent la circulation de la lymphe.
2. Le cœur : une double pompe mettant le sang sous pression
Le cœur est un muscle creux cloisonné en deux moitiés, constituée chacune d’une oreillette qui reçoit le sang par les veines et d’un ventricule qui
envoie le sang dans les artères. Des valvules auriculo-ventriculaires d’une part, et artérielles d’autre part, en s’opposant au reflux du sang, contraignent
la circulation intracardiaque de façon unidirectionnelle, d’une oreillette vers un ventricule puis vers des artères. Le cœur est constitué de deux pompes
juxtaposées et synchronisées qui mettent le sang sous pression, ce qui permet son écoulement dans les vaisseaux sanguins. Un cycle cardiaque dure en
moyenne 0,8 s ; deux évènements majeurs se succèdent alors : une phase de relâchement des ventricules, la diastole ventriculaire (0,5 s), au cours de
laquelle les ventricules se remplissent de sang et une phase de contraction, la systole ventriculaire (0,3 s) qui aboutit à l’éjection du sang dans le système
artériel. Les volumes sanguins auriculaires ou ventriculaires sont identiques dans le cœur droit et le cœur gauche à chaque étape du cycle. Il en résulte
que le volume de l’ondée systolique est identique pour les deux ventricules et égal à 70 mL au repos. Même en fin de systole, les cavités cardiaques ne
sont jamais vides de sang. Le cœur est à l’origine du débit sanguin global (ou débit cardiaque), produit de la fréquence de battements par le volume
d’éjection systolique. Au repos chaque ventricule propulse en une minute dans les artères, un volume de sang égal au volume sanguin de l’organisme
(5 L). La pression d’éjection du sang étant cinq fois plus élevée pour le cœur gauche que pour le cœur droit, le travail cardiaque du cœur gauche se
trouve augmenté dans des proportions équivalentes.
3. Le cœur présente un automatisme de fonctionnement, conséquence des propriétés du tissu nodal
Le déclenchement de la contraction cardiaque trouve son origine dans le tissu nodal, situé dans le cœur-même, ce qui fait du cœur un organe
automatique. Les cellules du nœud sino-auriculaire (NSA), pacemaker physiologique, génèrent spontanément un potentiel d’action qui se propage
directement au myocarde auriculaire puis au myocarde ventriculaire par le nœud auriculo-ventriculaire (NAV), puis le faisceau de His et le réseau de
Purkinje. Les caractéristiques électrophysiologiques du NAV sont responsables du délai entre l’activation des oreillettes et celle des ventricules. La
transmission du potentiel d’action cardiaque au sein du tissu nodal, des cellules nodales aux cellules myocardiques, et au sein du myocarde, se fait par
synapses électriques à travers des jonctions lacunaires.
Les cellules nodales sont excitables en l’absence de toute stimulation extérieure. Elles génèrent des potentiels de pacemaker : leur membrane se
dépolarise spontanément suite à l’ouverture de canaux cationiques peu sélectifs activés en dessous d’un potentiel de membrane seuil. Le courant
entrant sodique qui s’ensuit provoque une dépolarisation électrotonique suivie d’un potentiel d’action dont la phase de dépolarisation est due à
l’ouverture de canaux calciques voltage-dépendants. Ainsi est générée l’excitation cardiaque, qui propagée à l’ensemble des cellules du cœur déclenche
leur contraction. Sur un cœur isolé, la fréquence des potentiels d’action du pacemaker physiologique, le NSA, est très supérieure à la fréquence
cardiaque de repos, ce qui montre que dans l’organisme au repos s’exerce un contrôle de la fréquence cardiaque
Figure B2.1
Présenter l’organisation générale du système circulatoire : circulation
systémique et circulation pulmonaire
Présenter les différents segments vasculaires : artères (1° partie II), artérioles
(1°partie II), capillaires (1°partie III), sous leurs différents aspects
anatomiques, histologiques, fonctionnels
Figures B2.7 et B2.8
Relier la description du cycle cardiaque au rôle de pompe du cœur.
2° partie IB Mettre en relation débit cardiaque, fréquence et volume
d’éjection systolique.
Figure B2.10
Relier la localisation des structures impliquées dans l’automatisme avec la
séquence de contraction.
Figure B2.11
Expliquer le lien entre le rythme cardiaque et l’activité des cellules nodales
(potentiel de pacemaker).
Établir le lien entre conductance ionique et variations du potentiel
membranaire des cellules nodales.
Le lien entre l’activité du tissu nodal et le déclenchement de la contraction
des cellules musculaires cardiaques est simplement mentionné. Le
mécanisme de contraction des cellules musculaires cardiaques n’est pas au
programme.

Ce contrôle s’exerce notamment par l’intermédiaire du système nerveux végétatif. Les axones du système parasympathique se terminent au voisinage
des cellules du NSA ; elles libèrent de l’acétylcholine dans les fentes synaptiques. Ceux du système sympathique innervent les cellules nodales et les
cellules du myocarde ; elles libèrent de la noradrénaline. Acétylcholine et noradrénaline exercent une action antagoniste sur la fréquence cardiaque, en
se fixant à des récepteurs membranaires spécifiques des cellules du NSA. Ces récepteurs, muscariniques pour l’acétylcholine, adrénergiques pour la
noradrénaline, sont couplés à des protéines G (fixant le GTP). La nature de la sous-unité α des protéines G interagissant avec le récepteur membranaire
détermine les effets cellulaires de celui-ci. L’acétylcholine stimule l’ouverture de canaux potassiques et maintient fermés les canaux HCN des cellules
nodales, alors que la noradrénaline stimule leur ouverture. Ainsi la conductance membranaire à l’origine du potentiel de pacemaker dépend directement
de la concentration des neuromédiateurs dans la fente synaptique. L’AMPc peut agir comme second messager dans la réception, par les cellules
nodales, du message codé par ces neuromédiateurs. Ce mode d’action demande un plus long délai que dans le cas de la fixation sur un récepteur canal
ionique tout en entraînant une amplification de la réponse.
2° partie III Décrire les mécanismes du contrôle de la fréquence cardiaque
par les cellules nodales jusqu’à l’échelle cellulaire et moléculaire.
L’organisation du système neurovégétatif n’est pas au programme.
1
/
2
100%