Loi d`Avogadro-Ampère Activité documentaire tiré

Physique Chimie 2
nde
Activité documentaire 14 : Loi d’Avogadro-Ampère
Activité documentaire tiré du manuel de seconde de Bordas
Objectifs
:
Loi d’Avogadro-Ampère
Compétences : S’approprier, analyser, réaliser, valider
Problématique : Le volume occupé par une certaine quantité de gaz dépend-il de la nature de ce gaz ?
Questions :
1- Avogadro et Ampère travaillaient-ils ensemble lorsqu’ils ont formulé l’hypothèse qui porte leur nom ?
Faisaient-ils les mêmes recherches ?
2- Ecrire l’équation de la réaction de synthèse de l’eau à partir du dihydrogène et du dioxygène
3- Vérifier la loi de Gay Lussac à travers l’exemple proposé dans le texte
4- Expliquer la loi de Gay-Lussac à l’aide de la loi d’Avogadro-Ampère
5- Proposer un protocole expérimental permettant de déterminer la masse de gaz enfermé dans une bouteille
6- Déterminer le nombre de molécules contenues dans chacune des bouteilles
7- A quoi correspond le volume molaire d’un gaz ? Calculer ce volume molaire pour les différents gaz
8- Est-il vrai de dire que : « Des volumes égaux de gaz différents, pris dans les mêmes conditions de
température et de pression, renferment autant de molécules » ?
9- Est-il vrai de dire que : « Des volumes égaux de gaz différents, pris dans les mêmes conditions de
température et de pression, ont la même masse ?
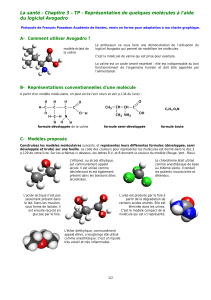
Document 1 : Deux hommes, une même hypothèse
S’intéressant aux masses relatives des
atomes constituant la matière, le
chimiste italien Amedeo Avogadro
(1776-1856) formule en 1811
l’hypothèse que des volumes égaux de
gaz différents, pris dans les mêmes
conditions de température et de
pression, renferment autant de
molécules.
Il fonde son raisonnement notamment sur la loi
énoncée en 1809 par le français Louis-Joseph Gay-
Lussac (1778-1850), selon laquelle les gaz se
combinent en volume dans des proportions simples
(par exemple, deux volumes d’hydrogène et un
volume d’oxygène se combinent en en deux volumes
de vapeur d’eau).
Cette hypothèse n’est pas acceptée
tout de suite par la majorité des
chimistes de l’époque. Il faut dire
qu’au début du XIXème siècle le
modèle de la matière commence
tout juste à se construire.
En 1814, sans avoir entendu parler
des travaux d’Avogadro, le chimiste
français André-Marie Ampère parvient à la même
hypothèse en s’intéressant aux combinaisons qui
s’opèrent lors de réactions chimiques.
Grâce à divers résultats expérimentaux et calculs,
l’hypothèse des deux chimistes sera confirmée,
conduisant à la loi d’Avogadro-Ampère : « Dans les
mêmes conditions de température et de pression,
tous les gaz ont le même volume molaire. »
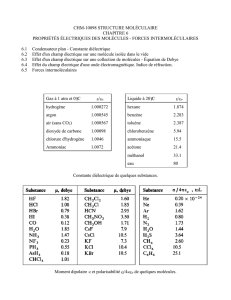
Document 2 : Mesures expérimentales
Pour vérifier la loi d’Avogadro-Ampère, on cherche à déterminer le nombre de molécules de gaz présentes dans
une bouteille de 1,10L et ce, pour différents gaz.
Les résultats sont consignés dans le tableau ci-dessous
O
2
CO
2
CH
4
Masse de la bouteille « vide » 496,23 g 496,23 g 496,23 g
Masse de la bouteille « pleine » 496,38 g 496,87 g 495,65 g
Masse de gaz déterminée 1,45 g 1,94 g 0,72 g
Masse molaire 32 g.mol
-1
44 g.mol
-1
16 g.mol
-1
Masse d’une molécule 5,32.10
-23
g 7,31.10
-23
g 2,66.10
-23
g
Nombre de molécules
Masse de 1,10 L d’air : 1,30 g
Avogadro
AMPère
1
/
1
100%