Télécharger le texte intégral - Thèses

ÉCOLE NATIONALE VETERINAIRE D’ALFORT
Année 2008
ANAPLASMOSE GRANULOCYTAIRE EQUINE :
ENQUETE SERO-EPIDEMIOLOGIQUE
DANS LE SUD-EST DE LA FRANCE EN 2007.
THESE
Pour le
DOCTORAT VETERINAIRE
Présentée et soutenue publiquement devant
LA FACULTE DE MEDECINE DE CRETEIL
le……………
par
Bérénice TILLIETTE
Né (e) le 26 août 1984 à Ivry sur Seine (Val de Marne)
JURY
Président : M.
Professeur à la Faculté de Médecine de CRETEIL
Membres
Directeur : Pr. Boulouis HJ,
Professeur à l’ENVA
Assesseur : Dr. Pradier Sophie,
Maître de conférences à l’ENVA

ANAPLASMOSE GRANULOCYTAIRE EQUINE : ENQUETE SERO-
EPIDEMIOLOGIQUE DANS LE SUD-EST DE LA FRANCE EN 2007.
NOM et Prénom : TILLIETTE Bérénice
Résumé :
L’anaplasmose granulocytaire équine est une maladie infectieuse, non contagieuse, due à la bactérie
Anaplasma phagocytophilum et transmise par les tiques Ixodes spp. Chez le cheval, le tableau clinique de la
maladie est généralement celui d’un syndrome fébrile avec peu de symptômes spécifiques.
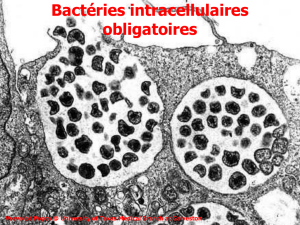
Anaplasma phagocytophilum est une bactérie à la pathogénie unique. Intracellulaire stricte, elle infecte les
granulocytes neutrophiles de nombreux mammifères, dont l’homme. Ce travail s’intéresse donc, dans la
synthèse bibliographique, aux mécanismes dont la bactérie dispose pour se développer chez son hôte.
De plus, nous avons réalisé pour l’année 2007 une enquête séro-épidémiologique qui repose sur la
constitution d’un échantillon de 643 chevaux vivant dans le Sud-est de la France (Gard, Hérault, Bouches du
Rhône). L’analyse sérologique par IFI de ces 643 sérums montre une prévalence pour l’anaplasmose
équine de: - 8,6% (IC95% : 7,5 – 9,7) à l’échelle des chevaux
- 39,3 % (IC95% : 34-45%).à l’échelle des écuries.
Par ailleurs, une enquête équivalente avait déjà été menée en 2001 (Pradier, 2001). La comparaison des
résultats obtenus pour 42 écuries communes à 2001 et 2007 montre une augmentation importante du nombre
d’écuries positives en 2007. Ainsi, il semblerait que l’anaplasmose granulocytaire équine soit une maladie
émergente dans la Sud-est de la France.
Mots clés :
ANAPLASMOSE ANAPLASMA PHAGOCYTOPHILUM EHRLICHIA
TIQUE IMMUNOFLUORESCENCE INDIRECTE SEROLOGIE
EQUIDE ENQUETE EPIDEMIOLOGIQUE CHEVAL
CAMARGUE
Jury :
Président : Pr.
Directeur : Pr. Boulouis
Assesseur : Dr. Pradier
Adresse de l’auteur :
Mlle Bérénice Tilliette
74 rue Diderot, 94300 Vincennes

EQUINE GRANULOCYTIC ANAPLASMOSIS :
EPIDEMIOLOGICAL SURVEY IN THE SOUTH-EAST OF FRANCE IN 2007
SURNAME and Given name: TILLIETTE Bérénice
Summary:
Equine granulocytic anaplasmosis is a tick-borne infectious disease caused by the bacterium Anaplasma
phagocytophilum. Infected horses present a febrile syndrome with few specific symptoms.
Anaplasma phagocytophilum is a unique intracellular bacterium that colonizes polymorphonuclear
leucocytes (neutrphils) of different animal species, including human one’s. A part of this work focuses on
some of the mechanisms that the bacterium uses for disseminating in his host cells.
Moreover, we have done an epidemiological survey on 643 horses living in the South-East of France (Gard,
Hérault, Bouches du Rhône). By immunofluorescence assay analysis of these sera we found a prevalence of
equine granulocytic ehrlichiosis of:
- 8,6% (IC95% : 7,5 – 9,7) for horses,
- 39,3 % (IC95% : 34-45%).for stables.
Furthermore, an equivalent study has already been done in 2001 (Pradier, 2001). Comparison of results
obtained for 42 common stables along the years 2001 and 2007 shew an impressive increase of positive
stables in 2007. In this way, equine granulocytic anaplasmosis could be an emergent disease in South-East of
France.
Keywords :
ANAPLASMOSIS ANAPLASMA PHAGOCYTOPHILUM EHRLICHIA
TICK IMMUNOFLUERESCENCE ASSAY SEROLOGY
EQUIDAE EPIDEMIOLOGICAL SURVEY HORSE
CAMARGUE
Jury :
President : Pr.
Director : Pr. Boulouis HJ.
Assessor : Dr. Pradier S.
Author’s address:
Mlle Tilliette Bérénice
74 rue Diderot, 94300 Vincennes


18 mars 2008
LISTE DES MEMBRES DU CORPS ENSEIGNANT
Directeur : M. le Professeur MIALOT Jean-Paul
Directeurs honoraires : MM. les Professeurs MORAILLON Robert, PARODI André-Laurent, PILET Charles, TOMA Bernard
Professeurs honoraires: MM. BUSSIERAS Jean, CERF Olivier, LE BARS Henri, MILHAUD Guy, ROZIER Jacques, CLERC Bernard
DEPARTEMENT DES SCIENCES BIOLOGIQUES ET PHARMACEUTIQUES (DSBP)
Chef du département : Mme COMBRISSON Hélène, Professeur - Adjoint : Mme LE PODER Sophie, Maître de conférences
- UNITE D’ANATOMIE DES ANIMAUX DOMESTIQUES
Mme CREVIER-DENOIX Nathalie, Professeur
M. DEGUEURCE Christophe, Professeur*
Mme ROBERT Céline, Maître de conférences
M. CHATEAU Henry, Maître de conférences
- UNITE DE PATHOLOGIE GENERALE , MICROBIOLOGIE,
IMMUNOLOGIE
Mme QUINTIN-COLONNA Françoise, Professeur*
M. BOULOUIS Henri-Jean, Professeur
M. FREYBURGER Ludovic, Maître de conférences
- UNITE DE PHYSIOLOGIE ET THERAPEUTIQUE
M. BRUGERE Henri, Professeur
Mme COMBRISSON Hélène, Professeur*
M. TIRET Laurent, Maître de conférences
Mme STORCK-PILOT Fanny, Maître de conférences
- UNITE DE PHARMACIE ET TOXICOLOGIE
Mme ENRIQUEZ Brigitte, Professeur *
M. TISSIER Renaud, Maître de conférences
M. PERROT Sébastien, Maître de conférences
- DISCIPLINE : ETHOLOGIE
M. DEPUTTE Bertrand, Professeur
- UNITE D’HISTOLOGIE , ANATOMIE PATHOLOGIQUE
M. CRESPEAU François, Professeur
M. FONTAINE Jean-Jacques, Professeur *
Mme BERNEX Florence, Maître de conférences
Mme CORDONNIER-LEFORT Nathalie, Maître de conférences
- UNITE DE VIROLOGIE
M. ELOIT Marc, Professeur *
Mme LE PODER Sophie, Maître de conférences
- DISCIPLINE : PHYSIQUE ET CHIMIE BIOLOGIQUES ET
MEDICALES
M. MOUTHON Gilbert, Professeur
- UNITE DE GENETIQUE MEDICALE ET MOLECULAIRE
M. PANTHIER Jean-Jacques, Professeur
Mme ABITBOL Marie, Maître de conférences*
- UNITE DE BIOCHIMIE
M. MICHAUX Jean-Michel, Maître de conférences
M. BELLIER Sylvain, Maître de conférences*
- DISCIPLINE : ANGLAIS
Mme CONAN Muriel, Professeur certifié
DEPARTEMENT D’ELEVAGE ET DE PATHOLOGIE DES EQUIDES ET DES CARNIVORES (DEPEC)
Chef du département : M. POLACK Bruno, Maître de conférences - Adjoint : M. BLOT Stéphane, Maître de conférences
- UNITE DE MEDECINE
M. POUCHELON Jean-Louis, Professeur*
Mme CHETBOUL Valérie, Professeur
M. BLOT Stéphane, Maître de conférences
M. ROSENBERG Charles, Maître de conférences
Mme MAUREY Christelle, Maître de conférences
- UNITE DE CLINIQUE EQUINE
M. DENOIX Jean-Marie, Professeur
M. AUDIGIE Fabrice, Maître de conférences*
Mme GIRAUDET Aude, Praticien hospitalier
Mme MESPOULHES-RIVIERE Céline, Maître de conférences
contractuel
Mme PRADIER Sophie, Maître de conférences contractuel
- UNITE DE REPRODUCTION ANIMALE
Mme CHASTANT-MAILLARD Sylvie, Maître de conférences*
(rattachée au DPASP)
M. NUDELMANN Nicolas, Maître de conférences
M. FONTBONNE Alain, Maître de conférences
M. REMY Dominique, Maître de conférences (rattaché au DPASP)
M. DESBOIS Christophe, Maître de conférences
Mme CONSTANT Fabienne, Maître de conférences (rattachée au
DPASP)
Mme DEGUILLAUME Laure, Maître de conférences contractuel
(rattachée au DPASP)
- DISCIPLINE : URGENCE SOINS INTENSIFS
Mme Françoise ROUX, Maître de conférences contractuel
- UNITE DE PATHOLOGIE CHIRURGICALE
M. FAYOLLE Pascal, Professeur *
M. MAILHAC Jean-Marie, Maître de conférences
M. MOISSONNIER Pierre, Professeur
Mme VIATEAU-DUVAL Véronique, Maître de conférences
Mme RAVARY-PLUMIOEN Bérangère, Maître de conférences (rattachée
au DPASP)
M. ZILBERSTEIN Luca, Maître de conférences contractuel
M. HIDALGO Antoine, Maître de conférences contractuel
- UNITE D’IMAGERIE MEDICALE
Mme BEGON Dominique, Professeur*
Mme STAMBOULI Fouzia, Maître de conférences contractuel
- DISCIPLINE : OPHTALMOLOGIE
Mme CHAHORY Sabine, Maître de conférences contractuel
- UNITE DE PARASITOLOGIE ET MALADIES PARASITAIRES
M. CHERMETTE René, Professeur *
M. POLACK Bruno, Maître de conférences
M. GUILLOT Jacques, Professeur
Mme MARIGNAC Geneviève, Maître de conférences contractuel
Mme HALOS Lénaïg, Maître de conférences
M. HUBERT Blaise, Praticien hospitalier
- DISCIPLINE : NUTRITION-ALIMENTATION
M. PARAGON Bernard, Professeur
M. GRANDJEAN Dominique, Professeur
DEPARTEMENT DES PRODUCTIONS ANIMALES ET DE LA SANTE PUBLIQUE (DPASP)
Chef du département : M. MAILLARD Renaud, Maître de conférences - Adjoint : Mme DUFOUR Barbara, Maître de conférences
- UNITE DES MALADIES CONTAGIEUSES
M. BENET Jean-Jacques, Professeur*
Mme HADDAD/ HOANG-XUAN Nadia, Maître de conférences
Mme DUFOUR Barbara, Maître de conférences
- UNITE D’HYGIENE ET INDUSTRIE DES ALIMENTS
D’ORIGINE ANIMALE
M. BOLNOT François, Maître de conférences *
M. CARLIER Vincent, Professeur
Mme COLMIN Catherine, Maître de conférences
M. AUGUSTIN Jean-Christophe, Maître de conférences
- DISCIPLINE : BIOSTATISTIQUES
M. SANAA Moez, Maître de conférences
- UNITE DE ZOOTECHNIE, ECONOMIE RURALE
M. COURREAU Jean-François, Professeur
M. BOSSE Philippe, Professeur
Mme GRIMARD-BALLIF Bénédicte, Professeur
Mme LEROY Isabelle, Maître de conférences
M. ARNE Pascal, Maître de conférences
M. PONTER Andrew, Maître de conférences*
- UNITE DE PATHOLOGIE MEDICALE DU BETAIL ET DES
ANIMAUX DE BASSE-COUR
M. MILLEMANN Yves, Maître de conférences*
Mme BRUGERE-PICOUX Jeanne, Professeur (rattachée au DSBP)
M. MAILLARD Renaud, Maître de conférences
M. ADJOU Karim, Maître de conférences
Mme CALAGUE, Professeur d’Education Physique * Responsable de l’Unité
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
1
/
106
100%