1S-03 Exercices

1
ère
S www.pichegru.net 10 novembre 2016
- 1 -
Exercices ch.3 : Sources de lumière colorée
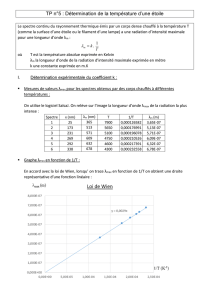
.1 Loi de Wien
1. Rigel est une étoile bleutée de la constellation d’Orion. La longueur
d’onde correspondant au maximum de son émission est dans le domaine
ultraviolet et vaut
λ
max
= 210 nm. Donner une estimation de la
température de surface de cette étoile en degré Celsius.
2. Un souffleur de verre sort la pâte de silice fondue du four à la
température de 1 550 °C.
Calculer la longueur d’onde dans le vide
λ
max
du maximum d’intensité du
rayonnement de la pâte de silice à cette température. Dans quel domaine
se trouve
λ
max
? Pourquoi une partie du rayonnement émis est-il visible ?
3. Les nuages moléculaires interstellaires peuvent avoir une température
d’une dizaine de kelvins. Dans quel domaine du spectre
electromagnétique émettent-ils un rayonnement ?
.2 Une lumière « chaude »
Traversé par un courant électrique, le filament en tungstène d’une
ampoule est porté à 2 700 K. Voici le spectre de la lumière émise.
1. Calculer
λ
max
. Dans quel domaine du spectre électromagnétique se
trouve cette longueur d’onde ? Est-ce cohérent avec le spectre ci-
dessus ?
2. Quelle est la couleur de la lumière solaire ? Expliquer pourquoi la
lumière d’une ampoule à filament apparaît plus rouge que celle du
Soleil.
3. On dit que la lampe à incandescence présente une lumière « plus
chaude » que la lumière du jour. Est-ce cohérent avec la température des
deux sources lumineuses ?
.3 Structure du Soleil
L’intervalle de longueurs d’onde dans le vide [0,50·
λ
max
; 10·
λ
max
]
représente 99 % de l’énergie d’un rayonnement électromagnétique dont
l’intensité maximale se trouve à
λ
max
. C’est le domaine spectral du
rayonnement.
1. Déterminer le domaine spectral :
a. du cœur du Soleil où l’on estime la température de l’ordre de 15
millions de degrés ;
b. de la photosphère solaire qui est la couche gazeuse de quelques
kilomètres d’épaisseur située en surface, de température voisine de
5500 °C.
2. Parmi ces deux domaines spectraux, lequel recouvre le domaine
visible ?
.4 Raies de l’atome d’hydrogène
Les différents niveaux d’énergie E
1
, E
2
, E
3
, etc de l’atome d’hydrogène
sont donnés par la formule : E
n
= – 13,6 / n
2
où E
n
s’exprime en électron-
volt. Le niveau le plus haut, E
ion
= 0, correspond à l’ionisation de
l’atome.
1. Calculer les énergies en électron-volt des niveaux n = 2 à n = 7.
2.a. Calculer les longueurs d’onde minimale et maximale associées aux
transition d’un état d’énergie vers le niveau fondamental (raies de
Lymann).
2.b. Ces rayonnements sont-ils visibles ?
3. Mêmes questions pour les transitions d’un niveau excité n ≥ 3 vers le
niveau 2.
.5 Raies du sodium
Les lampes à vapeur de sodium utilisées pour l’éclairage public émettent
une lumière jaune-orange.
On donne les énergies des niveaux suivants du sodium : niveau 3s : 0
eV ; niveau 3p 1/2 : 2,105 eV ; niveau 3p 3/2 : 2,107 eV ; niveau 4d :
4,293 eV.
1. Représenter les niveaux du sodium sur un diagramme énergétique
sans se soucier de l’échelle.
2. Déterminer en eV l’énergie des photons associés à toutes les
transitions possibles entre les états de ces niveaux d’énergie.
3. Une lampe à vapeur de sodium émet un doublet (c’est-à-dire deux
raies de longueurs d’onde très proches) orange et un autre vert-jaune.
Déterminer les longueurs d’onde dans le vide des quatre radiations.
.6 Spectre du soleil
Spectre (a) et profil spectral (b) du Soleil
Longueurs d’onde dans le vide de quelques radiations émises par des
atomes :
H : 434,0 nm ; 486,1 nm ; 656,3 nm.
Na : 589,0 nm ; 589,6 nm.
Mg : 470,3 nm ; 516,7 nm.
Hg : 435,6 nm ; 546,1 nm.
1. Quel est le phénomène à l’origine des raies noires du spectre solaire ?
2. Comment repère-t-on ce phénomène dans le profil spectral ?
3. Quelles informations sur le Soleil peut-on en déduire ?
4. Quels éléments chimiques le profil spectral permet-il d’identifier dans
l’atmosphère du Soleil ?
intensité
lumineuse
400 500 600 700
λ
(nm)

1
ère
S www.pichegru.net 10 novembre 2016
- 2 -
Correction
Ex.1
1.
≈
⋅
⋅
=
−
−
9
3
10210
109,2
T13800 K
2.
λ
max
≅
1,9 µm. Ceci correspond aux IR. Cependant de la lumière
visible est quand-même émise, car
λ
max
correspond à la longueur d’onde
du maximum d’émission, mais ça ne signifie pas que c’est la seule
longueur d’onde émise.
3.
λ
max
≅
0,3 mm. Cela correspondant plus ou moins à la limite entre les
IR et les microondes.
Ex.2
1.
λ
max
= 1074 nm. Cela correspond au IR. C’est cohérent avec le spectre
montré, car on voit que son maximum se situe au-delà du rouge.
2.
La lumière solaire est blanche. Par contre, la lumière du filament est
beaucoup plus riche en rouge qu’en bleu, d’où une couleur rougeâtre de
cette lumière.
3.
Non, une couleur est dite « chaude » dans le langage courant si ça
teinte est jaune, orange ou rouge. Mais elle est produite par une source
plus froide (le filament) qu’une source de lumière blanche (le soleil).
Ex.3
1.a.
Domaine spectral du cœur du Soleil : de 0,1 nm à 2 nm environ.
1.b.
Domaine spectral de la photosphère : de 250 à 5000 nm environ.
2.
Le visible s’étend entre 400 et 800 nm environ. C’est donc le
deuxième domaine qui le recouvre.
Ex.4
1.
Énergie des différents niveaux en eV
n Énergie (eV)
7 -0,28
6 -0,38
5 -0,54
4 -0,85
3 -1,51
2 -3,40
1 -13,60
2.
La plus petite longueur d’onde émise correspond à la plus grande
énergie perdue, soit le passage du niveau 7 au niveau 1.
λ
7→1
=
=
−
⋅
17
EE ch
93 nm.
Remarque : ne pas oublier de convertir les niveaux d’énergie en joule (1
eV = 1,6·10
-19
J).
La plus grande longueur d’onde correspond à la plus faible perte
d’énergie, soit le passage du niveau 2 au niveau 1 :
λ
2
→
1
= 122 nm.
Aucune de ces radiations ne se trouve dans le visible.
3.
λ
7
→
2
= 398 nm et
λ
3
→
2
= 657 nm. Toutes ces radiations sont dans le
visible.
Ex.5
1.
Diagramme énergétique
2.
Énergie des transitions
4d vers... 3p 3/2 vers... 3p 1/2 vers...
3p 3/2 : 2,186 eV 3p 1/2 : 0,002 eV 3s : 2,105 eV
3p ½ : 2,188 eV 3s : 2,107 eV
3s : 4,293 eV
3.
Les deux raies d’un doublet ont des longueurs d’onde très proche et
donc correspondent à des énergies de transition très voisines.
Un des doublet correspond aux transitions 4d
→
3p 3/2 et 4d
→
3p 1/2
et l’autre correspond aux transition 3p 3/2
→
3s et 3p 1/2
→
3s.
Un calcul n’est pas nécessaire pour attribuer les transitions aux doublets
proposés : le doublet jaune-vert a une longueur d’onde plus faible que
celui qui est orange, et correspond donc à des transitions énergétiques
plus importante, c’est-à-dire la transition 4d
→
3p 3/2 et 4d
→
3p 1/2.
Ex.6
1.
L’absorption
2.
Par des raies noires ou sombres
3.
On peut en déduire les éléments contenus dans la couche gazeuse qui
entoure le soleil (chromosphère).
4.
Éléments identifiables :
Le profil spectral permet d’identifier la présence d’hydrogène et de
sodium.
* On peut éliminer le mercure (Hg) pour cette raie, car l’autre raie du
mercure n’apparaît pas dans le spectre.
4d
3p 1/2
3p 3/2
3s
4,293
2,107
2,105
0
E
(eV)
H ou Hg*
H
? Na
H
1
/
2
100%