MUT BIOGM-LIVRET ENVIRONMENT CONTROL.indd

S
U
R
F
A
C
E
S
A
I
R
D
I
S
P
O
S
I
T
I
F
S
E
A
U
GUIDE PRATIQUE SUR
LE CONTRÔLE
DES INFECTIONS
ENVIRONNEMENTALES
DANS LES HÔPITAUX

3
3
3
Le contenu de ce livret a été rédigé avec l’aimable collaboration
et l’expertise technique du :
Professeur GL French, MD, FRCPath, DipHIC
Consultant honoraire en microbiologie,
’’Guy’s & St Thomas’s Hospital
Professeur émérite de microbiologie,
’King’s College, Londres, Royaume-Uni

1
AIRBORNE TRANSMISSION
1
1
AIRBORNE TRANSMISSION
ll est reconnu, depuis plus d’un siècle, que les patients sont exposés à un risque
d’infection dans les hôpitaux et les établissements de soins de santé. En 1860
déjà, Florence Nightingale écrivait que « la majeure partie des soins infirmiers
consistait à préserver la propreté ». Bien que le respect rigoureux des pratiques
d’hygiène et de propreté de l’environnement soit toujours strictement appliqué
en chirurgie, les règles en matière d’hygiène générale à l’hôpital ont perdu en
rigueur avec l’avènement des antibiotiques et suite à la perception erronée selon
laquelle les infections ne représenteraient plus une menace aussi importante.
Pourtant, les infections constituent un risque croissant pour la sécurité des
patients en raison d’une médecine moderne toujours plus complexe, d’une
vulnérabilité plus grande chez les patients affaiblis par leur âge (sujets
très jeunes et très âgés), immunodéprimés, ayant subi une importante
intervention chirurgicale et en soins intensifs, et de l’émergence d’agents
pathogènes multi-résistants (MDR).
La propagation de gènes de résistance entre bactéries et l’émergence, à
l’échelle mondiale, d’agents pathogènes ultra-multi-résistants sont désormais
reconnues comme étant une urgence de santé publique d’envergure
mondiale qui menace notre capacité à traiter les infections contractées en
milieu hospitalier et à dispenser des soins de santé sûrs et efficaces (Boucher
et al, 2009; European Commission, 2011; World Economic Forum report,
2014). Le contrôle de l’infection croisée est important non seulement pour
réduire l’infection du patient, mais aussi pour réduire la propagation des
agents pathogènes multi-résistants et de leurs gènes de résistance.
En milieu hospitalier, l’air, l’eau, les dispositifs médicaux et les surfaces
sèches constituent autant de sources potentielles de contamination et de
propagation d’infections.
Ce guide pratique a pour objectif de donner une vue d’ensemble des différents
types de transmissions d’origine environnementale des infections hospitalières
et de leur contrôle. Il analyse également les pratiques recommandées pour
optimiser les prélèvements d’échantillons bactériologiques.
Professeur GL French, MD, FRCPath, DipHIC
PRÉFACE
1

2
2
2

3
AIRBORNE TRANSMISSION
3
AIRBORNE TRANSMISSION
3
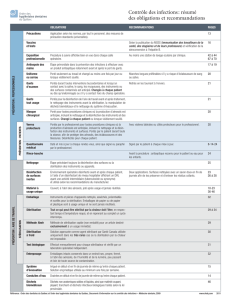
TABLE DES MATIÈRES
INTRODUCTION ..............................................................................................................................................4
TRANSMISSION PAR L’AIR ..........................................................................................6
TRANSMISSION PAR L’EAU ................................................................................. 14
TRANSMISSION PAR LES DISPOSITIFS ................................... 17
MÉDICAUX
TRANSMISSION À PARTIR D’UNE...................................................... 20
SURFACE SÈCHE
GESTION ET ORGANISATION ....................................................................... 30
ÉCHANTILLONNAGE BACTÉRIOLOGIQUE .................... 32
DE L’ENVIRONNEMENT
RÉFÉRENCES ..................................................................................................................................................... 38
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
1
/
44
100%