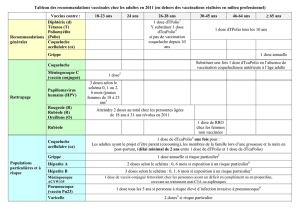
Les vaccinations des usagers de drogues – Drug abusers

Le Courrier des addictions (11) – n ° 4 – octobre-novembre-décembre 2009 14
M
i
s
e
s
a
u
p
o
i
n
t
a
u
p
o
i
n
t
M
i
s
e
s
13 MILLIONS D’usagers
de drogues
La population des usagers de drogues (UD) est
estimée à 13 millions dans le monde et tous
les pays sont confrontés à ce problème de so-
ciété. Ces personnes sont particulièrement à
risque d’acquérir des maladies infectieuses à
transmission parentérale aux premiers rangs
desquels le VIH et les virus des hépatites (B,
C et A), mais aussi le tétanos. La grippe est
également une maladie infectieuse aux consé-
quences potentiellement graves chez ces per-
sonnes, ce qui est d’autant plus prégnant dans
le contexte pandémique actuel.
La prévention contre ces maladies passe par les
programmes d’échange de seringues, la subs-
titution des opiacés, l’éducation à la santé et la
vaccination. La question de l’immunogénicité
– c’est-à-dire l’efficacité immunologique – des
vaccins dans la population des UD a fait l’objet
de plusieurs études, avec des résultats contra-
dictoires. Elle est évaluée par le dosage des
anticorps sériques spécifiques. Mais d’autres
voies de l’immunité sont également activées,
notamment l’immunité à médiation cellulaire,
qui n’est pas évaluée en routine. Plus que l’effi-
cacité immunologique, c’est l’efficacité clinique
qui importe. Or, elle n’est pas toujours corrélée
à une valeur seuil d’anticorps.
* CIC de vaccinologie Cochin-Pasteur, hôpital Cochin,
Paris.
Les vaccinations des usagers de drogues
Drug abusers vaccinations
Pierre Loulergue*
La consommation de drogues reste un problème mondial, quel que soit le stade de déve-
loppement économique du pays. Les consommateurs de drogues sont particulièrement
à risque pour de nombreuses maladies infectieuses, dont certaines sont à prévention
vaccinale. L’efficacité immunologique des vaccins dans cette population est diminuée,
mais il est difficile de conclure à une diminution de l’efficacité clinique. Deux des plus
grands fléaux chez les usagers de drogues (UD), le VIH et le VHC, n’ont pas de vaccins
disponibles pour le moment. Des essais cliniques sont en cours, mais il est nécessaire
de réaliser des essais cliniques également chez les UD qui sont parmi les plus exposés et
chez qui la réponse immunitaire risque d’être différente.
Drug abuse remains a major issue worldwide, whatever the stage of economic development. Drug
users are particularly at risk for many infectious diseases, some of which are preventable by vacci-
nation. The immunological efficacy of vaccines in this population is diminished, but it is difficult to
conclude that a reduction in clinical efficacy. Two of the greatest scourges among drug users, HIV
and HCV, have no vaccine available yet. Clinical trials are ongoing but it is necessary to conduct
clinical trials also among drug users who are among the most exposed and in which the immune
response may be different.
Mots-clés :
Usagers de drogues,
Population à risque, HAV, HBV, VHC, VIH,
Grippe, Tétanos, Réponse immunitaire.
Keywords :
Drug abusers, Population at
risk, HAV, HBV, HCV, HIV, Influenza, Tetanus,
Immune response.
CONTRE LES VIRUS
DES HÉPATITES
Virus de l’hépatite A
L’hépatite A est une maladie à transmission
orofécale dont la prévalence est corrélée au
niveau d’hygiène individuelle et collective du
pays, et donc à son niveau de développement
économique. Les UD sont à risque pour l’hé-
patite A du fait de la transmission parentérale
et d’un contexte socio-économique person-
nel souvent défavorable. Malgré l’existence de
deux vaccins contre l’hépatite A depuis plus
de 10 ans, qui ont tous deux une excellente
efficacité, la couverture vaccinale des consom-
mateurs est largement insuffisante (1). L’hépa-
tite A peut évoluer sur le mode épidémique au
sein de communautés d’usagers de drogue, qui
peuvent être rapidement stoppées par la vacci-
nation massive. Sur le plan sérologique, alors
que l’efficacité est de plus de 90 % chez les per-
sonnes saines après une dose, les UD semblent
nécessiter deux doses pour être suffisamment
couverts. Quaglio et al. ont montré qu’après
une dose, seul un tiers, mais après deux doses,
l’ensemble des patients atteignaient le seuil pro-
tecteur d’anticorps (2).
En France, on recommande un schéma à deux
injections, à J0 et une deuxième injection entre
6 et 12 mois plus tard pour permettre le main-
tien de l’immunogénicité à long terme. Pour
les personnes nées avant 1945, un contrôle
sérologique sera réalisé au préalable, car la
prévalence de l’hépatite A est élevée dans cette
tranche d’âge. Il s’agit d’un vaccin inactivé, condi-
tionné seul (Havrix
®
, Avaxim
®
) ou en associa-
tion avec le vaccin contre l’hépatite B (Twinrix
®
).
Un contrôle sérologique après vaccination est
nécessaire en cas d’immunodépression.
Virus de l’hépatite B
L’hépatite B est un problème majeur de santé
publique dans le monde avec plus de 300 mil-
lions de porteurs chroniques qui risquent de
développer une cirrhose ou un hépatocarci-
nome. Des vaccins existent depuis plusieurs
dizaines d’années, cependant, la couverture
vaccinale des UD est très faible (moins de 30 %)
[3]. C’est le vaccin pour lequel nous avons le
plus de données d’immunogénicité, mais dont
les résultats des études sont contradictoires
(4) : les taux de séroconversion varient de 58 à
100 % en fonction des études. Une étude s’in-
téressant à la persistance des anticorps à long
terme n’a pas montré de différence entre le
taux de personnes protégées 5 ans après vac-
cination chez les UD par rapport à un groupe
témoin (64 % versus 79 %) [5], il n’y a donc
pas de nécessité de faire des doses de rappel.
En outre, des données in vitro indiquent que
même en l’absence d’un taux d’anticorps pro-
tecteur, il peut exister un certain degré de pro-
tection grâce à la mémoire immunitaire (6).
Le calendrier vaccinal français recommande
de vacciner les UD contre l’hépatite B vu leur
surrisque (7). Un contrôle sérologique est né-
cessaire dans cette population.
Les vaccins contre l’hépatite B sont des vac-
cins inertes, fabriqués par génie génétique.
Le schéma vaccinal classique comporte trois
injections (J0, M1, M6), avec un intervalle
d’au moins 1 mois entre les deux premières
injections et entre 5 et 12 mois entre les deux
suivantes. Les rappels ne sont pas recomman-
dés. Un contrôle sérologique sera réalisé en si-
tuation d’immunodépression afin de proposer
des injections complémentaires en cas de non
réponse. Les vaccins sont conditionnés seuls
(Engerix
®
, Genhevac
®
) ou en association avec
le vaccin contre l’hépatite A.
Virus de l’hépatite C
La consommation de drogues est un des fac-
teurs de risque majeurs d’infection par le virus
de l’hépatite C, par ailleurs largement sous-

Le Courrier des addictions (11) – n ° 4 – octobre-novembre-décembre 2009
15
M
i
s
e
s
a
u
p
o
i
n
t
a
u
p
o
i
n
t
M
i
s
e
s
diagnostiquée, même dans les pays industria-
lisés. Comme pour le virus de l’hépatite B, les
conséquences de cette infection chronique
sont la cirrhose et l’hépato-carcinome. Le trai-
tement par interféron alpha et ribavirine pro-
posé actuellement est efficace dans un nombre
non négligeable de cas, selon le génotype
considéré, mais au prix d’effets secondaires im-
portants. Cependant, les risques d’échec et les
possibilités de recontamination font préférer
la solution d’une vaccination. Plusieurs candi-
dats ont fait l’objet d’essais cliniques de phase
I sur le versant thérapeutique de l’hépatite C,
avec des résultats encourageants en termes de
diminution de la charge virale et de tolérance.
Selon les cas, les stratégies se fondent sur la
production d’anticorps neutralisants ou d’une
réponse à la médiation cellulaire. Des essais
de phaseII devraient commencer prochaine-
ment. Le chemin reste toutefois long et incer-
tain avant l’obtention d’un vrai vaccin.
TOUJOURS EN PERSPECIVE
AUSSI, CELUI CONTRE LE VIH
Comme pour l’hépatite C, les UD sont tou-
chés par cette infection depuis le début de
la pandémie. La nécessité d’obtenir un vac-
cin contre le VIH a été comprise dès les an-
nées 1980. Beaucoup de moyens humains
et financiers ont été mobilisés depuis sans
succès pour l’instant. L’annonce récente des
résultats d’un essai de phase II montrant un
certain degré de protection contre l’infection
doit être tempérée par le fait qu’il s’agissait
d’un petit effectif. Des essais cliniques sur
un grand nombre de personnes sont néces-
saires. En outre, il est indispensable de mieux
caractériser la réponse vaccinale contre le
VIH pour permettre la progression dans la
recherche d’un vaccin.
CONTRE CEUX DE LA GRIPPE
La grippe saisonnière est une cause impor-
tante de morbidité et de mortalité chaque
année. Les UD peuvent être à risque à cause
de leur situation sociale précaire, d’un terrain
pulmonaire fréquemment fragilisé par une in-
toxication tabagique et d’un état de dénutri-
tion favorisant les surinfections. La situation
est encore plus préoccupante actuellement
avec la pandémie grippale due au virus A/
H1N1.
Le vaccin de la grippe saisonnière est connu
depuis longtemps et les taux de séroconver-
sion et de séroprotection sont des critères
préalables à l’obtention de la mise sur le mar-
ché : 70 % de la population doit être protégée
(60 % pour les plus de 60 ans). Les études
d’immunogénicité du vaccin antigrippal chez
les UD sont peu nombreuses, mais elles ne
montrent pas de diminution de l’efficacité
immunologique ni de modification de la to-
lérance du vaccin par rapport à la population
générale (8, 9). Concernant la grippe pandé-
mique A/H1N1 2009, il n’y a, pour l’instant,
aucune donnée publiée chez les consomma-
teurs de drogues. La vaccination antigrippale
est recommandée dans ce groupe à cause des
risques de décompensation respiratoire ou de
surinfection bactérienne.
LE TÉTANOS,
TOUJOURS PRÉSENT
Le tétanos est une maladie infectieuse ubi-
quitaire liée à Clostridium tetani. De petites
épidémies sont régulièrement signalées chez
des UD par voie intraveineuse, la transmis-
sion se faisant par des aiguilles souillées.
Le vaccin contre le tétanos existe sous forme
trivalente (associé aux vaccins contre la
diphtérie et la poliomyélite) ou quadrivalente
(mêmes valences associées au vaccin coque-
lucheux acellulaire). Les recommandations
françaises stipulent que la vaccination contre
le tétanos doit se faire avec un rappel tous les
10 ans chez l’adulte. Le tétanos est une mala-
die à déclaration obligatoire en France et doit
faire l’objet d’une notification à la DDASS. Il
convient d’être particulièrement vigilant chez
les UD par voie injectable en vérifiant leur
statut vaccinal et, au besoin, en réalisant une
sérologie pour mettre à jour leur vaccination
si le taux d’anticorps est insuffisant.
La couverture vaccinale antitétanique est
mauvaise chez les consommateurs de dro-
gues, du fait d’un suivi médical irrégulier
(10). Les injections de rappel décennales ne
sont souvent pas réalisées et les taux d’anti-
corps diminuent avec l’âge, rendant certaines
personnes vulnérables à cette infection aux
graves conséquences. Aucune donnée n’in-
dique que le vaccin antitétanique serait
moins immunogène chez les UD.
CONCLUSION
Malgré leur situation à haut risque pour un
certain nombre de maladies à prévention vac-
cinale, les consommateurs de drogues ont des
couvertures vaccinales très insuffisantes. Les
modalités de prise en charge de ces patients
doivent inclure la vaccination, après vérifica-
tion du statut vaccinal, voire après réalisation
de sérologies. Des essais cliniques d’immuno-
génicité des vaccins, mais surtout d’efficacité
clinique, sont nécessaires dans cette popula-
tion particulière, car les quelques données pu-
bliées sont parfois contradictoires. Les autres
mesures prophylactiques chez les UD restent
très importantes, mais la vaccination est un
élément indispensable d’une politique de pré-
vention.
v
Références bibliographiques
1. Poland GA. Evaluating existing recommenda-
tions for hepatitis A and B vaccination. Am J Med
2005;118,Suppl.10A:16S-20S.
2. Quaglio G, Pajusco B, Civitelli P et al. Immunoge-
nicity, reactogenicity and adherence with hepatitis A
vaccination among drug users. Drug Alcohol Depend
2004;74(1):85-8.
3. McGregor J, Marks PJ, Hayward A, Bell Y,
Slack RC. Factors influencing hepatitis B vaccine
uptake in injecting drug users. J Public Health Med
2003;25(2):165-70.
4. Baral S, Sherman SG, Millson P, Beyrer C. Vaccine
immunogenicity in injecting drug users: a systematic
review. Lancet Infect Dis 2007;7(10):667-74.
5. Puvacic S, Ravlija J, Puvacic Z, Curic I. Long term
protection after hepatitis B vaccination. Bosn J Basic
Med Sci 2005;5(3):50-3.
6. Are booster immunisations needed for lifelong he-
patitis B immunity? European Consensus Group on
Hepatitis B Immunity. Lancet 2000;355(9203):561-5.
7. Bulletin Épidemiologique Hebdomadaire. Ca-
lendrier vaccinal 2009 http://www.invs.sante.fr/
beh/2009/16_17/index.htm.
8. Iorio AM, Alatri A, Francisci D et al. Immunoge-
nicity of influenza vaccine (1993-94 winter season) in
HIV-seropositive and -seronegative ex-intravenous
drug users. Vaccine 1997;15(1):97-102.
9. Amendola A, Boschini A, Colzani D et al. In-
fluenza vaccination of HIV-1-positive and HIV-1-
negative former intravenous drug users. J Med Virol
2001;65(4):644-8.
10. Sangalli M, Chierchini P, Aylward RB, Foras-
tiereF. Tetanus: a rare but preventable cause of mor-
tality among drug users and the elderly. Eur J Epide-
miol 1996;12(5):539-40.
1
/
2
100%