Nutrition et immunité

DMV, Responsable des
Éditions Scientifiques,
Communication,
Groupe Royal Canin
DMV, PhD,
Dipl. ACVN, Dipl.
ECVCN
Directeur Scientifique
Nutrition-Santé pour
le Centre de Recherche
Royal Canin
BVSc (Hons) PhD,
Dipl. ACVIM,
Dipl. ACVN
Directrice
Scientifique
Royal Canin aux
États-Unis
Pascale Pibot Vincent Biourge Denise Elliott
Nutrition
Encyclopédie de la
Clinique Féline
Fermez cette fenêtre pour retourner sur IVIS
Ce livre est reproduit sur le site d'IVIS avec l'autorisation de Royal Canin. IVIS remercie Royal Canin pour son soutien.

Immunité
479
Nutrition
et immunité
Nicholas J CAVE
BVSc, MVSc,
MACVSc,
Dipl. ACVN
479
aLA : acide alpha linolénique
AGPI : acide gras polyunsaturé
ARA : acide arachidonique
CAM : molécule d'adhésion cellu-
laire
CD80/CD86 : molécules de costi-
mulation
CMH : complexe majeur d'histo-
compatibilité
COX : cycloxygénase
CPA : cellule présentatrice d’anti-
gène
DGLA : acide dihomo-g-linolé-
nique
EPA : acide eicosapentaénoïque
FHV : feline herpes virus
FIV: virus de l'immunodéficience
féline (feline immunodeficiency
virus)
HETE : acide hydroxyeicosatétraé-
noïque
HPETE : acide hydropéroxy-eicosa-
tétraénoïque
IFN : interféron
Ig : immunoglobuline
IL : interleukine
iNOS : oxyde nitrique synthétase
LOX : lipoxygénase
LPS : lipopolysaccharide
LT : leucotriène
NF-kB: facteur de transcription
nucléaire
NK : cellule tueuse (natural killer)
NO : monoxyde d’azote
NOS : NO synthétase
PAMPS : pathogen associated mo-
lecular patterns
PG : prostaglandine
PPAR : peroxisome proliferator-
activated receptor
SIRS : syndrome de réaction
inflammatoire généralisée (syste-
mic inflammatory response syn-
drome)
TCR : récepteur pour l’antigène
des cellules T (T cell receptor)
TGF b: transforming growth factor
Th1: lymphocyte Th1
Th2: lymphocyte Th2
TLR : toll-like receptor
TNF-a: tumor necrosis factor
TX : thromboxane
A
BRÉVIATIONS UTILISÉES DANS CE CHAPITRE
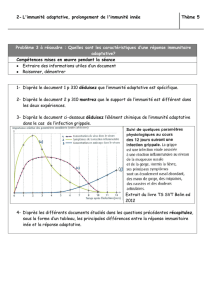
1 - Interactions complexes entre nutrition et immunité . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 481
2 - Le système immunitaire . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 481
3- Besoins nutritionnels du système immunitaire . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 485
4- Conséquences de la malnutrition sur l’immunité . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 488
5- Impact des réponses immunitaires sur le statut nutritionnel . . . . . . . . . . . . . . . . . . . . . . . 489
6- Réponse immunitaire aux antigènes alimentaires (tolérance orale) . . . . . . . . . . . . . . . . . 493
7 - Modulation nutritionnelle de l’immunité . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 497
8 - Influence du mode d’alimentation . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 503
Conclusion . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 504
Questions fréquemment posées . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 505
Références . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 507

480
Il existe peu de maladies, peut-être aucune, où le système
immunitaire ne soit pas relié, à un niveau quelconque, à la
pathogénie. L’implication du système immunitaire peut être
primaire, comme lors de réactions d’hypersensibilité, secondaire
en cas de maladie infectieuse mais le lien est parfois plus indirect
et surprenant comme ce qui concerne le rapport entre obésité et
immunité. La fonction immunitaire comprend aussi bien des
mécanismes de défense simples et innés que des réponses
complexes et adaptatives, spécifiques d’antigènes et faisant
intervenir de nombreuses cellules.
Qu’il s’agisse de réponses basiques ou complexes, le système
immunitaire, comme n’importe quel autre système de
l’organisme, dépend d’un apport alimentaire adéquat et est très
sensible aux déficits et déséquilibres nutritionnels. Cependant,
à la différence d’autres systèmes, les besoins nutritionnels du
système immunitaire varient très rapidement en fonction de
la réplication et des synthèses cellulaires ainsi que d’autres
fonctions exigeantes en énergie. Le système immunitaire est
donc très réactif à la composition de l’aliment, à la fois à court et
à long terme. Étant donné le rôle vital que joue le système
immunitaire pour l’individu, pour ou parfois contre son intérêt
dans certaines affections, il est important de comprendre
comment la nutrition peut affecter l’immunité chez l’animal en
bonne santé et chez l’animal malade. Ce chapitre vise à explorer
certains des aspects les plus importants des relations entre
immunité et nutrition chez le chat.
Nutrition
et immunité
Nicholas J CAVE
BVSc, MVSc, MACVSc, Dipl. ACVN
Nick Cave est diplômé de l’Université de Massey (Nouvelle-Zélande) depuis 1990. Il travaille en clientèle pendant 7 ans avant d’effectuer
un Résidanat en médecine interne et un Master en Sciences Vétérinaires à l’Université de Massey. Il effectue ensuite un Résidanat en nutri-
tion clinique, travaille sur un Doctorat de nutrition et d’immunologie à l’Université de Davis, Californie, et devient Diplomate de l’American
College of Veterinary Nutrition en 2004. Il est maintenant Enseignant Senior en Médecine et Nutrition des petits animaux à l’Université de
Massey.
Immunité

1 - Interactions
complexes entre
nutrition et immunité
La nutrition affecte directement la réponse immunitaire de
trois façons :
1. augmentation ou exagération de la réponse
2. suppression ou limitation de la réponse
3. modification de la nature de la réponse (Figures 1 et 2).
Le caractère bénéfique ou non d’un tel changement dépend du stade de la maladie et du patient lui-
même. Une atténuation de la réaction immunitaire peut s’avérer bénéfique dans les cas d’hypersensi-
bilité (comme la dermatite atopique) ou lors d’une activation exacerbée du système immunitaire
(comme lors du syndrome de réponse inflammatoire généralisée ou SIRS). De la même manière, une
augmentation de la réponse immunitaire peut être utile lors de la prévention ou de l’élimination d’une
infection ou du développement d’une immunité anti-tumorale.
À l’inverse, la modulation de l’immunité peut
être néfaste ou même fatale à l’hôte. L’immuno-
suppression peut aggraver la morbidité voire indui-
re une septicémie en cas d’atteinte infectieuse.
Une augmentation de l’immunité peut amplifier
un état d’autodestruction dans les situations où
l’activation immunitaire est déjà excessive ou mal
régulée (SIRS, hypersensibilité). Il est clair qu’un
aliment unique ne peut pas être adapté à tous les
cas.
Afin de comprendre comment la nutrition modu-
le l’immunité, il faut déjà comprendre quelle est
la nature de l’immunité.
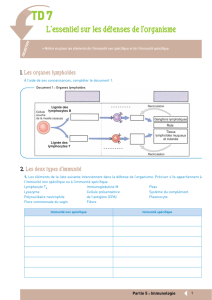
2-Le système
immunitaire
Fonction
Le système immunitaire a évolué afin de défendre
l’organisme contre les agents infectieux, des virus,
bactéries, champignons jusqu’aux gros parasites
pluricellulaires. Les réponses immunitaires varient
d’une fonction de barrière non spécifique à des
réponses phylogénétiquement évoluées, com-
plexes et adaptées qui peuvent inclure la destruc-
tion ou l’élimination de l’agent pathogène (Figu-
re 3). La réponse parfaite à une infection est théo-
riquement de l’éliminer sans dommages pour le
soi. Cependant, les réponses immunitaires ne sont
jamais parfaites et font toujours des dégâts dont
l’intensité varie du caractère indétectable à dis-
proportionné. Au pire ils peuvent être fatals.
Ce concept de base est fondamental dans l’inter-
prétation des effets de la nutrition sur l’immunité.
1 - Interactions complexes entre nutrition et immunité
F
IGURE
1 - N
UTRITION
ET IMMUNITÉ
481
Immunité
F
IGURE
2 - N
UTRITION
,
AGENT PATHOGÈNE
ET IMMUNITÉ
Si l’on prend en compte l’agent
pathogène spécifique ou la
cellule tumorale à l’initiative de la
réponse immunitaire, l’interaction
se révèle encore plus complexe.
IMMUNITÉ INNÉE
IMMUNITÉ ACQUISE
> Destruction microbienne
> Lésion tissulaire chez l’hôte
Explosion oxydative [HOCl O2
-•] [NO•]
Phagocytose
> Migration
Perforines IFN-gTLRs
CD 80/86
IL-4
IL-10
IFN-g
0 heure
6 heures
3 jours 5 jours
12 heures
Prolifération
Prolifération
Eicosanoïdes
[PGE2] [LTB4]
IL-1 TNF-aIL-6
> Réaction
inflammatoire
aiguë
Site d'action : modifications nutritionnelles
Vitamine A, malnutrition protido-calorique
Acides gras polyinsaturés (AGPI)
Antioxydants, malnutrition protido-calorique
Antioxydants, arginine, glutamine, génistéine, caroténoïdes
Glutamine, génistéine, fer
Lutéine, génistéine
Leptine, vitamine E, AGPI
Nutriments présentés dans le Tableau 2, lutéine, génistéine (chez le chat?), cuivre, zinc
Lutéine, vitamine A, fer
Nutrition Immunité
Nutrition
Immunité
Agent
pathogène
Les liens entre la nutrition et
l’immunité sont complexes et pas
complètement élucidés. Un concept
de base important est le caractère
bi directionnel de cette interaction.
F
IGURE
3 - C
ARACTÉRISTIQUES ET FONCTIONS
DE L
’
IMMUNITÉ NATURELLE ET DE L
’
IMMUNITÉ ACQUISE
Points clés de la modulation nutritionnelle

Aspects généraux
de la réponse immunitaire
> L’immunité naturelle
Les mécanismes anatomiques et physiologiques en
place avant la première exposition et qui contribuent
à l’immunité sont qualifiés “d’innés”. Beaucoup de ces
mécanismes sont primitifs (lysozyme, phagocyte),
alors que d’autres plus complexes existent seulement
chez les vertébrés et sont encore plus sophistiqués
chez les mammifères (ex : cellules natural killer ou NK)
(Tableau 1).
Chez les mammifères, le rôle initial de l’immunité
naturelle est d’éliminer les micro-organismes lorsque
cela est possible. Lorsqu’une infection survient, la
réponse naturelle conduit à un ou tous les résultats
suivants :
1. élimination de l’infection
2. limitation de la progression de l’infection (grâce à
des dispositifs “ralentisseurs”)
3. stimulation de l’immunité acquise avec production
d’une réponse inflammatoire précoce à l’infection.
L’immunité naturelle procure donc les “signaux de
danger” qui donnent l’alerte et activent les
réponses immunitaires acquises.
La reconnaissance des microbes
Les cellules de l’immunité naturelle possèdent des
récepteurs évolués qui reconnaissent des molécules
phylogénétiquement conservées. Ces profils molécu-
laires sont dénommés pathogen associated molecular
patterns ou PAMPS. Des exemples de PAMPS sont les
lipopolysaccharides (LPS) contenus dans la paroi des
bactéries gram négatif, l’acide lipotéichoïque contenu
dans la paroi des bactéries gram positif et la double
chaîne d’ARN des virus. Les récepteurs des PAMPS
incluent les récepteurs scavenger (récepteurs éboueurs),
les récepteurs au mannose et la famille des récepteurs
toll-like (TLR) (Akira, 2003). À ce jour, 10 TLR sont
connus chez les mammifères mais l’expression de ces
10 types de TLR n’est pas encore décrite chez le chat.
La plupart des TLR sont des protéines membranaires,
bien que le TLR9 se lie à un ligand intracellulaire
(ADN bactérien). La fixation d’un TLR à son ligand
entraîne l’apparition du facteur de transcription
nucléaire NF-kB, qui pénètre dans le noyau et se lie à
des sites spécifiques sur l’ADN de la cellule hôte,
conduisant à la transcription de gènes pro inflamma-
toires divers. Dans les macrophages et les neutrophiles,
ces gènes codent pour des cytokines (tumor necrosis fac-
tor ou TNF-a, IL-1 et IL-12), des molécules d’adhésion
(E-sélectine), la cycloxogénase (COX), l’oxyde
nitrique synthétase (iNOS), et sur les macrophages les
molécules de costimulation, CD80 et CD86, expri-
mées à la surface des macrophages.
T
ABLEAU
1 - E
LÉMENTS CLÉS DE L
’
IMMUNITÉ INNÉE
Composant Exemples Fonctions
Sécrétions épithéliales Élimination de l’infection, transport
de molécules antimicrobiennes
Barrières épithéliales Élimination de l’infection
Molécules antimicrobiennes défensines, lysozyme Destruction microbienne
Anticorps naturels IgM Opsonisation, fixation du complément
Phagocytes neutrophiles,
macrophages Phagocytose et destruction des microbes
Cellules tueuses cellules “Natural
Killer” (NK)
Lyse des cellules infectées ou néoplasiques,
activation des macrophages
Protéines de la coagulation thrombine Confinement physique des microbes
Complément Destruction des microbes, opsonisation,
chimiotactisme, activation des leucocytes
Protéine C-réactive Opsonisation
F
IGURE
4 - L
IGANDS ET EFFETS DES SIGNAUX ÉMIS
PAR LES
T
OLL
L
IKE
R
ECEPTORS
(TLR)
La voie classique de signalement après l’implication des TLR est l’activation du facteur de
transcription nucléaire NF-kB. Le dimère NF-kB activé diffuse ensuite dans le noyau où il
permet la transcription d’un nombre varié de gènes pro-inflammatoires.
NOYAU
CYTOPLASME
Bactéries gram +
Acide lipotéichoïque
Agent viral à
double ARN
• ADN viral: herpès
• Séquences bactériennes
CpG ADN
Phosphorylation par
la tyrosine kinase
NF-kB
TLR4
TLR1
TLR3
TLR9
TLR2
Facteur de transcription
nucléaire NF-kB
TNFa
COX2
CD80/86
iNOS
Bactéries gram -
Lipopolysaccharide
482
Immunité
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
1
/
32
100%