11 La réplication de l`ADN

1
11 La réplication de l’ADN
11.1 Le cycle cellulaire
Les cellules passent la majorité de leur
temps en phase G0 (copie d’ADN en
ARN).
Lorsqu’elles se divisent, elles doivent
doubler leur ADN (copie d’ADN en
ADN), afin que les deux nouvelles
cellules obtenues soient identiques.

2
Chaque brin de l’hélice bicaténaire sert de matrice à la synthèse d’un brin fils.
Chaque molécule fille d’ADN contient un brin parental et un brin fils nouvellement synthétisé.
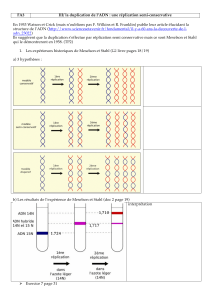
11.2 La réplication de l’ADN est semi-conservatoire
1) hélicase
2) polymérase
molécule parentale molécules filles

3
(a) Pendant la synthèse d’ADN, le
désoxyribonucléotide 5’-phosphate à placer
forme des liaisons hydrogènes avec un résidu
du brin parental et devient ainsi une base
appariée. Il se forme ensuite un lien
phosphodiester entre ce nouveau nucléotide
et le résidu terminal de la chaîne naissante
d’ADN avec départ de Ppi.
(b) Le squelette phosphoglucidiqueprovient
d’un transfert du groupe nucléotidyle d’un
désoxynucléoside5’-triphosphate (dNTP) à
l’hydroxyle 3’ du résidu nucléotidyle
terminal de la chaîne d’ADN en formation.
Après le départ du pyrophosphate, l’ADN
polymérase se déplace d’un résidu, un
nouveau dNTP se fixe et l’enzyme enclenche
le transfert du groupe nucléotidyle suivant,
allongeant la chaîne d’une autre unité
nucléotidique.
Description de la chimie de la
réplication de l’ADN

4
Pour un ADN de procaryote circulaire, deux réplisomes ou réplicateurs vont en sens inverse à partir
d’une origine commune. Pour un ADN d’eucaryote linéaire et de beaucoup plus grande taille, la
réplication démarre en un très grand nombre de sites (jusqu’à 6000 fourches de réplication).
11.3 La réplication de l’ADN est bi-directionnelle
procaryote eucaryote

5
Il existe 3 ADN polymérases :
l’ADN polymérase I,
l’ADN polymérase II (rôle
inconnu) , et;
l’ADN polymérase III qui effectue
son action à la fourche de
réplication.
11.4 Mécanismes à la fourche de réplication
La sous-unité αinsère 1 base erronée sur 10,000. L’unité εcorrige ces défauts avec un taux
d’erreur de 1 sur 1,000. Le taux d’erreur global est donc de 10–7.
L’holoenzyme d’ADN polymérase III
catalyse l ’addition de 1000
nucléotides par seconde à 37°C.
La sous-unité αprovoque
l’allongement de l’ADN par
incorporation successive des résidus
complémentaires à ceux du brin
parental (il faut du Mg2+).
La sous unité e possède une activité
d’exonucléase 3’→5’.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%