2009-2010 Mr Ferchiou

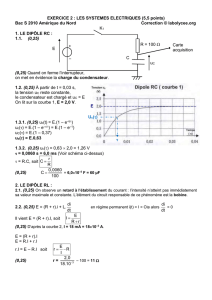
1/4
LYCEE PILOTE BOURGUIBA
-Tunis-
DEVOIR DE
CONTRÔLE
(2eme Trimestre)
Date : 22-Janvier-2009
Durée : 2 heures
Classes : 4éM3
Ref :4é-Dc2-2008-2009
FERCHIOU
CHIMIE (7 points)
Exercice 1 (3 points) Loi de modération
On étudie à une température T et à une pression P un système contenant initialement
n0 mol de N2O4. Pour P=1bar et T comprise entreT1= 25°C et T2=45°C N2O4 se dissocie
selon l’équation N2O4 ; ; 2NO2
Une méthode expérimentale permet de déterminer la constante d’équilibre K et le taux
d’avancement à la température T1 et à la température T2 .Les résultats sont donnés
dans le tableau suivant :
T en °C
25
45
0,148
0,356
K
0,14
0,58
1) a) Dresser un tableau décrivant l’évolution du système chimique au cours de la
réaction de dissociation de N2O4.
b) Déterminer l’expression de K en fonction de n0, et V. Avec V volume du
mélange.
2)
a) Enoncer la loi de modération.
b) En utilisant les données du tableau ci-dessus. Déterminer le caractère énergétique
de la réaction de synthèse du peroxyde d’azote N2O4.
c) Quelle est l’influence d’une diminution de pression à température constante sur cet
équilibre? Justifier.
3) Le mélange initial formé de n0=0,05 mol de N2O4, évolue pour atteindre un équilibre
dynamique à la température T1.On élève ensuite la température pression constante du
mélange obtenu à jusqu’à la valeur T2.Déterminer la composition molaire du mélange à
la température T2.En déduire la valeur du volume V du mélange à l’équilibre à la
température T2.
Exercice 2 : (4 points) Constante d’équilibre d’une réaction acide-base
Données: pKA des couples acide / base :
Acide méthanoïque HCOOH(aq) / ion méthanoate HCOO –(aq) : pKA1 = 3,8
Acide benzoïque C6H5COOH (aq) / ion benzoate C6H5COO –(aq) : pKA2 = 4,2
On dispose de solutions aqueuses d'acide méthanoïque et d'acide benzoïque de
même concentration molaire en soluté apporté c = 10– 2 mol.L-1. La mesure du pH d'un
volume V = 10 mL d’une solution aqueuse d'acide méthanoïque donne pH1 = 2,9

2/4
A- Etude de la réaction de l'acide méthanoïque avec l'eau.
1) Écrire l'équation bilan de la réaction l'acide méthanoïque avec l'eau.
2) Dresser un tableau descriptif de l'évolution du système chimique.
3) Calculer l’avancement final xf, l’avancement maximal xMax; et en déduire son taux
d'avancement final. Conclure.
4) Donner l’expression de la constante d’acidité du couple HCOOH(aq)/HCOO–(aq).
B-
Soit la réaction chimique suivante :
HCOOH (aq) + C6H5COO - (aq) ; ; HCOO -(aq) + C6H5COOH(aq)
1) Exprimer la constante d'équilibre de cette réaction en fonction de pKA1 et pKA2 puis
calculer sa valeur.
2. On dispose de solutions aqueuses d'acide méthanoïque et de benzoate de sodium de
même concentration molaire C et de solutions aqueuses d'acide benzoïque et de
méthanoate de sodium de même concentration molaire C'. On admettra que, dans leurs
solutions aqueuses respectives :
[HCOOH (aq)] = C ; [C6H5COO-(aq)] = C ; [C6H5COOH (aq)] = C';[HCOO-(aq)] = C'.
On réalise un mélange formé d’un volume v de chacune des solutions indiquées ci-
dessus.
a) Les concentrations molaires C et C', sont telles que C= 10–2 mol.L-1 et
C' = 5.10–3 mol.L-1.Dans quel sens va évoluer spontanément le système chimique
juste après le mélange des quatre solutions.
b) En gardant la même valeur de C, quelle valeur faudrait-il donner à C' pour que le
système soit en équilibre à l’état initial ?
PHYSIQUE (13 points)
Exercice 1 (5 points) Oscillations libres
On considère le circuit schématisé ci-contre, renferment un générateur de tension idéale
de force électromotrice E = 6 V, une bobine d'inductance L et de résistance r = 10, un
conducteur ohmique de résistance R variable, un condensateur de capacité C = 0,47 μF
et un commutateur K.
A l'aide d'un oscilloscope, on visualise enregistre les variations de la tension aux bornes
du condensateur.
1) l’interrupteur K étant fermé depuis longtemps sur la position 1, on le bascule sur
la position 2 à la date t=0. Etablir l'équation différentielle vérifiée par la tension
uC(t).
E
K
2
C
L, r
R
i
uC
1

3/4
2) On fixe la valeur de R a une valeur R1, on obtient sur l’oscillogramme suivant.
a) Déterminer la pseudo période T des oscillations du circuit et en déduire la
valeur de l’inductance L de la bobine.
b) Quel est l’effet de la valeur de la résistance R sur les oscillations ?
Représenter l’allure de la courbe uc=f(t) pour R2>>R1.
3)
a) Calculer la valeur de l'énergie totale E1 du circuit à la date t1 = 0.
b) Calculer la valeur de l'énergie totale E2 du circuit après trois oscillations.
c) Comparer E1 et E2, conclure.
d) Sachant que le rapport
Error!
=
Tot 2 1
-R (t -t )
e
, déterminer la valeur de R.
Exercice 2 ( 8 points ) Oscillations forcées
Un montage électrique est formé par une association en série, d’un dipôle résistor de
résistance R, d’une bobine purement inductive et d’un condensateur de capacité C.
L’ensemble est alimenté par un générateur de tension alternative uG(t) =UGMax sin(t)
de fréquence f réglable et qui maintient à ses bornes une tension efficace UG constante.
Un oscilloscope bi-courbe convenablement branché permet de visualiser simultanément
les tensions uG(t) et la tension uC(t) aux bornes du condensateur.
1) Faire le schéma d’un montage qui permet de visualiser la tension uG(t) sur la voie A
et la tension uc(t) sur la voie B .On indiquera les branchements nécessaires sur le
schéma.
2) Etablir l’équation différentielle vérifiée par l’intensité du courant i(t)=IMax.sin(t+).
3) Montrer que l’amplitude IMax est maximale pour une valeur particulière R de la
pulsation e du générateur. Exprimer R en fonction de L et C. Faire une construction de
Fresnel sans souci d’échelle.
4) On fixe la valeur de la fréquence du générateur à une valeur f1.
uc(V)
t(ms)
0
3
2

4/4
On observe sur l’oscilloscope les oscillogrammes (A) et (B) représentés sur la figure
ci après .Un ampèremètre branché en série dans le montage indique la valeur
I=
2
.10-2 A.
(B)
(A)
2V
a- Identifier les oscillogrammes A et B. justifier clairement votre réponse.
b- Déterminer le déphasage =u)-uc).
c- En déduire le déphasage entre la tension uG(t) et l’intensité i(t).
5) a- Déterminer les expressions instantanées des tensions uc(t), uG(t) et de l’intensité
i(t). On prendra f1=125Hz.
b- Déterminer la valeur de la capacité C du condensateur.
6) Calculer la puissance moyenne fournie par le générateur.
7) Faire une construction de Fresnel à l’échelle, relative tensions maximales aux bornes
des dipôles du montage. En déduire les valeurs de R et de L.
Echelle : 1 cm ; 1 V
-Fin du sujet-
1
/
4
100%