etude de la concentration pulmonaire en corps asbestosiques dans

1
UNIVERSITE PARIS VAL-DE-MARNE
FACULTE DE MEDECINE DE CRETEIL
***********
ANNEE: 2007 N°
THESE
POUR LE DIPLOME D’ETAT
DE
DOCTEUR EN MEDECINE
Discipline: Médecine du Travail
Présentée et soutenue publiquement le 26 avril 2007
à la faculté de médecine René Descartes (PARIS 5)
Par Anne-Laure DUFET
Née le 14 avril 1978
ETUDE DE LA CONCENTRATION PULMONAIRE
EN CORPS ASBESTOSIQUES
DANS DEUX SERIES
DE PATIENTS ATTEINTS DE
CANCER BRONCHO-PULMONAIRE
Directeur et Président de thèse:
Professeur Jean-Claude PAIRON
Le conservateur de la bibliothèque
universitaire:

2
REMERCIEMENTS
A Jean-Claude PAIRON pour sa patience et ses nombreux conseils.
Au Laboratoire d’Etude des Particules Inhalées (LEPI) pour toutes les informations
transmises pour la réalisation de ce travail.
A Soizick CHAMMING’S et toute l’équipe de l’Institut Interuniversitaire de Médecine du
Travail de Paris Ile-de-France (IIMTPIF) pour leur gentillesse et leur disponibilité.
A Yuriko IWATSUBO pour toutes les analyses statistiques qu’elle a bien voulu effectuer
pour cette étude.

3
SOMMAIRE
LISTE DES ABREVIATIONS .................................................................................................. 5
LISTE DES TABLEAUX .......................................................................................................... 7
LISTE DES FIGURES ............................................................................................................... 9
INTRODUCTION .................................................................................................................... 14
1 L’AMIANTE: GENERALITES, PATHOLOGIES ET METHODES D’EVALUATION
DES EXPOSITIONS ................................................................................................................ 16
1.1 Généralités sur l’amiante .............................................................................................. 16
1.1.1 Définition ................................................................................................................. 16
1.1.2 Caractéristiques physico-chimiques et devenir des fibres d’amiante dans le tractus
respiratoire ................................................................................................................................ 16
1.1.3 Utilisation de l’amiante et situations d’exposition ................................................... 18
1.2 Pathologies liées à l’amiante ........................................................................................ 19
1.2.1 Pathologies liées à l’amiante en dehors du cancer broncho-pulmonaire .................. 21
1.2.1.1 Mésothéliome ........................................................................................................... 21
1.2.1.2 Asbestose .................................................................................................................. 24
1.2.1.3 Fibrose pleurale d’origine asbestosique ................................................................... 25
1.2.1.4 Cancers de localisations extra-thoraciques............................................................... 28
1.2.2 Cancer broncho-pulmonaire ..................................................................................... 28
1.2.2.1 Généralités sur le cancer broncho-pulmonaire ......................................................... 28
1.2.2.2 Cancer broncho-pulmonaire lié à l’amiante ............................................................. 31
1.3 Méthodes d’évaluation des expositions à l’amiante ..................................................... 35
1.3.1 Méthodes d’évaluation des expositions à l’amiante en dehors des données
métrologiques ........................................................................................................................... 36
1.3.1.1 Outils prévus par la réglementation ......................................................................... 36
1.3.1.2 Questionnaires .......................................................................................................... 37
1.3.1.3 Matrices emploi-exposition (MEE) .......................................................................... 38
1.3.1.4 Bases de données documentaires ............................................................................. 38
1.3.2 Méthodes utilisant des résultats de métrologie ........................................................ 38
1.3.2.1 Recherche et quantification des fibres d’amiante dans les matériaux ...................... 38
1.3.2.2 Recherche et quantification des fibres d’amiante en suspension dans l’air ............. 39
1.3.2.3 Recherche et quantification des fibres d’amiante dans les produits biologiques:
biométrologie ........................................................................................................................... 41
2 OBJECTIFS DE L’ETUDE ............................................................................................. 46
2.1 Objectif principal .......................................................................................................... 46
2.2 Objectifs secondaires .................................................................................................... 46
3 PATIENTS ET METHODES .......................................................................................... 47
3.1 Sélection des patients et paramètres recueillis ............................................................. 47
3.2 Technique d’analyse biométrologique ......................................................................... 48
3.3 Recueil et expertise des informations sur les expositions professionnelles ................. 49
3.4 Analyse statistique ........................................................................................................ 51

4
4 RESULTATS ................................................................................................................... 54
4.1 Paramètres socio-démographiques et tabagisme .......................................................... 54
4.1.1 Age ........................................................................................................................... 54
4.1.2 Sexe .......................................................................................................................... 55
4.1.3 Tabagisme ................................................................................................................ 56
4.2 Concentrations pulmonaires en corps asbestosiques (groupe A et groupe B) ............. 58
4.2.1 Concentrations pulmonaires moyennes, concentrations pulmonaires médianes et
distribution des sujets en fonction des classes de rétention pulmonaire en corps asbestosiques
(groupe A et groupe B) ............................................................................................................. 58
4.2.2 Evolution des concentrations pulmonaires en corps asbestopsiques et de leur
distribution au fil du temps ....................................................................................................... 60
4.3 Analyses selon les types histologiques (groupe A) ...................................................... 63
4.3.1 Distribution des types histologiques des cancers broncho-pulmonaires (groupe A) 63
4.3.2 Rétention pulmonaire en corps asbestosiques et index d’exposition cumulée à
l’amiante en fonction des types histologiques de cancer broncho-pulmonaire (groupe A) ..... 64
4.4 Corrélation entre l’index d’exposition cumulée et la concentration pulmonaire en
corps asbestosiques (groupe A) ................................................................................................ 68
4.5 Corrélation entre le délai écoulé depuis la fin de la dernière exposition professionnelle
à l’amiante et la concentration pulmonaire en corps asbestosiques (groupe A) ...................... 69
4.6 Concentrations pulmonaires en corps asbestosiques et expositions professionnelles .. 69
4.6.1 Expositions professionnelles des sujets du groupe A ............................................... 69
4.6.2 Expositions professionnelles des sujets du groupe B ............................................... 78
5 DISCUSSION .................................................................................................................. 81
5.1 Aspects méthodologiques ............................................................................................. 81
5.1.1 Populations étudiées ................................................................................................. 81
5.1.2 Prélèvements et analyses minéralogiques ................................................................ 83
5.1.3 Evaluation des expositions ....................................................................................... 84
5.2 Résultats observés ........................................................................................................ 85
5.2.1 Résultats concernant les deux groupes de l’étude, A et B........................................ 85
5.2.2 Résultats concernant uniquement le groupe A ......................................................... 91
5.2.3 Résultats concernant uniquement le groupe B ......................................................... 97
CONCLUSION ........................................................................................................................ 98
BIBLIOGRAPHIE ................................................................................................................... 99
ANNEXE 1 ............................................................................................................................ 113
ANNEXE 2 ............................................................................................................................ 115
ANNEXE 3 ............................................................................................................................ 116
ANNEXE 4 ............................................................................................................................ 117
ANNEXE 5 ............................................................................................................................ 118
ANNEXE 6 ............................................................................................................................ 120
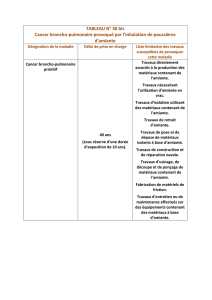
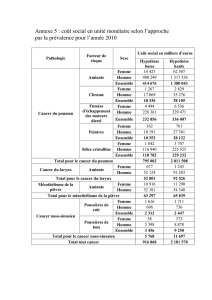
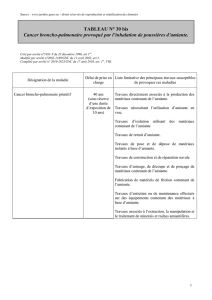
ANNEXE 7 ............................................................................................................................ 122
ANNEXE 8 ............................................................................................................................ 125
ANNEXE 9 ............................................................................................................................ 126
ANNEXE 10 .......................................................................................................................... 127

5
LISTE DES ABREVIATIONS
BCME: Bis(ChloroMéthyl) Ether
BIT: Bureau International du Travail
CA: Corps Asbestosiques
CITI: Classification Internationale Type par Industrie de toutes les branches
d’activité économique
CITP: Classification Internationale Type des Professions
CIRC: Centre International de Recherche sur le Cancer
CMME : ChloroMéthyl Méthyl Ether
CNAMTS: Caisse Nationale de l’Assurance Maladie des Travailleurs Salariés
COFRAC: COmité FRAnçais d’ACcréditation
DREES: Direction de la Recherche, des Etudes, de l'Evaluation et des Statistiques
ERS: European Respiratory Society
f: fibres
FIVA: Fonds d’Indemnisation des Victimes de l’Amiante
g: gramme
HEI-AR: Health Effects Institute-Asbestos Research
IARC: International Agency for Research on Cancer
IIMTPIF: Institut Interuniversitaire de Médecine du Travail de Paris Ile-de-France
INRS: Institut National de Recherche et de Sécurité
INSEE: Institut National de la Statistique et des Etudes Economiques
INSERM: Institut National de la Santé Et de la Recherche Médicale
InVS: Institut de Veille Sanitaire
IRM: Imagerie par Résonance Magnétique
L: Longueur
LBA: Lavage Broncho-Alvéolaire
LEPI: Laboratoire d’Etude des Particules Inhalées
ml: millilitre
MEBA: Microscopie Electronique à Balayage Analytique
MEE: Matrice Emploi-Exposition
MET: Microscope Electronique à Transmission
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
1
/
130
100%